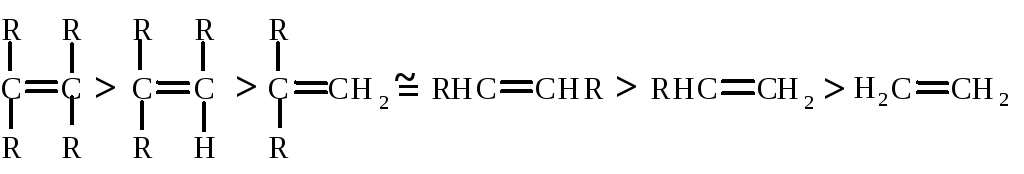- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды. Галогенпроизводные углеводородов
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
- •И.С. Колпащикова, е.Р.Кофанов, е.М.Алов
- •Углеводороды.
- •Галогенпроизводные углеводородов
4.4.1. Гидрирование. Теплота гидрирования
В процессе гидрирования алкена происходит разрыв -связи и связи Н–Н и образование двух связей С–Н:
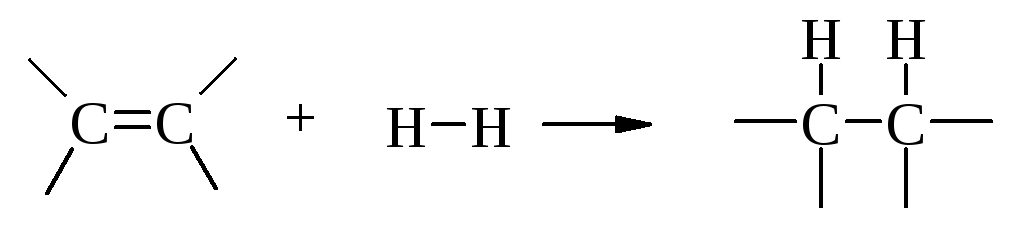
Количество теплоты, выделяющейся при гидрировании одного моля ненасыщенного соединения, называется теплотой гидрирования. Этен и другие алкены в обычных условиях не реагируют с газообразным водородом вследствие высокой энергии активации Еакт. (рис. 4.5).

Рис. 4.5. Энергетическая диаграмма реакции гидрирования двойной связи
В присутствии катализаторов алкены легко гидрируются в алканы. Теплота гидрирования в присутствии катализатора остаётся такой же, как и без катализатора. Изменяется лишь Еа, катализатор понижает энергетический барьер между исходными веществами и переходным состоянием. Катализатор, понижая энергию активации, направляет реакцию по особому механизму.
Обычно в качестве катализатора гидрирования используют тонко измельчённые металлы VIII группы: платину, палладий, рутений, родий, никель. Реагенты адсорбируются на поверхности катализатора, где и происходит реакция. Предполагают, что алкен взаимодействует с поверхностью металла с разрушением -связи. Водород также адсорбируется на поверхности металла, и связь Н-Н ослабляется. Тогда гидрирование алкена можно представить как одновременное присоединение двух атомов водорода к двум углеродным атомам (рис. 4.6). Образующийся алкан не обладает сродством к поверхности металла и десорбируется с неё. Освободившиеся места на поверхности занимают новые молекулы алкена и водорода.

Рис. 4.6. Гидрирование этена
С*, H* - атомы углерода и водорода, активированные на поверхности катализатора
Уменьшение энергетического барьера прямой реакции также понижает энергию активации и обратной реакции и таким образом увеличивает скорость обратной реакции - дегидрирования. Катализатор в одинаковой степени ускоряет и прямую и обратную реакции, т.е. способствует более быстрому наступлению равновесия между исходными и конечными продуктами, но не сдвигает равновесия.
Платина, палладий, никель в соответствующих условиях служат и катализаторами дегидрирования. Каталитическое гидрирование ведется обычно в избытке водорода, что замедляет обратный процесс дегидрирования.
4.4.2. Теплота гидрирования и устойчивость алкенов
Теплоты гидрирования дают информацию об относительной устойчивости алкенов. Для сравнения устойчивости алкенов нужно сопоставить теплоты гидрирования различных алкенов для одного и того же алкана в равных условиях.
Например, сравним теплоты гидрирования 1-бутена, цис-2-бутена и транс-2-бутена. В реакциях поглощается 1 моль водорода и образуется один и тот же продукт – н-бутан.
При гидрировании транс-изомера выделяется на 4 кДж/моль энергии меньше, чем при гидрировании цис-изомера. Это означает, что содержание энергии в нем на 4 кДж/моль меньше, т.е. другими словами, транс-изомер на 4 кДж/моль устойчивее цис-изомера. В транс-изомере два объёмистых заместителя расположены по разные стороны от двойной связи, пространственные препятствия меньше, чем в случае цис-изомера. В свою очередь, оба геометрических изомера 2-бутена более устойчивы, чем 1-бутен (рис. 4.7).
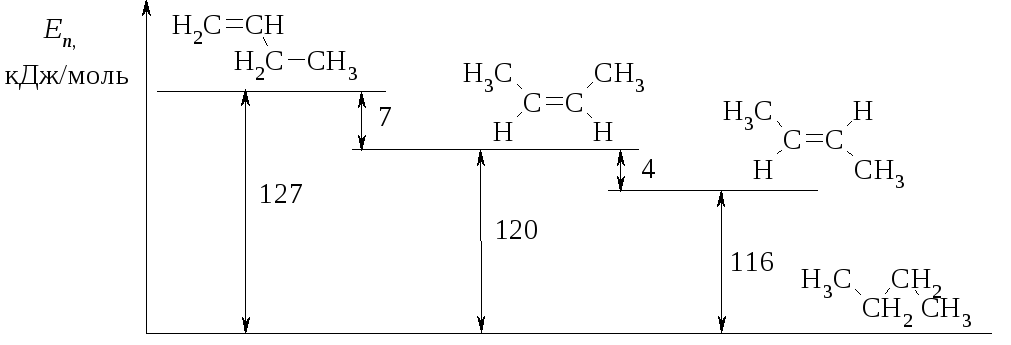
Рис. 4.7. Теплоты гидрирования изомеров бутена
Сравним теплоты гидрирования (кДж/моль) алкенов, которые при взаимодействии с водородом дают 2-метилбутан.
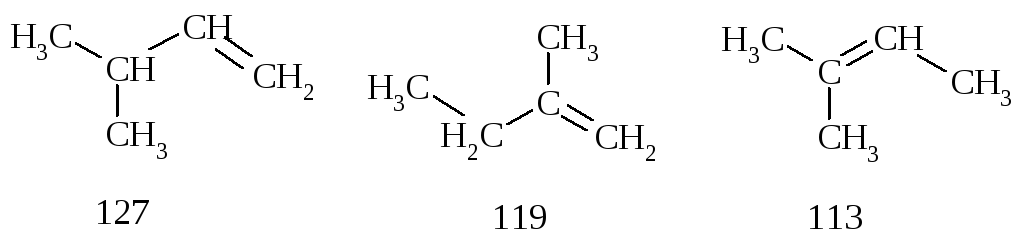
Различие в теплотах гидрирования обусловлено их различной устойчивостью.
|
Чем больше степень алкилирования атомов углерода при двойной связи, тем более устойчив алкен: |
|
|
Различная устойчивость алкенов может быть объяснена неодинаковой возможностью распределения электронной плотности в молекулах с различным числом метильных групп при углеродах у двойной связи. Электроны -связи углерод – водород метильной группы частично перекрываются с электронами -связи (гиперконъюгация). Такое электронное взаимодействие ведет к уменьшению энергии молекулы.

К объяснению изменения устойчивости алкенов в приведенном ряду также может быть привлечено представление о различии энергий и длин связей, образованных sp3- и sp2-гибридизованными атомами углерода.

В 2-бутене имеются две более короткие и более прочные -связи Сsp3–Сsp2 , а в 1-бутене – только одна такая связь.