
Рябов Г.А. - Синдромы критических состояний - 1994
.pdfявляется составной частью интерстициальной жидкости и предназначена в основном для транспорта химических крупномолекулярных субстратов, главным образом белков, а также (частично) жировых конгломератов и углеводов из интерстициального пространства (куда они проникают из клеток) в кровь. На терминальных концах лимфатических сосудов имеются клапаны, которые регулируют этот процесс. Движение лимфы по сосудам осуществляется за счет насосного действия миоэндотелиальных волокон, функционирующих синхронно с клапанным аппаратом, расположенным по всей длине лимфатического сосуда. Лимфатическая система обладает также концентрационной функцией, поскольку осуществляет реабсорбцию воды в зоне венозного конца капилляра.
Быстрое удаление белков из интерстициального пространства снижает тканевое коллоидно-осмотическое давление (КОД). Этот механизм вместе с насосной функцией лимфатической системы обеспечивает слабоотрицательное гидростатическое давление (около 6 мм рт. ст.) в интерстициальном пространстве [Guyton А. С. et al., 1971]. Значение отрицательного давления в интерстициальном пространстве переоценить невозможно, поскольку оно не только определяет клеточную архитектуру, но и создает оптимальные условия для жизнедеятельности клеток. При отечных состояниях, когда отрицательное давление в интерстициальной жидкости нивелируется, клеточная архитектура нарушается. Отрицательное давление в интерстициальном пространстве является также гарантией постоянства интерстициального водного объема, предупреждает накопление излишних объемов жидкости и, наконец, улучшает условия метаболизма, поскольку сближает поверхности сосудистой и клеточной диффузионных мембран.
Факторами, повышающими интерстициальное давление, являются: увеличение внутрикапиллярного давления и снижение КОД плазмы, возрастание интерстициального КОД и, наконец, повышение проницаемости капилляров. Сначала влияние названных факторов компенсируется усилением лимфатического тока, иногда в 10—50 раз [Hillman K., 1990]. С исчерпанием компенсирующего лимфатического механизма интерстициальное давление поднимается выше нуля. При этом в интерстициальном пространстве накапливается большое количество жидкости. Отношения между давлением и объемом жидкости в разных зонах интерстициального пространства неодинаковы, поскольку различные ткани имеют разную степень податливости, растяжимости (compliance).
Примерно те же механизмы определяют динамику легочного интерстициального пространства. Однако легочное капиллярное давление ниже и легочные капилляры относительно легко пропускают молекулы белка. Вместе с тем движение лимфы по легочным лимфатическим сосудам осуществляется быстрее из-за выраженного пульсирующего характера кровотока в близрас-положенных легочных кровеносных сосудах. В целом же относительная величина легочного интерстициального пространства значительно меньше тканевого и альвеолярный легочный эпителий может противостоять давлению со стороны интерстиция не выше 2 мм рт. ст. При
превышении этого значения начинается отек легких. В норме жидкость не накапливается в интерстициальном пространстве легких благодаря описанным насосным механизмам.
Трансцеллюлярную жидкость охарактеризовать одним определением невозможно, поскольку ее специфика обусловливается локализацией. В целом по составу она близка к интерстици-альной жидкости и плазме, включает электролиты и белки в различных сочетаниях. Общий объем цереброспинальной и суставной жидкости в организме равен примерно 300— 400 мл. В норме объем жидкости, находящейся в каждый отдельный момент в желудке, кишечнике, желчном пузыре, желчных и панкреатических ходах, также невелик, хотя проходящий через желудочно-кишечный тракт объем жидкостей составляет 8— 10 л/сут. Объем трансцеллюлярной жидкости составляет 0,5—1% массы тела.
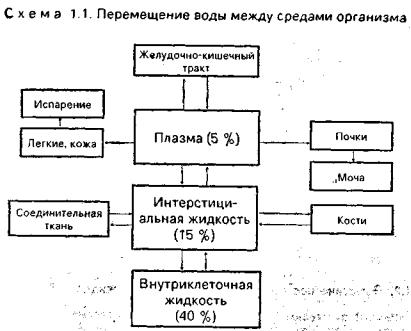
Общие направления перемещений воды между средами организма представлены на схеме 1.1.
Хотя в практических целях принято считать, что объем внеклеточной жидкости составляет 20—22% массы тела, он может значительно увеличиваться при голодании, тяжелых инфекционных заболеваниях, травме, сепсисе и раке, т. е. при тех состояниях, которые сопровождаются потерей значительной части мышечных масс. Объем внеклеточной жидкости увеличивается также при отеках (сердечные, безбелковые, воспалительные, почечные и др.), беременности.
При ожирении относительный объем внеклеточной жидкости меньше. Он уменьшается также при всех формах дегидратации, особенно при потере солей. Существенные нарушения объема внеклеточной жидкости наблюдаются при критических состояниях у хирургических больных. Такие состояния возникают у оперированных или неоперированных больных в результате перитонита, панкреатита (особенно его некротической формы), геморрагического и септического шока, кишечной непроходимости,
кровопотери и тяжелой травмы, при которой могут развиться практически все синдромы, характерные для критических состояний. Наиболее часто при этом страдает объем внеклеточной жидкости. Конечной целью регуляции жидкостного и электролитного баланса у тяжелобольных являются поддержание и нормализация сосудистого и интерстициального» жидкостных объемов, их электролитного и белкового состава. В клиническрй практике только этим путем можно влиять на водный и электролитный состав клеточного пространства, как бы оно ни изменилось.
Поддержание и нормализация объема внеклеточной жидкости и ее состава являются также основой для регуляции артериального и центрального венозного давления (ЦВД), нормализации сердечного выброса, почечного, печеночного, мозгового и коронарного кровотока, наконец, кровообращения всего организма, его микроциркуляции и поддержания биохимического гомеостаза.
1.2. Электролитный состав организма
Из табл. 1.1, где представлен нормальный состав трех главных сред организма, следует, что Na+ является преимущественно катионом внеклеточной жидкости. Хлорид (С1—) и бикарбонат (НСО3—) представляют собой анионную электролитную группу внеклеточного пространства. В клеточном пространстве определяющим катионом является К+, а к анионной группе относятся фосфаты, сульфат, белки, органические кислоты и в меньшей степени бикарбонат.
Таблица 1.1. Электролитный состав сред человеческого организма (средние сводные данные)
|
Плазма |
Интер стициальное |
|
||
|
|
|
пространство |
|
|
Ионы |
мзкв/л |
ммоль/л |
|
ммоль/л |
Клеточное |
|
|
|
мзкв/л |
|
пространство |
|
|
|
|
|
мэкв/л |
|
|
Катионы: |
|
|
|
Na+ |
140 |
140 |
145 |
145 |
10 |
К+ |
4,5 |
4.5 |
4 |
4 |
150 |
Са2+ |
5,0 |
2,5 |
3 |
2,5 |
-- |
Mg2+ |
1,5 |
0,75 |
Л 2 : |
1 |
30 |
Сумма |
151,0 |
~148 |
! 154 |
152,5 |
190 |
концентраций |
|
Анионы |
|
|
|
|
|
|
|
||
С1— |
104 |
104 |
116 |
116 |
— |
НСО3— |
24 |
24 |
27 |
27 |
10 |
SO42— |
1,0 |
0,5 |
21 |
1,0 |
__ |

РО42- |
2,0 |
1,0 |
3 |
1,5 |
100 |
белок |
15 |
~2 |
1 |
— |
60 |
органические |
5 |
5,0 |
5 |
5 |
20 |
кислоты |
|
|
|
|
|
Сумма |
151 |
136,5 |
154 |
150,5 |
190 |
концентраций |
|
|
|
|
|
1.3. Осмотическое состояние биологических жидкостей
Осмосом называют спонтанное движение растворителя из раствора с низкой концентрацией частиц в раствор с высокой концентрацией их через мембрану, проницаемую только для растворителя. Осмотическое давление — избыточная величина гидростатического давления, которое должно быть приложено к раствору, чтобы уравновесить диффузию растворителя, через., полупроницаемую мембрану1.
1Энциклопедический словарь медицинских терминов.— М.: Советская энциклопедия, 1983, с. 270.
Осмотическое давление плазмы крови составляет в среднем 6,62 атм (пределы колебаний 6,47—6,72 атм). Осмотическое давление зависит только от концентрации частиц, растворенных в растворе, и не зависит от их массы, размера и валентности. Таким образом, осмотическое давление создают в растворе все ц частицы — как ионы (Na+, К+, С1—, НСО3—), так и нейтральные молекулы (глюкоза, мочевина).
В биологии и медицине осмотическое состояние сред принято выражать двумя понятиями: осмолярностью, представляющей собой суммарную концентрацию растворенных частиц в 1 л раствора (в миллиосмолях на литр), и осмоляльностью, являющейся концентрацией частиц в 1 кг растворителя, т. е. воды (мосмоль/кг).
Среднее содержание воды в крови составляет по объему 92%, следовательно, осмоляльность= осмолярность/0,92.
Осмоляльность раствора численно равна суммарной концентрации, выраженной в количестве веществ (в миллимолях, но не в миллиэквивалентах), содержащихся в 1 кг растворителя (вода), плюс количество полностью диссоциированных электролитов, недиссоциированных веществ (глюкоза, мочевина) или слабодиссоциированных субстанций, таких как белок. Поскольку с помощью специального прибора осмометра определяется осмоляльность (но не осмолярность), мы будем пользоваться этим термином.
Все одновалентные ионы (Na+, К+, Cl—) образуют в растворе число осмолей, равное числу молей и эквивалентов (электрических зарядов). Двухвалентные ионы образуют в растворе каждый по одному осмолю (и молю), но по два эквивалента.
Осмоляльность нормальной плазмы — величина достаточно постоянная и равна 285—295 мосмоль/кг. Из общей осмоляльности плазмы
лишь 2 мосмол/кг обусловлены наличием растворенных в ней белков. Таким образом, главными компонентами, обеспечивающими осмоляльность плазмы, являются Na+ и С1- (около 140 и 100 мосмоль/кг соответственно). Постоянство осмотического давления внутриклеточной и внеклеточной 1 жидкости предполагает равенство молярных концентраций содержащихся в них электролитов, несмотря на различия в ионном составе внутри клетки и во внеклеточном пространстве. С 1976 г. в соответствии с Международной системой (СИ) концентрацию веществ в растворе, в том числе осмотическую, принято выражать в миллимолях на 1 л (ммоль/л). Понятие «осмоляльность», или «осмотическая концентрация», эквивалентно понятию «моляльность», или «моляльная концентрация». По существу понятия «миллиосмоль» и «миллимоль» для биологических растворов близки, хотя и не идентичны.
Часть осмотического давления, создаваемую в биологических жидкостях белками, называют коллоидно-осмотическим (онкотическим) давлением (КОД). Оно составляет примерно 0,7% осмотического давления (или осмотической концентрации), т. е. около 30 мм рт. ст. (2 мосмоль/кг), но имеет исключительно большое функциональное значение в связи с высокой гидро-фильностью белков и неспособностью их свободно проходить через полупроницаемые биологические мембраны.
КОД плазмы крови и других сред определяют с помощью специальных приборов онкометров. Нормальные величины осмоляльности биологических сред и жидкостей человеческого организма приведены в табл. 1.2.
Таблица 1.2. Нормальные значения осмоляльности биологических сред
Среда |
Осмоляльность, мосмоль на 1 кг воды |
Плазма крови |
285—295 |
Цереброспинальная жидкость |
285—295 |
Желудочный сок |
160—340 |
Слюна |
110—210 |
Желчь |
290—300 |
Моча |
600—1200 (в зависимости от диеты и |
|
диуреза) |
Наиболее распространенный метод определения осмотической концентрации в биологической среде — криоскопический — основан на изменении температуры замерзания исследуемого раствора. Присутствие растворенного вещества понижает точку замерзания (для дистиллированной воды 0°С) тем сильнее, чем концентрированнее раствор. Основанные на этом принципе осмометры позволяют определять осмоляльность в очень малой пробе (0,05—0,15 мл).
Если непосредственное определение осмоляльности невозможно (например, в случае отсутствия осмометра), ее можно рассчитать по одной из нескольких предложенных для этой цели формул. Одна из них [Fabri P. J., 1988] имеет вид:
Осмольрасч= 1,86-[На+]+[Гл] + [М],
где [Na+], [Гл], [М] — концентрации Na+, глюкозы, мочевины (ммоль/л), 1,86 — удвоенный осмотический коэффициент Na+ (с учетом сопутствующего аниона; мосмоль/ммоль). Предлагают также рассчитывать так называемый градиент, или дискриминанту, осмоляльности («osmolal gap»; см. главу 2, где говорится о близком по смыслу показателе «anion gap»), т. е. разность между измеренной и расчетной осмоляльностью.
Обычно осмоляльный градиент не превышает 10 мосмоль/кг. Более высокий градиент указывает на то, что в формировании высокой осмоляльности принимают участие другие (обычно не учитываемые) субстанции — лактат, этанол, маннитол.
Осмоляльность внеклеточной жидкости, определяемая концентрацией растворенных в ней веществ, поддерживается постоянной благодаря почечному механизму регуляции, осуществляемому с участием антидиуретического гормона (АДГ) и альдостерона. Почечный механизм работает на основе концентрации субстанций во внеклеточной жидкости. Эта концентрация может быть оценена отношением количества растворенных субстанций к количеству растворителя. Следовательно, варианты патологии этой функции могут выражаться в отклонениях от нормы: изменении количеств растворенных веществ, объема воды или того и другого показателя.
Наиболее распространенной ошибкой в клинической практике является предположение, что изменения осмоляльности отражают повышение или понижение содержания воды. В действительности осмоляльность отражает концентрационные взаимоотношения и увеличивается либо в зависимости от увеличения содержания растворенного субстрата (например, при азотемии), либо в результате абсолютного уменьшения содержания растворителя (воды), в частности при дегидратации, либо, наконец, в результате изменения обоих компонентов (гиперосмоляльная кома).
1.4. Механизмы поддержания внутриклеточного объема жидкости и внутриклеточного ионного состава
Осмотические и электрические силы. Основным условием постоянства объема водных внутри- и внеклеточных сред, разделенных клеточной мембраной, является их изотоничность. Тоничностью называют компонент осмоляльности вне клеточной жидкости, обусловленный концентрацией растворенных веществ, плохо проникающих через клеточные мембраны, (Na+, в отношении некоторых тканей — глюкоза). Обычно осмоляльность и тоничность изменяются однонаправленно, поэтому гиперосмоляльность означает и гипертоничность [Loeb J. H., 1984]. Однако возможно повышение осмоляльности без увеличения тоничности (в частности, при повышении в плазме концентрации мочевины, этанола, для которых тканевые мембраны хорошо проницаемы) [Fabri P. J., 1988]. В этом

случае существенных перемещений жидкости между внутри- и внеклеточным пространствами не происходит.
Анионы, находящиеся внутри клетки, обычно поливалентны, велики и не могут свободно проникнуть через клеточную мембрану. Единственным катионом, для которого клеточная мембрана проницаема и который находится в клетке в свободном состоянии и в достаточном количестве,
обеспечивающем частичную нейтрализацию клеточных анионов, является К+.
Как уже говорилось, Na+ является внеклеточным катионом. Его локализация обусловлена двумя обстоятельствами: относительно низкой способностью проникать через клеточную мембрану и наличием особого механизма вытеснения Na+ из клетки—так называемого натриевого насоса. С1~ также является внеклеточным компонентом, но его потенциальная способность проникать через клеточную мембрану относительно высока. Она не реализуется потому, что клетка имеет достаточно постоянный состав фиксированных клеточных анионов, создающих в ней преобладание отрицательного потенциала, вытесняющего С1—. Таким образом, осмотическое и электрическое равновесие между клеточным и внеклеточным пространством может быть достигнуто при относительно высокой концентрации К+ внутри клетки и соответствующей высокой концентрации С1—за ее пределами. Эти различия в концентрациях мобильных ионов внутри клетки (к) и вне ее (вк) обеспечивают постоянную разность потенциалов — так называемый трансмембранный потенциал, равный примерно 60—80 мВ, причем внутриклеточный заряд имеет отрицательное значение. Указанные взаимоотношения могут быть представлены в следующем виде:
[К+]к [С1-]вк
——— = ————
[К+]вк [С1—]к
где [К+]к и [С1-]к— концентрация ионов калия и хлора внутри клетки; [К+]вК и [С1-]вк— концентрация этих же ионов вне клетки.
Электрическое взаимодействие может быть выражено так: V=611g-|^=611gl|^.
[К JK !>' JBK
«Натриевый насос». Мембранная проницаемость Na+ в общем в 10— 20 раз меньше, чем К+. Однако наличие градиента концентраций Na+ во вне- и внутриклеточном пространствах и отрицательный внутриклеточный заряд могли бы обеспечить силу, способную двигать Na+ в сторону клетки. В действительности этого не происходит, поскольку такая сила оказывается сбалансированной другой, действующей в обратном направлении и называемой натриевым насосом. Энергия натриевого насоса, являющегося специфическим свойством клеточной мембраны, обеспечивается гидролизом аденозинтрифосфата (АТФ) и направлена на выталкивание Na+ из клетки [Whittman R., Wheeler К. Р., 1970]. Эта же энергия способствует движению К+
внутрь клетки. Установлено, что противоположно направленные движения К+ и Na+ осуществляются в пропорции 2:3. По мнению М. W. В. Bradbury (1973), с физиологической точки зрения для К+ этот механизм не столь существен, так как последний в норме обладает высокой способностью проникать через клеточную мембрану. Описанный механизм является основным для обеспечения постоянства концентрации клеточных и внеклеточных компонентов.
Гипоксия приводит к сдвигу метаболизма в анаэробной фазе и образованию в клетке молочной кислоты, которая смещает рН в кислую сторону, что оказывает влияние на передвижение ионов через клеточную мембрану. Если функция натриевого насоса оказывается нарушенной дефицитом О2 или каким-либо другим метаболическим расстройством, то это приводит к неконтролируемой ситуации, когда клеточное пространство почти свободно доступно для Na+. В результате уменьшается внутриклеточный отрицательный потенциал и клетка становится более доступной и для С1—. Связанное с этим повышение осмотического давления в клетке приводит к перемещению воды внутрь клетки и ее набуханию, а в дальнейшем и к нарушению ее целостности.
1.5. Механизмы поддержания внеклеточного объема жидкости, и внеклеточного ионного состава
Внеклеточная жидкость является промежуточной средой, отделяющей внутриклеточную среду от внешнего мира. Следовательно, от изменения объема и состава внеклеточной жидкости зависит и состояние внутриклеточной среды.
Осмоляльность и объем внеклеточной жидкости. Организм получает воду главным образом в виде питья и с пищей. Частично вода образуется в результате метаболизма, особенно жиров. Вода выводится через почки (основной путь), при испарении с поверхности альвеол, кожи и, наконец, с экскрементами. Повышение осмоляльности плазмы крови, возникающее при потере чистой воды, является специфическим раздражителем осморецепторов, заложенных в переднем гипоталамусе. В результате их активации у человека, во-первых, появляется ощущение жажды и, во-вторых, усиливаются синтез и продукция АДГ, который оказывает влияние на реабсорбцию воды в дистальных и собирательных канальцах почек и задерживает в организме воду. При низкой продукции АДГ организм выделяет большое количество мочи с низкой осмоляльностью (около 30 мосмоль/кг) и низкой плотностью (1,001—1,002 г/л). При максимальной секреции АДГ организм выделяет малое количество мочи (около 500 мл) с высокой осмоляльностью (более 1200—1400 мосмоль/кг) и высокой плотностью (в ряде случаев более 1,040 г/л). Этот механизм позволяет поддерживать довольно постоянный уровень осмоляльности плазмы (285— 295 мосмоль/кг) с небольшими отклонениями в ту или другую сторону.
Роль натрия в поддержании баланса воды. Около 14 000 ммоль Na+
в минуту фильтруется клубочками и попадает в почечные канальцы. За исключением небольшого количества, составляющего 200 ммоль/сут, почти весь Na+ в почках же реабсорбируется. Выведение Na+ почками зависит от изменений его клубочковой фильтрации и его реабсорбции в канальцах. Объем внеклеточной жидкости регулируется также деятельностью так называемых волюморецепторов, заложенных в стенках левого и, возможно, правого предсердий [Kappagoda С. Т. et al., 1972]. Благодаря механизму капиллярной фильтрации объем крови находится в тесной связи с общим объемом внеклеточной жидкости. В свою очередь от объема крови зависят ЦВД и давление в легочных венах.
Контроль за выведением солей и жидкости осуществляют также юкстагломерулярный аппарат почек, барорецепторы каротидного синуса и клетки коры надпочечников, которые чувствительны непосредственно к концентрациям Na+ и К+ в крови. Альдостерон способствует активации реабсорбции Na+ из дистальных и проксимальных канальцев, а также из петли нефрона и, следовательно, является фактором, задерживающим Na+ в организме. Секреция альдостерона повышается при бессолевой диете, после кровопотери, а также при переходе из горизонтального в вертикальное положение. Повышенное введение в организм Na+ тормозит секрецию альдостерона, способствуя таким образом выведению лишнего Na+. В регуляции функции самого альдостерона принимают участие ренин и антиотензин-II, которые стимулируют его секрецию.
1.6. Контроль водно-электролитного баланса
Поступление воды. Человек должен потреблять воды столько, сколько необходимо, чтобы возместить суточную ее потерю через почки и внепочечными путями. Нормальная сбалансированная потребность человека в воде колеблется от 1000 до 2500 мл/сут и зависит от массы тела, возраста, пола и ряда других факторов.
В процессе обмена и утилизации всех трех главных метаболических компонентов — белков, углеводов и жиров — одним из конечных продуктов является вода. Следовательно, организм в состоянии частично покрыть свои потребности за счет использования образующейся в нем эндогенной воды.
При продукции в организме 100 ккал (420 кДж) образуется около 10 мл воды [Moore F., 1963]. Поскольку суточный энергетический выход составляет у взрослого человека 1500— 2000 ккал (6300—9240 кДж), объем образующейся при этом метаболической воды составляет около 150—220 мл, т. е. около 8—10% суточной потребности. Окисление 100 г белков сопровождается образованием 41 мл воды, 100 г жиров —107 мл и 100 г углеводов — 55 мл воды. Очевидно, что метаболическая вода не содержит электролитов. Лихорадка, травма, инфекции и другие тяжелые заболевания приводят к увеличению образования эндогенной воды в 2—3 раза.
Диурез и перспирационные потери. Наиболее тонким и
чувствительным показателем баланса жидкости в организме является диурез. Здоровый человек в состоянии выделить в течение суток все продукты обмена в относительно небольшом объеме мочи (400—600 мл). Оптимальный же диурез в 3—4 раза больше и составляет 1400—1600 мл/сут. Помимо этого, при нормальных температурных условиях и нормальной влажности воздуха организм теряет через кожу и путем испарения через дыхательные пути от 800 до 1000 мл воды, образующих так называемые неощутимые потери. Таким образом, общее выведение воды (с мочой и перспирацией) должно составлять 2200— 2600 мл/сут.
В реанимационной практике существуют три варианта определения диуреза: сбор суточной мочи (при неосложненном течении болезни), определение диуреза каждые 8 ч (при инфузионной терапии любого типа) и почасовое определение диуреза (у больных с выраженными расстройствами водно-электролитного баланса, находящихся в шоке и с подозрением на развитие почечной недостаточности при катетеризованном мочевом пузыре). Функция почек в послеоперационном периоде считается удовлетворительной, если в первые 2 сут после операции диурез составляет в среднем 25—35 мл/ч. Это нижняя граница нормы. В последующие дни при благоприятном течении и при условии адекватной инфузионной терапии целесообразно добиваться диуреза, близкого к 80—90 мл/ч, т. е. 1700—2000 мл/сут.
Однако наш опыт показывает, что у больных, которым проводится реанимация, или у больных, находящихся в критическом состоянии, а также в первые дни после обширных операций получить такой диурез практически трудно. Это возможно лишь при значительной водной и солевой нагрузке, которая опасна в критических состояниях, поскольку возможны водная перегрузка легких и нарушение функции почек. Для того чтобы больной в первые 2 сут после обширной операции, когда активно действует фактор антидиуреза, выделил за сутки 2 л мочи, необходимо вводить ему внутривенно жидкости, включая солевые растворы, в количестве 4,5—5 л/сут. По-видимому, в среднем удовлетворительный для тяжелобольного диурез, обеспечивающий полное выведение шлаков, должен составлять 60
мл/ч (1500±500 мл/сут).
Олигурией считается диурез ниже 25—30 мл/ч (меньше 500 мл/сут). В настоящее время различают три типа олигурии (с учетом анатомофункциональных факторов): преренальную, ренальную и постренальную
[Dougan L. R., Flnaly W. E., 1973]. Олигурия первого типа возникает в результате блока почечных сосудов или неадекватного кровообращения. Олигурия второго типа характеризуется паренхиматозной почечной недостаточностью, а третьего — связана с нарушением оттока мочи из почек. С точки зрения реаниматолога, практически наиболее важны два первых. Чтобы оценить значение и качество олигурии, важно знать объем циркулирующей крови (ОЦК), системный объемный кровоток (сердечный выброс), содержание и распределение электролитов в организме и ряд других не менее важных показателей. Плотность мочи, превышающая 1,016—1,018
