
- •Введение
- •Рекомендации по решению задач
- •Требования к оформлению
- •Критерии и шкала оценивания устной защиты решения задач
- •1. Кинематика поступательного и вращательного движения Формулы
- •Примеры решения задач
- •2. Динамика поступательного движения Формулы
- •Примеры решения задач
- •3. Закон сохранения импульса тела. Столкновения частиц Формулы
- •Примеры решения задач
- •4. Закон сохранения энергии Формулы
- •Примеры решения задач
- •5. Динамика вращательного движения Формулы
- •Примеры решения задач
- •6. Гармонические колебания. Волны в упругой среде. Акустика. Специальная теория относительности Формулы Гармонические колебания
- •Волны в упругой среде. Акустика
- •Специальная теория относительности
- •Примеры решения задач
- •Молекулярно-кинетическая теория
- •Элементы статистической физики
- •Примеры решения задач
- •8. Физические основы термодинамики. Реальные газы. Жидкости Формулы Физические основы термодинамики.
- •Реальные газы. Жидкости
- •Примеры решения задач
- •Список используемой литературы
Примеры решения задач
1. Вычислите работу, совершаемую одним молем идеального газа при изобарном нагревании на 1 К.
Дано: p1 = p2 = p; ν = 1 моль; ΔT = 1 К; |
Решение: При изобарном нагревании идеального газа работа A, совершаемая газом, равна
A = pΔV.
|
A – ? |
Так как по условию задачи не даны значения давления р газа и изменения его объема ΔV, выразим эти величины через известное изменение ΔT температуры газа. Для этого воспользуемся уравнением состояния идеального газа
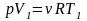 ,
,
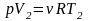 .
.
Из этих уравнений получаем
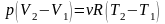 ,
или pΔV
= νRΔT.
,
или pΔV
= νRΔT.
Отсюда для работы газа при изобарном нагревании будем иметь
A = νRΔT;
А = 1·8,31·1 = 8,31 Дж.
Таким образом, молярная газовая постоянная R равна работе, совершаемой одним молем идеального газа при изобарном нагревании 1 К.
Ответ: A = 8,31 Дж.
2. Определите максимальный КПД тепловой машины, если температура нагревателя равна 227 ºС, а температура холодильника равна 27 ºС.
Дано: T1 = 500 К; T2 = 300 К; |
Решение: Максимальный КПД тепловой машины определяется выражением
|
ηmax – ? |
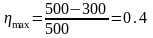 .
.
Ответ: ηmax = 0,4.
3. Карбюраторный двигатель внутреннего сгорания работает по циклу, состоящему из четырех последовательно происходящих процессов: адиабатного сжатия из состояния А в состояние В, изохорного перехода из состояния В в состояние С в результате нагревания воздуха при сжигании горючей смеси, адиабатного расширения из состояния С в состояние D и изохорного перехода из состояния D в исходное состояние А (см. рис.). Вычислите КПД двигателя для случая, если бы воздух был идеальным одноатомным газом при значениях температуры в состояниях А, В, С и D соответственно ТА = 300 К, ТB = 524 К, ТC = 786 К и ТD = 450 К.
Решение:
Значение КПД теплового двигателя определяется уравнением

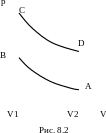 ,
,
здесь Q1 – количество теплоты, переданное за цикл рабочему телу от нагревателя; Q2 – количество теплоты, полученное за цикл холодильником от рабочего тела.
Во время осуществления адиабатических процессов расширения и сжатия нет теплообмена рабочего тела ни с холодильником, ни с нагревателем. Следовательно, весь процесс теплоотдачи количества теплоты Q1 от нагревателя осуществляется при переходе газа из состояния В в состояние С, а процесс передачи количества теплоты Q2 холодильнику – при переходе газа из состояния D в состояние А. При изохорическом переходе газа из состояния В в состояние С работа внешних сил равна нулю: А = 0, так как поршень неподвижен. Из первого закона термодинамики для этого процесса следует
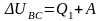 ,
A
= 0,
,
A
= 0,
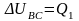 .
.
Мы получили, что количество теплоты, полученное газом от нагревателя за весь цикл, равно изменению внутренней энергии газа при переходе из состояния В в состояние С:
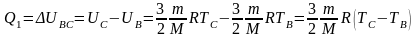 .
.
Аналогично количество теплоты Q2, переданное холодильнику при изохорическом переходе газа из состояния D в состояние А, равно
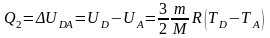 .
.
Подставляя полученные выражения для Q1 и Q2 в уравнение для определения КПД, получаем
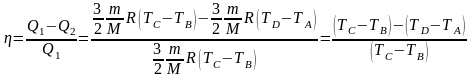 .
.
Найдем численное значение КПД:
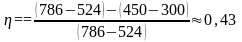 .
.
Ответ: η = 0,43.
4. В теплоизолированном сосуде находятся вода и лед при температуре 0 ºС. Массы воды и льда соответственно равны 0,5 кг и 60 г. В воду впускается водяной пар массой 10 г при температуре 100 ºС. Какой станет температура воды в сосуде после установления теплового равновесия? Теплоемкость сосуда в расчетах не учитывать.
Дано: m1 = 0,5 кг; m2 = 0,06 кг; m3 = 0,01 кг; T1 = 273 К; T2 = 373 К; r = 2,26·106 Дж/кг; λ = 3,3·105 Дж/кг; c = 4,23·103 Дж/(кг·К); |
Решение: Проверим сначала, достаточно ли выделяющегося при конденсации пара количества теплоты Q3 для плавления льда. При конденсации пара выделяется количество теплоты Q3:
Для плавления льда требуется количество теплоты Q2: |
T3 – ? |
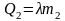 .
.
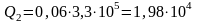 Дж.
Дж.
 Дж.
Дж.
Сравнение количеств теплоты Q3 и Q2 показывает, что Q3 > Q2. Это означает, что лёд расплавится полностью, но значения количеств теплоты отличаются незначительно, следовательно, пар конденсируется полностью. Поэтому уравнение теплового баланса имеет вид:
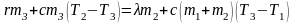 .
.
Теплота выделяется при конденсации пара массой m3 и остывании сконденсировавшейся воды от температуры Т2 до некоторого значения T3, а поглощается при плавлении льда массой m2 и нагревании воды массой (m1 + m2) от температуры Т1 до равновесного значения T3. Обозначив T3 – T1 = ΔТ, для разности T2 – T3 получим
T2 – T3 = T2 – T1 – ΔТ = 100 – ΔТ.
Уравнение теплового баланса приобретает вид
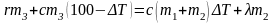 ;
;
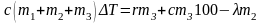 .
.
Откуда
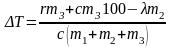 ;
;
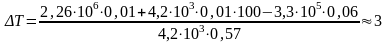 К.
К.
Тогда T2 = 273 К + 3 К = 276 К.
Ответ: T2 = 276 К.
5. Идеальная холодильная машина, работающая по обратному циклу Карно, использует в качестве холодильника тающий лед при температуре 0° С, а в качестве нагревателя – кипящую воду при 100° С. Какая масса льда образуется получении от сети энергии 25 кДж? Удельная теплота плавления льда λ = 3,25∙105 Дж/кг.
Дано: T1 = 273 К; T2 = 373 К; A = 25 кДж; λ = 3,25·105 Дж/кг; |
Решение: При работе идеальной тепловой машины в обратном направлении все происходит в обратно порядке: машина забирает теплоту Q2 у холодильника и отдает теплоту Q1 нагревателю, потребляя при этом работу A (в виде энергии, полученной от сети). Соотношение между работой A, потребленной холодильной машиной, и теплотой Q1, отданной ей нагревателю, такое же, как в прямом цикле Карно |
m – ? |
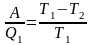 ,
,
здесь T1 и T2 – абсолютные температуры нагревателя и холодильника. Учитывая, что Q1 = Q2 + A, получим соотношения
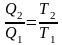 и
и
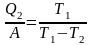 .
.
Для получения массы льда m надо забрать теплоты (λ – удельная теплота плавления). Выражая из этих соотношений 1массу льда, получаем
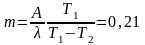 кг.
кг.
Ответ: m = 210 г.
6. Вычислить удельные теплоемкости неона и водорода при постоянных объеме (cV) и давлении (cp), принимая эти газы за идеальные. Вычислите удельную теплоемкость смеси этих двух газов при постоянном объеме. Масса неона m1 = 6 г, масса водорода m2 = 10 г.
Дано: R = 8,31 Дж/(моль·К); M1 = 0,020 кг/моль; M2 = 0,002 кг/моль; m1 = 0,006 кг; m2 = 0,010 кг; |
Решение: Удельные теплоемкости идеальных газов выражаются формулами
;
Для неона (одноатомный газ – i = 3)
|
cV1, cV2 – ? cp1, cp2 – ? cVсм – ? |
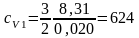 Дж/(кг·К);
Дж/(кг·К);
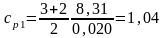 кДж/(кг·К).
кДж/(кг·К).
Для водорода (двухатомный газ – i = 5)
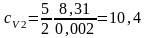 кДж/(кг·К);
кДж/(кг·К);
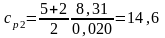 кДж/(кг·К).
кДж/(кг·К).
Удельная теплоемкость смеси газов определяется отношением молярной теплоемкости Cсм к массе mсм этой смеси
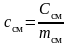 .
.
Теплоемкость вещества есть величина аддитивная, поэтому для двух газов можно написать
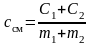 ,
,
здесь C1, C2 – теплоемкости газов, m1, m2 – их массы.
Теплоемкость газа при постоянном объеме определяется соотношением
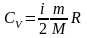 .
.
Окончательные расчеты дают следующее значение для смеси
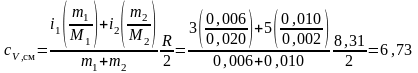 кДж/(кг·К).
кДж/(кг·К).
Ответ: cV1 = 624 Дж/(кг·К), cV2 = 1,04 кДж/(кг·К), cp1 = 10,4 кДж/(кг·К), cp2 = 14,6 кДж/(кг·К), cVсм = 6,73 кДж/(кг·К).
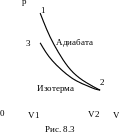
7. В цилиндре под поршнем находится водород массой неона m = 0,02 кг при температуре T1 = 300 К. Водород начал расширяться адиабатно, увеличив свой объем в пять раз, а затем был сжат изотермически, причем объем газа уменьшился в пять раз. Найти температуру T2 в конце адаибатного расширения и работу A, совершенную газом. Изобразить процесс графически.
Дано: R = 8,31 Дж/(моль·К); T1 = 300 К; m = 0,02 кг; V1/V2 = 5; |
Решение: Температуры и объемы газа, совершающего адиабатный процесс, связаны между собой соотношением
|
T2 – ? A – ? |
здесь γ – показатель адиабаты (для водорода как двухатомного газа γ = 1,4).
Отсюда получаем выражение для конечной температуры
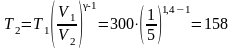 К.
К.
Работа A1 газа при адиабатном расширении определяется по формуле
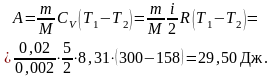
Работу A2 газа при изотермическом сжатии можно выразить формулой
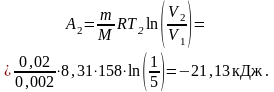
Знак минус показывает, что при сжатии газа работа совершена внешними силами. Общая работа, совершенная газом при рассмотренных процессах,
A = A1 + A2 = 29,50 + (– 21,13) = 8,37 кДж.
График процесса приведен на рис. 8.3
Ответ: T2 = 158 К, A = 8,37 кДж.
8. Найти изменение ΔS энтропии при нагревании воды массой m = 0,1 кг от t1 = 0 °С до температуры t2 = 100 °С и последующем превращении воды в пар той же температуры.
Дано: R = 8,31 Дж/(моль·К); m = 0,1 кг; t1 = 0 °С; t2 = 100 °С; M = 0,018 кг/моль; λ = 3,25·105 Дж/кг; c = 4,2·103 Дж/(кг·К); |
Решение: Найдем отдельно изменение энтропии ΔS՛ при нагревании воды и изменение энтропии ΔS՛՛ при превращении ее в пар. Полное изменение энтропии выразится суммой ΔS՛ и ΔS՛՛. Как известно, изменение энтропии выражается общей формулой
|
m – ? |
При бесконечно малом изменении dT температуры нагреваемого тела затрачивается количество теплоты dQ = mcdT, здесь m – масса тела, c – его удельная теплоемкость. Изменение энтропии при нагревании воды

При вычислении изменения энтропии во время превращения воды в пар той же температуры постоянная температура T выносится за знак интеграла. Вычислив интеграл, найдем
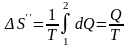 ,
,
здесь Q – количество теплоты, переданное при превращении нагретой воды в пар той же температуры. С учетом теплоты парообразования Q = λm, здесь λ – удельная теплота парообразования, получим
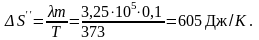
Полное изменение энтропии при нагревании воды и последующем превращении ее в пар
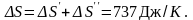
Ответ: ΔS = 737 Дж/К.

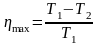 ;
;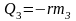 .
.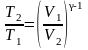 ,
,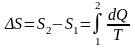 .
.