
Теория-1
.pdf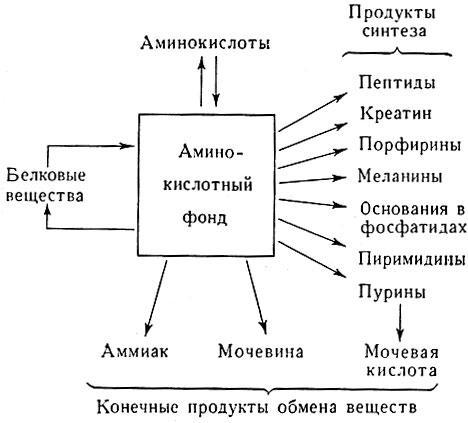
Рис. 1. Схема использования аминокислотного фонда в организме
Тканевой обмен аминокислот
Фонд аминокислот, образовавшийся в результате ферментативного расщепления пищевых продуктов или продуктов распада тканей, расходуется на биосинтез белков и многих других соединений, свойственных только данному организму, на энергетические затраты, а также на образование конечных продуктов азотистого обмена, подлежащих выведению.
Метаболизм аминокислот.
Трансаминирование
Трансаминирование - реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота.
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) - производное витамина В6
Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.

Реакция по типу «пинг-понг»
В таких реакциях первый продукт должен уйти из активного центра фермента до того, как второй субстрат сможет к нему присоединиться.
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот.
Дезаминирование аминокислот
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака.
1. Окислительное дезаминирование
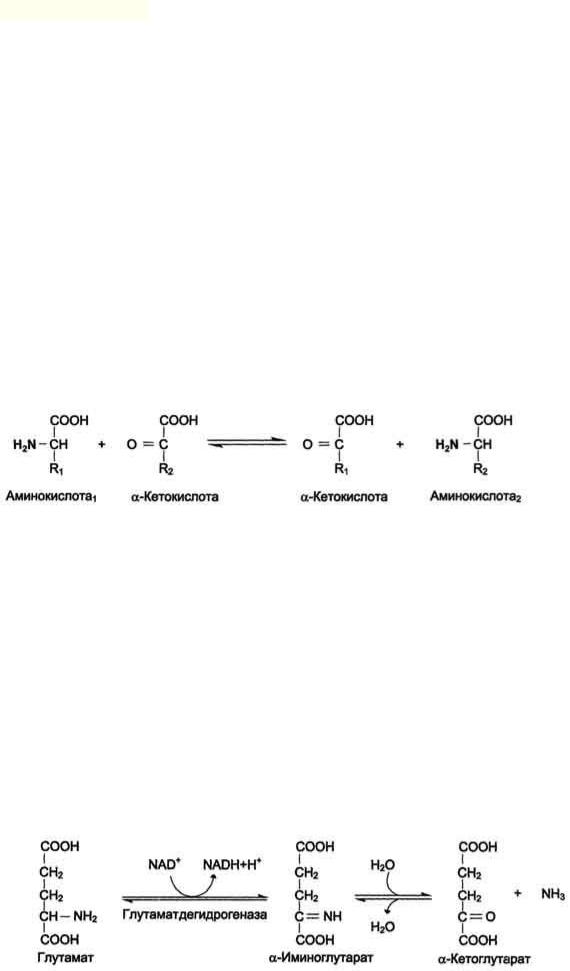
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является
NAD+.
2. Непрямое дезаминирование (трансдезаминирование)
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α- кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию.
Неокислительное дезаминирование серина катализирует сериндегидратаза.
Неокислительное дезаминирование треонина катализирует фермент треониндегидратаза.
Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
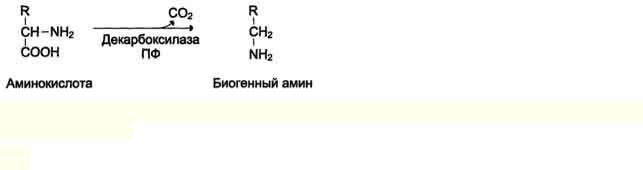
Декарбоксилирование аминокислот и их производных
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению ос-карбоксильной группы.
Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами.
Баланс аминокислот в клетке. Энергетическое и пластическое использование аминокислот (написать соответствующие реакции).
Азотистый баланс
Аминокислоты (свободные и в составе белков) содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма. Азотистый баланс - разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей). Если количество поступающего азота равно количеству выделяемого, то наступаетазотистое равновесие. Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) у детей, а также у пациентов, выздоравливающих после тяжѐлых болезней. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжѐлых заболеваний.
Трансаминирование
Трансаминирование - реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота.
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) - производное витамина В6
Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.
Реакция по типу «пинг-понг»
В таких реакциях первый продукт должен уйти из активного центра фермента до того, как второй субстрат сможет к нему присоединиться.
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот.
Дезаминирование аминокислот
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака.
1. Окислительное дезаминирование
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является
NAD+.
2. Непрямое дезаминирование (трансдезаминирование)
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α- кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию.
Неокислительное дезаминирование серина катализирует сериндегидратаза.
Неокислительное дезаминирование треонина катализирует фермент треониндегидратаза.
Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
Декарбоксилирование аминокислот и их производных
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению ос-карбоксильной группы.
Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами.
43. Гниение белков в кишечнике (схема распада аминокислот) и обезвреживание продуктов гниения.
Многочисленные превращения аминокислот, вызванные деятельностью микроорганизмов кишечника, получили общее название «гниение белков в кишечнике». Так, в процессе распада серосодержащих аминокислот (цистин, цистеин, метионин) в кишечнике образуются сероводород H2S и метил-меркаптан CH3SH.
Диаминокислоты – орнитин и лизин – подвергаются процессу декарбоксилирования с образованием токсичных аминов – путресцина и кадаверина.
Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичном бактериальном декарбоксилировании образуются соответствующие амины: фенилэтиламин, параоксифенилэтиламин и индолилэтиламин (триптамин).
Кроме того, микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола.
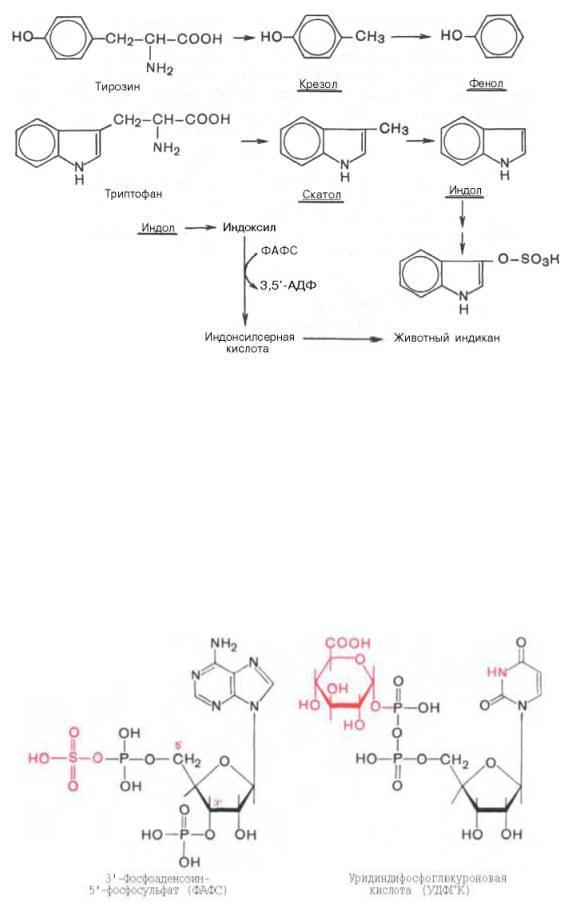
После всасывания эти продукты через воротную вену попадают в печень, где подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой с образованием нетоксичных, так называемых парных, кислот (например, фенолсерная кислота или ска-токсилсерная кислота). Последние выделяются с мочой. Механизм обезвреживания этих продуктов изучен детально.
В печени содержатся специфические ферменты – арилсульфотрансфераза и УДФ- глюкоронилтран-сфераза, катализирующие соответственно перенос остатка серной кислоты из ее связанной формы – 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) и остатка глюкуроновой кислоты также из ее связанной формы – уридилдифосфоглюкуроновой кислоты (УДФГК) на любой из указанных продуктов.
Индол (как и скатол) предварительно подвергается окислению в индоксил(соответственно

скатоксил), который взаимодействует непосредственно в ферментативной реакции с ФАФС или с УДФГК. Так, индол связывается в виде эфиросерной кислоты. Калиевая соль этой кислоты получила название животного индикана, который выводится с мочой.
По количеству индикана в моче человека можно судить не только о скорости процесса гниения белков в кишечнике, но и о функциональном состоянии печени.
44. Источники аммиака в организме (написать реакции). Роль свободных аминокислот в обезвреживании аммиака.
Катаболизм аминокислот в тканях происходит постоянно со скоростью 100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака.
476
Схема A
Схема Б
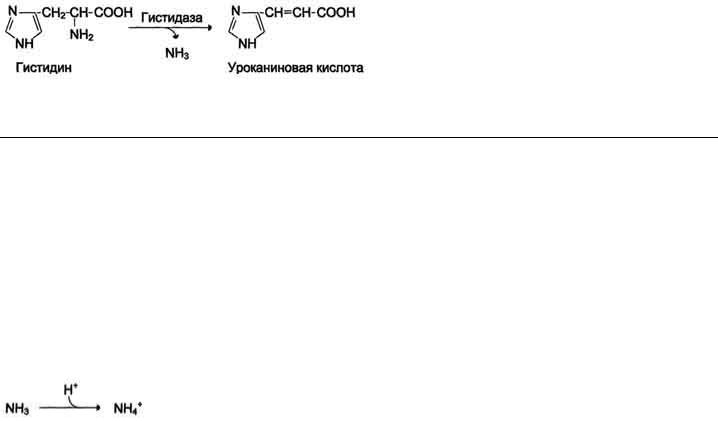
Схема В
Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов. Основные источники аммиака в клетках представлены в табл. 9-3.
Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония - NH4+
Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. К симптомам гипераммониемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжѐлых случаях развивается кома с летальным исходом.
Механизм токсического действия аммиака на мозг и организм в целом,
очевидно, связан с действием его на несколько функциональных систем.
7.Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глугамата:
α-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+.
Уменьшение концентрации α-кетоглутарата вызывает:
8.угнетение обмена аминокислот (реакции транса-минирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
9.гипоэнергетическое состояние в результате снижения скорости ЦТК.

477
Таблица 9-3. Основные источники аммиака
Источник |
Процесс |
Ферменты |
Локализация |
|
процесса |
||||
|
|
|
||
Аминокислот |
Непрямое дезаминирование |
Аминотрансферазы, ПФ |
Все ткани |
|
ы |
(основной путь |
Глутаматдегидрогеназа, |
|
|
|
дезаминирования |
NAD+ |
|
|
|
аминокислот) |
|
|
|
|
Окислительное |
Глутаматдегидрогеназа, |
Все ткани |
|
|
дезаминирование глутамата |
NAD+ |
|
|
|
Неокислительное |
Гистидаза-Серин, |
Преимущественно |
|
|
дезаминирование Гис, Сер, |
треониндегидратазы, ПФ |
печень |
|
|
Тре |
|
|
|
|
Окислительное |
Оксидаза L-аминокислот, |
Печень и почки |
|
|
дезаминирование |
FMN |
|
|
|
аминокислот |
|
|
|
|
(малозначимый путь |
|
|
|
|
дезаминирования) |
|
|
|
Биогенные |
Окислительное |
Аминооксидазы, FAD |
Все ткани |
|
амины |
дезаминирование (путь |
|
|
|
|
инактивации биогенных |
|
|
|
|
аминов) |
|
|
|
АМФ |
Гидролитическое |
АМФ-дезаминаза |
Интенсивно |
|
|
дезаминирование |
|
работающая мышца |
Свободные аминокислоты всасываются и после транспорта кровью включаются в клетках в различные пути использования, главным из которых является синтез собственных белков. Кроме того, аминокислоты используются для синтеза других азотсодержащих соединений, например таких, как тироксин, адреналин, гистамин, выполняющих специфические функции. Аминокислоты используются также как источники энергии, включаясь в путь катаболизма.
45. Пути образования и обезвреживания аммиака. Первичное и окончательное обезвреживание аммиака. Глюкозо-аланиновый цикл. Орнитиновый цикл Кребса. Связь с ЦТК. Роль свободных аминокислот в процессе обезвреживания аммиака.
Аммиак (NН3) – продукт обмена большинства соединений, содержащих амино- и
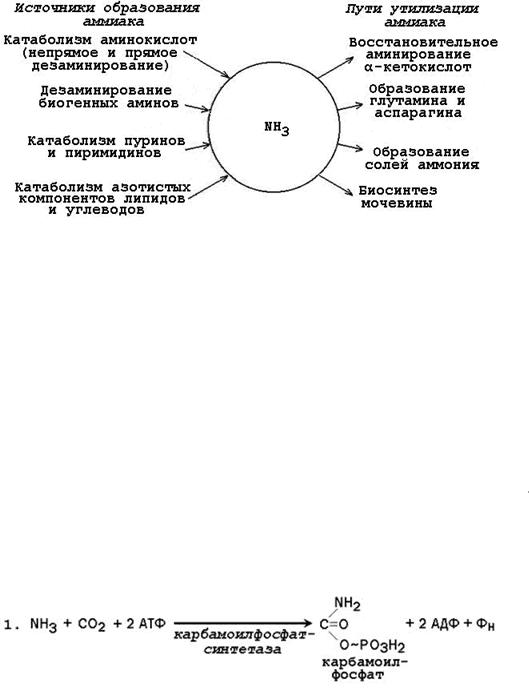
амидогруппы. Главным путѐм образования аммиака служит окислительное дезаминирование. Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологических значениях рН молекула NН3 легко превращается в ион аммония NН4+, который не способен проникать через биологические мембраны и задерживается в клетке. Накопление
NН4+ вызывает торможение заключительных этапов цикла трикарбоновых кислот и снижение продукции АТФ. Поэтому в организме существует ряд механизмов связывания (обезвреживания) аммиака
Биосинтез мочевины.
Биосинтез мочевины – основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени. Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций.
Две начальные реакции биосинтеза мочевины происходят в митохондриях клеток печени.
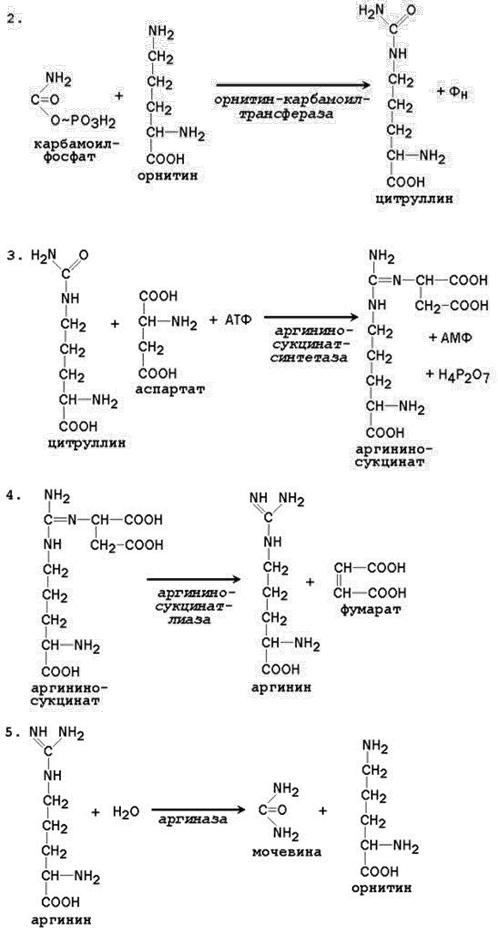
Последующие реакции протекают в цитоплазме клеток печени.
