
Теория-1
.pdfповышенным сродством к электрону атома Y, что обусловливает высокую свободную
энергию гидролиза М.с., составляющую 6—14 ккал/моль.
Примеры:
АТФ представляет собой аденозинфосфорную кислоту, содержащую 3 остатка фосфорной кислоты (или фосфатных остатка), служит универсальным переносчиком и основным аккумулятором химической энергии в живых клетках, кофермент многих ферментов. Всѐ это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения.
Ацетил-кофермент А, ацетил-коэнзим А, сокращѐнно ацетил-КоА — важное соединение в обмене веществ, используемое во многих биохимических реакциях. Его главная функция — доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот, чтобы те были окислены с выделением энергии
Гуанозиндифосфат (ГДФ, GDP,) — нуклеотид, эфир пирофосфорной кислоты с
гуаниловым нуклеозидом. ГДФ состоит из пирофосфата, сахара пентозы рибозы и азотистого основания гуанина
Креатинфосфат — продукт обратимого метаболического N-фосфорилирования креатина, являющийся, подобно АТФ, высокоэнергетическим соединением.
Дыхательная цепь – последовательная цепь ферментов, осуществляющая перенос ионов водорода и электронов от окисляемых субстратов к молекулярному кислороду – конечному акцептору водорода. В ходе этих реакций выделение энергии происходит постепенно, небольшими порциями, и она может быть аккумулирована в форме АТФ. Локализация ферментов дыхательной цепи – внутренняя митохондриальная мембрана.
Дыхательная цепь включает четыре мультиферментных комплекса:
I. НАДН-KoQ-редуктаза (содержит промежуточные акцепторы водорода: флавинмононуклеотид и железосерные белки).
II. Сукцинат-KoQ-редуктаза (содержит промежуточные акцепторы водорода: ФАД и железосерные белки).
III. KoQН2-цитохром с-редуктаза (содержит акцепторы электронов: цитохромы b и с1, железосерные белки).
IV. Цитохром с-оксидаза (содержит акцепторы электронов: цитохромы а и а3, ионы меди Cu2+).
В качестве промежуточных переносчиков электронов выступают убихинон (коэнзим Q) и цитохром с.
Убихинон (KoQ) – жирорастворимое витаминоподобное вещество, способен легко диффундировать в гидрофобной фазе внутренней мембраны митохондрий. Биологическая роль коэнзима Q – перенос электронов в дыхательной цепи от флавопротеинов (комплексы I и II) к цитохромам (комплекс III).
Цитохром с – сложный белок, хромопротеин, простетическая группа которого – гем – содержит железо с переменной валентностью (Fe3+ в окисленной форме и Fe2+ в восстановленной форме). Цитохром с является водорастворимым соединением и располагается на периферии внутренней митохондриальной мембраны в гидрофильной фазе. Биологическая роль цитохрома с – перенос электронов в дыхательной цепи от комплекса III к комплексу IV.
ХЕМИОСМОТИЧЕСКАЯ ТЕОРИЯ- учение о механизме преобразования энергии в биол. мембранах при синтезе аденозинтрифосфорной к-ты (АТФ). Разработана П. Митчеллом в

1961—66. Согласно исходным представлениям Митчелла, запасание энергии в АТФ происходит вследствие предварит, накопления зарядов на стенках мембраны, создания мембранного потенциала и разности концентраций протонов. Разность электрохимич. потенциалов ионов водорода на сопрягающих мембранах (внутр. мембраны митохондрий, тилакоиды хлоропластов, мембраны бактерий) возникает за счѐт энергии, выделяемой при деятельности цепи окислит.-восстановит, ферментов, или за счѐт поглощѐнных квантов света. Трансмембранные электрохимич. потенциалы ионов могут служить источником энергии не только для синтеза АТФ, на и для транспорта веществ, движения бактериальных клеток и др. энергозависимых процессов.
Ингибиторы окислительного фосфорилирования. Ингибиторы блокируют V комплекс:
Олигомицин — блокируют протонные каналы АТФ-синтазы.Атрактилозид, циклофиллин — блокируют транслоказы.
Разобщители окислительного фосфорилирования Разобщители — липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий минуя V комплекс(его протонный канал). Разобщители:
Естественные — продукты перекисного окисления липидов, жирных кислот с длинной цепью; большие дозы тиреоидных гормонов.
Искусственные — динитрофенол, эфир, производные витамина К, анестетики. Коэнзим Q10 (кофермент q10, убихинон) – жирорастворимое витаминоподобное соединение, небелковая часть одного из ферментов. Молекула Убихинона имеет сходное строение с витаминами Е, К.
Коэнзим Q10 – энерготропное (участвующее в энергетическом обмене) соединение, является наиболее важным кофактором энзимных реакций энергетического обмена (синтез АТФ, перенос электронов), поэтому максимальное содержание Коэнзима Q10 в митохондриях клеток с максимальным энергетическим обменом (сердце, печень и др.). Здоровое сердце, по мнению многих экспертов, невозможно без Коэнзима Q10 , который рекомендуется принимать не только в профилактических, но и в лечебных целях при сердечно-сосудистых заболеваниях.
Другая не менее важная функция Коэнзима Q10 – антиоксидантная. Он нейтрализует
свободные радикалы, предохраняет клетки мозга от липидного переокисления, восстанавливает антиоксидантную активность витамина Е.
Субстратное и окислительное фосфорилирование. Привести
примеры реакции, биологическая роль. Синтез АТФ. Роль магния в процессах с участием АТФ
Субстратное фосфорилирование — это синтез АТФ за счет переноса высокоэнергетического ортофосфата (Н3Р04) от окисляемого субстрата на АДФ. Такое фосфорилирование происходит в основном в мышцах прианаэробном окислении глюкозы с участием высокоспецифических ферментов.
Пример: (7 реакция гиколиза) Окислительное фосфорилирование — это синтез АТФ за счет энергии, которая выделяется при переносе электронов по дыхательной цепи от окисляемых питательных веществ к

атомарному кислороду. Окислительное фосфорилирование является основным механизмом образования АТФ в аэробных условиях.
Пример: (1 реакция гликолиза)
Субстратное фосфорилирование и окислительное фосфорилирование характеризуются разной степенью сопряженности между реакциями, протекающими с освобождением и накоплением энергии. При субстратном фосфорилировании окисление тесно связано с образованием первичного макроэргического соединения. При окислительном фосфорилировании окисление в дыхательной цепи непосредственно не связано с синтезом АТФ и первоначально используется для образования протонного потенциала, который в дальнейшем приводит к синтезу АТФ.
Синтез АТФ.
В дыхательной цепи можно выделить 3 участка, в которых перенос электронов сопровождается относительно большим снижением свободной энергии. Эти этапы способны обеспечить энергией синтез АТФ.
Первый процесс - перенос электронов от восстановленных коферментов NADH и FADH2 через ЦПЭ на кислород - экзергонический. Например:
NADH + Н+ +1/2 O2 → NAD+ + H2O + 52 ккал/моль(≈220 кДж/моль). (1)
Второй процесс - фосфорилирование АДФ, или синтез АТФ, - эндергонический:
АДФ + Н3РО4+7,3 ккал/моль (30,5 кДж/моль) = АТФ + Н2О. (2)
Синтез АТФ из АДФ и Н3РО4 за счѐт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием.
Роль магния:
В организме человека в большинстве клеточных реакций поставщиком энергии является молекула АТФ. Мало кто знает, что в ее состав входит и магний. Таким образом, получается, что магний является тем элементом, который играет важную роль и в энергетике организма.
Магний обладает способностью уменьшать разобщение внутриклеточного «дыхания» и окислительного фосфорилирования в митохондриях и уменьшать потребность клетки в кислороде, вследствие чего снижаются непроизводительные потери энергии в виде тепла, увеличивается КПД синтеза АТФ в цикле Кребса.
Переваривание и всасывание углеводов в желудочно-кишечном
тракте. Написать формулы субстратов. Какие ферменты участвуют в переваривании углеводов, какие связи они расщепляют? С помощью каких биохимических тестов можно определить наследственные нарушения переваривания углеводов в желудочно-кишечном тракте.
Переваривание углеводов в ротовой полости
Вротовой полости пища измельчается при пережѐвывании, смачиваясь при этом слюной. Слюна на 99% состоит из воды и обычно имеет рН 6,8. В слюне присутствует гидролитический фермент α-амилаза (α-1,4-гликозидаза), расщепляющая в крахмале α-1,4- гликозидные связи. В ротовой полости не может происходить полное расщепление крахмала, так как действие фермента на крахмал кратковременно.
Вжелудке.
Действие амилазы слюны прекращается в резко кислой среде содержимого желудка (рН 1,5- 2,5). Однако внутри пищевого комка активность амилазы может некоторое время сохраняться, пока рН не изменится в кислую сторону. Желудочный сок не содержит ферментов, расщепляющих углеводы.
Переваривание углеводов в кишечнике
Последующие этапы переваривания нерасщеплѐнного или частично расщеплѐнного крахмала, а
305
также других углеводов пищи происходит в тонком кишечнике в разных его отделах под действием гадролитических ферментов - гликозидаз.
Панкреатическая α-амилаза
В двенадцатиперстной кишке рН среды желудочного содержимого нейтрализуется, так как секрет поджелудочной железы имеет рН 7,5-8,0 и содержит бикарбонаты (НСО3-). С
секретом поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Этот фермент гидролизует α-1,4-гликозидные связи в крахмале и декстринах.
Продукты переваривания крахмала на этом этапе:
дисахарид мальтоза, содержащая 2 остатка глюкозы, связанные α-1,4-связью.
Из тех остатков глюкозы, которые в молекуле крахмала находятся в местах разветвления и соединены α-1,6-гликозидной связью, образуется дисахарид изомальтоза.
образуются олигосахариды, содержащие 3-8 остатков глюкозы, связанные α-1,4- и α- 1,6-связями
Дальнейшее их переваривание происходит под действием специфических ферментов в тонком кишечнике.
Сахаразо-изомальтазный комплекс
Этот ферментативный комплекс состоит из двух полипептидных цепей и имеет доменное строение. Он прикрепляется к мембране микроворсинок кишечника с помощью гидрофобного домена, каталитический центр выступает в просвет кишечника.
Сахаразо-изомальтазный комплекс гидролизует сахарозу и изомальтозу, расщепляя α-1,2- и α- 1,6-гликозидные связи.
Гликоамилазный комплекс
Этот ферментативный комплекс катализирует гидролиз α-1,4-связи между глюкозными остатками в олигосахаридах, действуя с восстанавливающего конца. Комплекс расщепляет также связи в мальтозе, действуя как мальтаза.
β-Гликозидазный комплекс (лактаза)
Лактаза расщепляет β-1,4-гликозидные связи между галактозой и глюкозой в лактозе. Лактаза, как и другие гликозидазные комплексы, связана с щѐточной каемкой и распределена неравномерно по всему тонкому кишечнику.
Трегалаза - также гликозидазный комплекс, гидролизующий связи между мономерами в трегалозе - дисахариде, содержащемся в грибах. Трегалоза состоит из двух глюкозных остатков, связанных гликозидной связью между первыми аномерными атомами углерода.
Совместное действие всех перечисленных ферментов завершает переваривание пищевых олиго- и полисахаридов с образованием моносахаридов, основной из которых - глюкоза. Кроме глюкозы, из углеводов пищи также образуются фруктоза и галактоза, в меньшем количестве - манноза, ксилоза, арабиноза.
Формулы субстратов:
сахароза
мальтоза
Для диагностики различных нарушений переваривания используют пробы с нагрузкой определѐнными углеводами. Недостаточность кишечных дисахаридаз можно диагностировать с помощью введения дисахарида и последующего определения концентрации глюкозы в крови. Для большей чувствительности этот тест проводят, вводя сначала дисахарид (50 г), а затем эквивалентное количество составляющих его моносахаридов (по 25 г каждого). После нагрузки концентрация глюкозы в крови увеличивается примерно на 50% относительно нормы. При патологии отмечают незначительную гипергликемию.
Если тест при нагрузке моносахаридом сопровождается адекватным повышением его концентрации в крови, а нагрузка дисахаридом не даѐт нормальной реакции, то это, скорее всего, указывает на дефект кишечной дисахаридазы, а не системы транспорта.
О недостаточности лактазы можно судить, определяя водород в выдыхаемом воздухе (водородный тест). Водород образуется в результате действия бактериальных ферментов на лактозу.

18.Этапы аэробного дихотомического окисление глюкозы. Характеристика и биологическая роль каждого процесса. Регуляция аэробного дихотомического окисления глюкозы.
Аэробный путь окисления глюкозы и его энергетика.
Аэробный путь окисления глюкозы происходит в 3 этапа:
1.окисление молекулы глюкозы до 2 молекул пирувата;
2.окислительное декарбоксилирование пирувата (с образованием 2 молекул ацетил-КоА);
3.реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ.
1-ый этап. Окисление молекулы глюкозы до 2 молекул пирувата - это первые 10 реакций гликолиза. Суммарная реакция 1 этапа: Глюкоза + 2 НАД+ + 2 АДФ ^ 2 пирувата + 2 НАДН + Н+ + 2 АТФ
2-ой этап. Окислительное декарбоксилирование пирувата (с образованием 2 молекул ацетил-КоА) происходит в матриксе митохондрий и осуществляется мультиферментным комплексом пируватдегидрогеназой. В его состав входят 3 фермента и 5 коферментов:
1.Пируватдекарбоксилаза - кофермент тиаминпирофосфат (активная форма витамина В1).
2.Дегидролипоилацетилтрансфераза - кофермента: в активном центре - липоевая кислота
(витаминоподобное вещество), из матрикса митохондрий используется Коэнзим А (КоА~8Н). 3. Дигидролипоилдегидрогеназа - коферменты: в активном центре - ФАД, из матрикса митохондрий используется - НАД.
Суммарная реакция: 2 Пируват + 2 НАД+ + КоА ^ 2 ацетил-КоА + 2 НАДН + Н+ Каждый восстановленный НАД в митохондриях отдает протоны и электроны в полную ц.п.э., где образуется 2 х 3 АТФ = 6 АТФ. Таким образом, ценность второго этапа - 6 АТФ. Эти реакции происходят только в аэробных условиях!
3-ий этап. Реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ. Следовательно, энергетический выход третьего этапа (в расчете на молекулу глюкозы) - 2 х 12 АТФ = 24 АТФ
Энергетическая ценность аэробного окисления глюкозы:
1 этап - 8 (6) АТФ
2 этап - 6 АТФ 3 этап - 24 АТФ Итого: 38 (36) АТФ
19. Дихотомический анаэробный путь окисления углеводов, его этапы, биологическая роль. Написать соответствующие реакции. Механизм развития ацидоза при гипоксии.
Дихотомический распад глюкозы может происходить как в анаэробных (без присутствия кислорода), так и в аэробных (в присутствии кислорода) условиях. При распаде глюкозы в анаэробных условиях в результате процесса молочнокислого брожения образуется молочная кислота. Иначе этот процесс называется гликолизом.
1. Первой ферментативной реакцией гликолиза является фосфорилирование. Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
2.
3. Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта
реакция |
определяет |
скорость |
гликолиза |
в |
целом. |
|
4. |
|
|
|
|
|
|
5. |
Пятая реакция – это реакция изомеризации триозофосфатов. Образованием глицеральдегид-3- |
|||||

фосфата как бы завершается первая стадия гликолиза.
6.
7. Таким образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ
8.
9.
10.Десятая реакция характеризуется разрывом высокоэргической связи и переносом
фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование)
11.
Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются 2 молекулы АТФ (гексокиназная и фосфофрук-токиназная реакции). На последующих образуются 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет 2 молекулы АТФ на одну молекулу глюкозы
Ацидоз при гипоксии.
любая тяжелая/длительная гипоксия приобретает тканевой компонент (гипоксия → ацидоз → блокада гликолиза → отсутствие субстрата для окисления → блокада окисления → тканевая гипоксия).
Пути образования и использования оксалоацетата в клетке.
21. Глюконеогенез. Напишите реакции. Связь с гликолизом и ЦТК. Биологическая роль. Гормональная регуляция процесса.
Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитами являются в первую очередь молочная и пи-ровиноградная кислоты,
Последовательность реакций глюконеогенеза представляет собой обращение соответствующих реакций гликолиза. Лишь три реакции гликолиза необратимы вследствие происходящих в ходе их значительных энергетических сдвигов:
а) фосфорилирование глюкозы; б) фосфорилирование фруктозо-6-фосфата;
в) превращение фосфоенолпирувата в пируват.
Обход этих энергетических барьеров обеспечивают ключевые ферменты глюконеогенеза.
Обратный переход пирувата в фосфоенолпируват требует участия двух ферментов. Первый из них –пируваткарбоксилаза - катализирует реакцию образования оксалоацетата (рисунок 12.1, реакция 1). Коферментом пируваткарбоксилазы является биотин (витамин Н). Реакция протекает в митохондриях. Роль еѐ заключается также в пополнении фонда оксалоацетата для цикла Кребса.
Все последующие реакции глюконеогенеза протекают в цитоплазме. Мембрана митохондрий непроницаема для оксалоацетата, и он переносится в цитоплазму в виде других метаболитов: малата или аспартата. В цитоплазме указанные соединения вновь переходят в оксалоацетат. При участии фосфоенолпируваткарбоксикиназы из оксалоацетата образуется

фосфоенолпируват
Фосфоенолпируват в результате обращения ряда реакций гликолиза переходит во фруктозо- 1,6-дифосфат. Превращение фруктозо-1,6-дифосфата во фруктозо-6-фосфат катализируется фруктозодифосфатазой
Гормональная активация глюконеогенеза осуществляется глюкокортикоидами, которые увеличивают синтез пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы,
фруктозо-1,6-дифосфатазы. Глюкагон стимулирует те же самые ферменты через аденилатциклазный механизм путем фосфорилирования.
Также имеется метаболическая регуляция, при которой аллостерически активируется
пируваткарбоксилаза при помощи ацетил-SКоА, фруктозо-1,6-дифосфатаза при участии АТФ
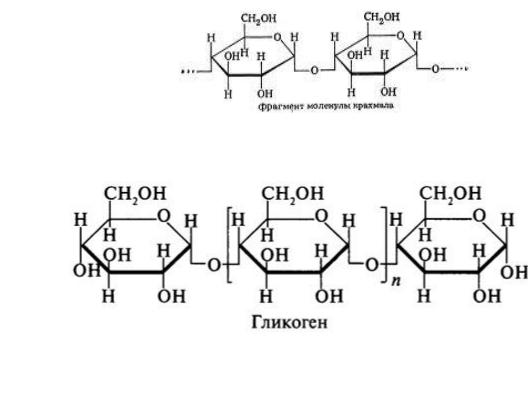
22.Распад гликогена до пирувата, биологическая роль, регуляция процесса.
Гликогенолиз. Запасным полисахаридом в тканях человека является гликоген. Процесс распада гликогена называетсягликогенолизом. Этот процесс может осуществляться либо путем гидролиза, либо фосфоролиза.
Фосфоролиз является основным путем распада гликогена, его катализирует фермент гликогенфосфорилаза, относящийся к классу трансфераз. Гликогенфосфорилаза отщепляет остатки глюкозы с нередуцирующего конца гликогена и переносит их на молекулу фосфорной кислоты с образованием глюкозо-1-фосфата:
Глюкозо-1-фосфат быстро изомеризуется, превращаясь в глюкозо-6-фосфат, который в печени гидролизуется фосфатазами до глюкозы и фосфорной кислоты:
Процесс фосфоролиза гликогена тонко регулируется. Регуляция активности гликогенфосфорилазы носит каскадный характер, в котором можно выделить несколько видов регуляции ферментативной активности:
84
1) гормональная (глюкагон в печени, адреналин в мышцах);
2) аллостерическая;
3) протеинкиназные реакции (в данном случае - фосфорилирование бокового радикала серина в гликогенфосфорилазе).
Активность мышечной фосфорилазы увеличивается при определенной концентрации АМФ и ацетилхолина, а также в присутствии катионов кальция и натрия.
Снижение скорости фосфоролиза происходит при уменьшении запасов гликогена и фосфорной кислоты, а также при увеличении концентрации глюкозо-6-фосфата. Механизмы, снижающие скорость фосфоролиза гликогена, предохраняют организм от больших трат углеводных запасов (гликогена), которые могли бы привести к недостатку глюкозы, необходимой для работы головного мозга и сердечной мышцы.
Гидролиз гликогена катализируется ферментами амилазами, которые относятся к классу гидролаз. В результате гидролиза гликоген расщепляется до свободной глюкозы:

Гидролитический распад гликогена происходит обычно в печени. Глюкоза, полученная при фосфоролизе и гидролизе гликогена, поступает в различные ткани и органы организма, где подвергается дальнейшему распаду.
Затем дальнейшее превращение глюкозы в пируват идет в гидролизе.
Первой ферментативной реакцией гликолиза является фосфорилирование. Образование глюкозо- 6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
2.
3. Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии
ионов магния и является наиболее медленно текущей реакцией гликолиза. |
Фактически эта |
||||
реакция |
определяет |
скорость |
гликолиза |
в |
целом. |
4.
5. Пятая реакция – это реакция изомеризации триозофосфатов. Образованием глицеральдегид-3- фосфата как бы завершается первая стадия гликолиза.
6.
7. Таким образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ
8.
9.
10.
23.Синтез гликогена, написать соответствующие реакции. Метаболическая и гормональная регуляция. Какие биохимические тесты используются для диагностики гликогенозов? Методика выполнения теста.
Синтез гликогена (гликогенез)
Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы, а в печени – и глюкокиназы. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фос-фат:
Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглюкозу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГпирофосфорилаза):
Глюкозо-1-фосфат + УТФ < = > УДФ-глюкоза + Пирофосфат.
Приводим структурную формулу УДФ-глюкозы.
На второй стадии – стадии образования гликогена – происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена («затравочное» количество). При этом образуется α-(1–>4)-связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи.
Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь
цикл |
превращений |
глюкозо-1-фосфата |
начинается |
сначала. |
Регуляция: |
Регуляция синтеза |
гликогена осуществляется |
через регуляцию |
активности |

гликогенсинтазы. Гликогенсинтаза в клетках присутствует в двух формах: гликогенсинтаза в
(D) — фосфорилированная неактивная форма, гликогенсинтаза а (I) — нефосфорилированная активная форма. Глюкагон в гепатоцитах и кардиомиоцитах по аденилатциклазному механизму инактивирует гликогенсинтазу. Аналогично действует адреналин в скелетных мышцах. Гликогенсинтаза D может аллостерически активироваться высокими концентрациями глюкозо-6-фосфата. Инсулин активирует гликогенсинтазу. Итак, инсулин и глюкоза стимулируют гликогенез, адреналин и глюкагон — тормозят.
Цикл трикарбоновых кислот, биохимические функции. Связь с
орнитиновым циклом. Пластическая, энергетическая функции ЦТК.
ТРИКАРБОНОВЫХ КИСЛОТ ЦИКЛ (цикл Кребса), цик-лич. последовательность ферментативных р-ций, в к-рых осуществляются превращения ди- и трикарбоновых к-т, образующихся как промежут. продукты в организме животных, в растениях и микробах.
1.
2. дегидратированию с образованием цис-аконитовой кислоты
3.
4. окислительное декарбокси-лирование α-кетоглутаровой кислоты
5.
6. сукцинат дегидрируется в фумаровую кислот
7.
8.
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться.
Орнитиновый цикл находится в тесной взаимосвязи с циклом трикарбоновых кислот:
1.пусковые реакции цикла мочевины, как и реакции ЦТК, протекают в митохондриальном матриксе; 2.поступление СО2 и АТФ, необходимых для образования мочевины, обеспечивается работой ЦТК;
3.в цикле мочевины образуется фумарат, который является одним из субстратов ЦТК. Фумарат гидратируется в малат, который в свою очередь окисляется в оксалоацетат. Оксалоацетат может подвергаться трансаминированию в аспартат; эта аминокислота участвует в образовании аргининосукцината.
Функции ЦТК
Катаболическая функция — превращение различных веществ в субстраты цикла: Жирные кислоты, пируват,Лей,Фен — Ацетил-КоА.
Арг, Гис, Глу — α-кетоглутарат. Фен, тир — фумарат.
Анаболическая функция — использование субстратов цикла на синтез органических веществ:
Оксалацетат — глюкоза, Асп, Асн. Сукцинил-КоА — синтез гема.
