
Теория-1
.pdf
глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА накапливается в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени.
Основные этапы и ключевые ферменты биосинтеза высших жирных
кислот. Регуляция процесса. Челночный механизм переноса ацетилКоА. Образование и роль малонил-КоА. Принцип работы синтазы ВЖК. Реакции десатурации.
Липогенез - (lipogenesis) - процесс, при котором глюкоза и другие вещества из содержащихся в пище углеводов превращаются в организме в жирные кислоты
Регуляция липогенеза.
Главный фактор, контролирующий скорость липогенеза, — состояние питания организма и тканей. Скорость липогенеза снижается при ограниченном поступлении калорийной пищи в организм, а также при богатой жирами диете или в случае недостатка инсулина (как это имеет место при сахарном диабете). При всех этих состояниях повышается уровень свободных жирных кислот в плазме крови.
Интенсивность липогенеза возрастает при потреблении сахарозы вместо глюкозы, поскольку фруктоза минует регуляторную стадию гликолиза, катализируемую фосфофруктокиназой
Челночный механизм переноса Ацетил-КоА.
Так как мембрана митохондрии непроницаема для ацетил КоА, то начальным этапом биосинтеза является перенос ацетил КоА через митохондриальную мембрану с помощью цитратпируватного челночного механизма.
Известно, что первой реакцией цикла Кребса является конденсация ацетил КоА с щавелевоуксусной кислотой (оксалоацетатом) с образованием цитрата (лимонной кислоты). Часть образовавшихся цитрат-ионов не вовлекается в дальнейшие реакции цикла Кребса, а переносятся через митохондриальную мембрану в цитозоль, где в присутствии цитратлиазы и при участии АТФ и HS-KoA вновь образует ацетил-КоА и ЩУК :
Цитрат + HS-KoA + АТФ → Оксалоацетат + Ацетил-КоА + АДФ + Н3РО4
Возвращение оксалоацетата в митохондрии осуществляется с помощью двух посредников − малата и пирувата.Восстановление оксалоацетата в малат в цитозоле является частью малатаспартатного
челночного механизма переноса восстановленного (НАД∙Н + Н+) из цитозоля в митохондрии:
Оксалоацетат + НАД∙Н + Н+ ↔Малат + НАД
Однако образовавшийся малат не переносится с\через мембрану, а сразу окисляется с одновременным декарбоксилированием в пируват:
Малат + НАДФ+ → Пируват + СО2 + НАДФ∙Н + Н+
Таким образом, перенос одной молекулы ацетил КоА из митохондрии в

цитозоль сопровождается образованием одной молекулы восстановленной
формы (НАДФ·Н + Н+), который необходим для многих биосинтезов, а пируват, который дифундирует в митохондрии, затем карбоксилируется с образованием оксалоацетата.
Собственно синтез пальмитиновой кислоты начинается с карбоксилирования ацетил КоА. Эта реакция протекает в присутствии фермента, простетической группой которого является биотин:
Эта реакция является ключевой в синтезе жирных кислот. Дальнейшие превращения объединяются в циклы по шесть реакций, и в результате завершения каждого цикла углеродная цепь будущей молекулы удлиняется на два углеродных атома.
Синтаза жирных кислот Синтаза жирных кислот позвоночных состоит из двух идентичных пептидных цепей, т. е представляет собой гомодимер. Каждая из двух пептидных цепей, представленных на рисунке в виде половинок шара, может катализировать семь различных реакций ([1]-[7]), из которых складывается синтез пальмитата.
Установлено, что две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот. Эти превращения протекают в микросомах клеток печени и жировой ткани при участии молекулярного кислорода, восстановленной системы пиридиновых нуклеотидов и цитохрома b5. Превращению подвергаются только активированные формы пальмитиновой и стеариновой кислот. Ферменты, участвующие в этих превращениях, получили название деса-тураз, а реакции образования — реакции десатурации.
34.Холестерин, строение, роль, синтез до мевалоната (написать
реакции). Регуляция процесса. Ингибиторы синтеза холестерина. Биохимические функции атерогенных форм липопротеинов и их роль в патогенезе атеросклероза. КоQ, возможность синтеза в организме.
Холестерол - стероид, характерный только для животных организмов. Он синтезируется во многих тканях человека, но основное место синтеза - печень.
Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН.
1. Синтез мевалоновой кислоты.
Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3- гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил- SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
2.Синтез изопентенилдифосфата. На этом этапе три остатка фосфат присоединяются к мевалоновой кислоте, затем она декарбоксилируется и дегидрируется.
3.После объединения трех молекул изопентенилдифосфата синтезируется
фарнезилдифосфат.
4.Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5.После сложных реакций линейный сквален циклизуется в ланостерол.
6.Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола.
Регуляция синтеза
Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз.
1.Метаболическая регуляция – по принципу обратной отрицательной связи фермент ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2.Ковалентная модификация при гормональной регуляции: инсулин, активируя протеинфосфатазу, способствует переходу фермента в активное состояние.
Ингибирование.
Конечный продукт метаболического пути (холестерол) снижает скорость транскрипции гена ГМГ-КоА-редуктазы, подавляя таким образом собственный синтез. В печени активно идѐт синтез жѐлчных кислот из холестерола, поэтому и жѐлчные кислоты (как конечные продукты синтеза) подавляют активность гена ГМГ-КоА-редуктазы (рис. 8-67). Так как молекула ГМГ-КоА-редуктазы существует около 3 ч после синтеза, то ингибирование синтеза этого фермента конечным продуктом метаболического пути (холестеролом) является эффективной регуляцией.
+статины
Липопротеины
Холестерол транспортируется кровью только в составе ЛП. ЛП обеспечивают поступление в ткани экзогенного холестерола, определяют потоки холестерола между органами и выведение избытка холестерола из организма.
Липопротеины очень низкой плотности (ЛПОНП) отвечают за транспорт поступающих с пищей липидов. Основная роль ЛПОНП – транспорт триглицеридов из печени в периферические ткани, помимо этого они являются предшественниками липопротеинов низкой плотности (ЛПНП). Период полужизни ЛПОНП в плазме составляет 6-12 часов. ЛПОНП относят к высокоатерогенным липопротеидам, участвующим в механизме образования атеросклеротических бляшек, по сути, они являются маркерами атерогенности. Анализ сдается утром натощак, поскольку перед этим необходимо не есть в течение 10 часов. Пить можно только обычную воду. Для исследования берется кровь из вены.
Липопротеины низкой плотности – основные переносчики холестерола в организме. Холестерол, входящий в их состав, считается «вредным», так как при его избытке повышается риск появления в артериях бляшек, которые могут приводить к их закупорке и вызывать инфаркт или инсульт.
Липопротеины промежуточной плотности ( — класс липопротеиновкрови,
образующихся при липолитической деградации липопротеинов очень низкой плотности под действиемлипопротеинлипазы. Однако ЛППП могут накапливаться при ряде нарушений липидного обмена (гиперлипидемии).
Убихиноны — это жирорастворимые коферменты, представленные преимущественно в митохондриях эукариотических клеток. Убихинон является компонентом цепи переноса
электронов и принимает участие в окислительном фосфорилировании. Максимальное содержание убихинона в органах с наибольшими энергетическими потребностями, например,
в сердце и печени. По химической природе кофермент Q имеет сходство в строении молекулы с
витаминами Е и К . Кофермент Q представляет собой желто-оранжевые кристаллы без вкуса и запаха Существуют два осн. пути хим. синтеза убихинонов. Один из них включает алкилирование
полипренильной цепью 2,3-диме-токси-5-метил-1,4-гидрохинона

Второй подход к хим. синтезу убихинонов состоит в наращивании по терминальному звену полипренильной цепи низшего прир. гомолога или синтетического убихинона в окисленной форме
Препараты убихинонов применяют для лечения заболеваний сердечно-сосудистой системы (в т. ч. хронических), лечения детей с митральным пороком сердца, для уменьшения кардиоток-сич. действия противоопухолевых антибиотиков и в качестве иммуномодулирующих ср-в.
35. Липопротеины плазмы крови. Методы разделения. Классификация, строение, биологическая роль. Апопротеины, их роль. Обратный транспорт холестерина. Биологическая роль.
Липопротеины плазмы подразделяются на две группы: белки, связанные с липидами ковалентно, и белки, связанные с липидами нековалентными связями. Липид, ковалентно связанный с липопротеином, служит якорем, с помощью которого белки
прикрепляются к мембране (см. рис. 231). Липопротеины второй группы не имеют строго определенного состава. Они скорее представляют собой агрегаты липидов с белками.
Эти липопротеиновые комплексы имеют переменные размеры и состав. В плазме крови они обеспечивают транспорт водонерастворимых липидов.
Липопротеиновые комплексы представляют собой шаровидные агрегаты, состоящие из ядра, образованного неполярными липидами (триацилглицеринами и ацилхолестеринами), и оболочкитолщиной примерно 2 нм, построенной из апопротеинов и амфифильных липидов (фосфолипидов и холестерина). Наружная сторона оболочки полярна, вследствие этого липиды растворимы в плазме. Чем больше липидное ядро, т. е. чем большую часть составляют неполярные липиды, тем меньше плотность липопротеинового комплекса.
Липопротеиновые комплексы делятся на пять групп. Ниже они приведены в порядке
уменьшения размера и увеличения плотности: это хиломикроны и остатки хиломикронов, |
||||
липопротеины |
очень |
низкой |
плотности . липопротеины |
промежуточной |
плотности , липопротеины низкой плотности , липопротеины высокой плотности .
Липопротеиновые комплексы несут на внешней поверхности характерныйапопротеин, который «плавает» на оболочке (здесь в качестве примера ЛНП). Апопротеины играют решающую роль в функционировании липопротеинов: они служат молекулами узнавания для мембранных рецепторов (см. ниже) и необходимыми партнерами для ферментов и белков, которые участвуют в метаболизме и обмене липидов
Транспорт триацилглицеринов и холестерина
Хиломикроны обеспечивают транспорт пищевых липидов от кишечника к тканям. Хиломикроны образуются в слизистой кишечника и транспортируются в кровь лимфатической системой. В мышцах и жировой ткани они разрушаются липазой липопротеинов. Остатки хиломикронов утилизируются печенью.
ЛОНП, ЛПП и ЛНП тесно связаны между собой. Они транспортируют триацилглицерины, холестерин и фосфолипиды от печени к тканям. ЛОНП образуются в печени и могут превращаться, как и хиломикроны, в ЛПП и ЛНП путем отщепления жирных кислот. Образующиеся ЛНП снабжают холестерином различные ткани организма.
ЛВП возвращают избыточный холестерин, образующийся в тканях, обратно в печень. Во время транспорта холестерин ацилируется жирными кислотами из лецитина. В этом процессе участвует лецитинхолестеринацилтрансфераза . Между ЛВП и ЛОНП также происходит обмен липидами и белками.
Методы разделения:

Метод ультрацентрифугирования позволяет разделить ЛП, используя их различие в плотности, которая зависит от соотношения количества липидов и белков в частице. Так как жир имеет меньшую, чем вода, плотность, то ХМ, содержащие более 85% жиров, располагаются на поверхности сыворотки крови, а ЛПВП, содержащие наибольшее количество белков, имеют самую большую плотность и при центрифугировании располагаются в нижней части центрифужной пробирки.
метод электрофореза. Скорость движения частиц при электрофорезе зависит от их заряда и размера. Заряд, в свою очередь, зависит от количества белков на поверхности ЛП. При электрофорезе в геле все типы ЛП движутся к положительному полюсу; ближе к старту располагаются ХМ, а ЛПВП, имеющие наибольшее количество белков и наименьший размер, удаляются от старта дальше других частиц.
Апопротеины.
Гидрофильный слой липопротеинов образован белками, которые называют апопротеинами, и амфифильными молекулами липидов фосфолипидами и холестеролом. Гидрофильные группы этих молекул обращены к водной фазе, а гидрофобные части - к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды. Некоторые апопротеины интегральные и не могут быть отделены от липопротеина, а другие могут свободно переноситься от одного типа липопротеина к другому. Апопротеины выполняют несколько функций:
формируют структуру липопротеинов; взаимодействуют с рецепторами на поверхности клеток и таким образом определяют,
какими тканями будет захватываться данный тип липопротеинов; служат ферментами или активаторами ферментов, действующих на липопротеины.
Холестерин: обратный транспорт в печень
Установлено, что в отличие от содержащих апоВ липопротеидов ( ЛПОНП и ЛПНП ), доставляющих ХС клеткам периферических тканей, ЛП высокой плотности способны забирать ХС с плазматических мембран этих клеток, а также с поверхности богатых ТГ липопротеидов (ХМ и ЛПОНП ), где образуется его избыток в результате действия на эти частицылипопротеидлипазы (ЛПЛ) . Забрав холестерин, ЛПВП транспортируют его в печень для окисления в желчные кислоты . Свойством связывать ХС обладает один из основных апопротеинов ЛПВП - апоА-I . На первом этапе образуются так называемые насцентные (незрелые) формы ЛПВП - н-ЛПВП, или пре-b-ЛПВП. Пре-b-ЛПВП затем превращается в зрелую, структурно завершенную частицу ЛПВП (нативные ЛПВП, или a-ЛПВП).
Биосинтез триацилглицеринов и фосфолипидов.
Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование α-глице-рофосфата (глицерол-3-фосфата) как промежуточного соединения. В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:
в процессе гликолитического распада глюкозы образуется дигид-роксиацетонфосфат. Последний в присутствии ци-топлазматической глицерол-3-фос-фатдегидрогеназы способен
превращаться в глицерол-3-фосфат:
Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты (т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная кислота (фосфатидат):
Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидро-лазой до 1,2- диглицерида (1,2-диацилглицерола):
Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицеролацилтрансферазой:
39. Перекисное окисление липидов, этапы. Роль активных форм кислорода. Ферментное звено АОС, роль минеральных компонентов пищи. Окисление перекисное
Окисление перекисное - сложный многостадийный цепной процесс окисления кислородом липидных субстратов, главным образом полиненасыщенных жирных кислот, включающий стадии взаимодействия липидов со свободнорадильными соединениями и образования свободных радикалов липидной природы.
Реакции перекисного окисления липидов (ПОЛ) являются свободнорадикальными и постоянно происходят в организме. Свободнора-дикальное окисление нарушает структуру многих молекул. В белках окисляются некоторые аминокислоты. В результате разрушается структура белков, между ними образуются ковалент-ные "сшивки", всѐ это активирует протеолитические ферменты в клетке, гидролизующие повреждѐнные белки. Активные формы кислорода легко нарушают и структуру ДНК. Неспецифическое связывание
Fe2+ молекулой ДНК облегчает образование гидроксильных радикалов, которые разрушают
структуру азотистых оснований. Но наиболее подвержены действию активных форм кислорода жирные кислоты, содержащие двойные связи, расположенные через СН2-группу.
Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал.
ПОЛ - цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления.
Стадии перекисного окисления липидов
1) Инициация: образование свободного радикала (L•)
Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2- групп полиеновой кислоты, что приводит к образованию липидного радикала.
2) Развитие цепи:
L • + О2 → LOO •
LOO• + LH → LOOM + LR•
Развитие цепи происходит при присоединении О2, в результате чего образуется липопероксирадикал LOO• или пероксид липида LOOH.
ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других.
3) Разрушение структуры липидов
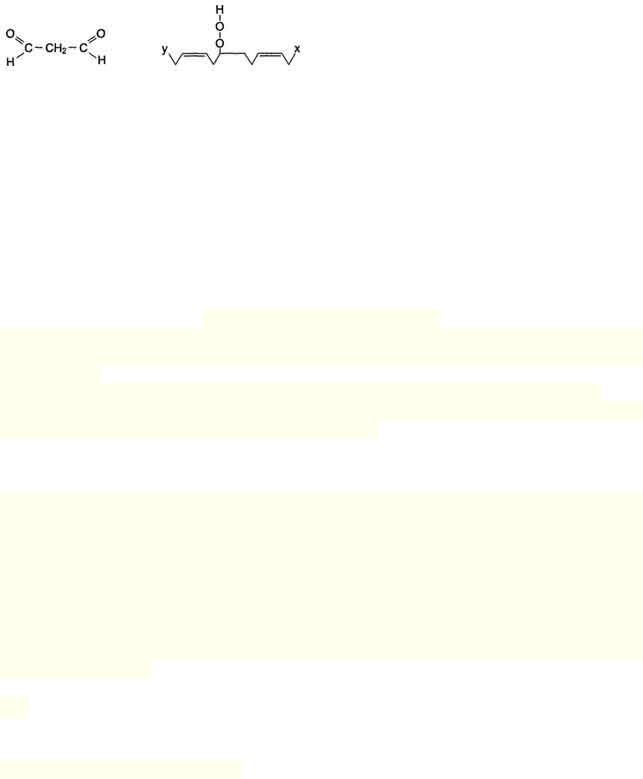
Конечные продукты перекисного окисления полиеновых кислот - малоновый диальдегид и гидропероксид кислоты.
4) Обрыв цепи - взаимодействие радикалов между собой:
LOO• + L• → LOOH + LH L• + vit E → LH + vit E•
vit E• + L• → LH + vit Еокисл.
Продукты О. п., в частности перекиси липидов, используются в организме для синтеза биологически активных веществ — простагландинов (Простагландины), тромбоксанов, стероидных гормонов (Гормоны) и т.д.
Роль активных форм кислорода.
Выясняется, что АФК принимают непосредственное участие в формировании разнообразных физиологических ответов клеток на тот или иной молекулярный
биорегулятор.
АФК и сами могут имитировать действие многих гормонов и нейромедиаторов. Так,
H2O2 в низких концентрациях имитирует действие на жировые клетки инсулина, а инсулин
стимулирует в них активность NADPH-оксидазы. Таким образом, становится ясно, что
АФК - это универсальные регуляторные агенты [28], факторы, благотворно влияющие на процессы жизнедеятельности от клеточного уровня до уровня целого организма.
Ферментное звено АОС можно представить в виде 3-х линий АРЗ: супероксиддисмутаза – 1-ая линия, каталаза и селеновая глутатионпероксидаза – 2-ая линия, ГП, глутатионтрансфераза, пероксидаза, цитохромоксидаза, некоторые медьсодержащие оксидазы – 3-ая линия Кроме того, можно выделить ферменты прямого антиоксидантного действия (перечисленные выше) и косвенного (НАД, ФАД и убихинон зависимые дегидрогеназы). Функционирование всех ферментов взаимосвязано и взаимозависимо, – продукты реакции, катализируемой ферментом из одной линии системы антиоксидантной и антирадикальной защиты, являясь субстратами для ферментов последующих линий, одновременно могут выступать в роли их аллостерических эффекторов как положительных, так и отрицательных.
40. Переваривание белков в желудочно-кишечном тракте. Какими биохимическими тестами можно обнаружить нарушения переваривания белков в желудочно-кишечном тракте?
Переваривание белков в желудке
Желудочный сок - продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопротеин, который называют "внутренним фактором" (фактором Касла). Этот белок связывает "внешний фактор" - витамин В12, предотвращает его разрушение и способствует всасыванию.
1. Образование и роль соляной кислоты
Основная пищеварительная функция желудка заключается в том, что в нѐм начинается

переваривание белка. Существенную роль в этом процессе играет соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов - гастринов (см. раздел 11), которые, в свою очередь, вызывают секрецию НСI и профермента - пепсиногена.
2.Механизм активации пепсина
Под действием гастринов в главных клетках желудочных желѐз стимулируются синтез и секреция пепсиногена - неактивной формы пепсина. Пепсиноген - белок, состоящий из одной полипептидной цепи. Под действием НСl он превращается в активный пепсин. В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ).
3.Возрастные особенности переваривания белков в желудке
У детей грудного возраста в ж
елудке находится фермент реннин (химозин) , вызывающий свѐртывание молока. Основной белок молока - казеин, представляющий смесь нескольких белков, различающихся по аминокислотному составу и электрофоретической подвижности. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са2+, образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. Белки успевают расщепиться под действием пепсина. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НСl и пепсина.
Переваривание белков в кишечнике
Желудочное содержимое (химус) в процессе переваривания поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из
поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина.
1. Активация панкреатических ферментов
В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путѐм частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбок-сипептидазы А и В.
Активация трипсиногена происходит под действием фермента эпителия кишечника энтеропептидазы.
Этот фермент отщепляет с N-конца молекулы трипсиногена гексапептид Вал-(Асп)4-Лиз.
Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, и образуется активный трипсин. Последовательность Вал-(Асп)4-Лиз
присуща большинству известных трипсиноге-нов разных организмов - от рыб до человека.
Образовавшийся трипсин активирует химотрипсиноген, из которого получается несколько активных ферментов (рис. 9-3). Химотрипсиноген состоит из одной полипептидной цепи, содержащей 245 аминокислотных остатков и пяти дисульфидных мостиков.
2. Специфичность действия протеаз

Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина.
Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот.
Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
3.Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи.
4.Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды.
Врезультате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
Диагностика нарушений переваривания.
Определение кислотности желудочного сока используют для диагностики различных заболеваний желудка. Повышенная кислотность желудочного сока обычно сопровождается изжогой, диареей и может быть симптомом язвы желудка и двенадцатиперстной кишки, а также гиперацидного гастрита. Пониженная кислотность бывает при некоторых видах гастритов. Полное отсутствие НСl и пепсина (желудочная ахилия) наблюдается при атрофических гастритах и часто сопровождается пернициозной анемией вследствие недостаточности выработки фактора Касла и нарушения всасывания-витамина В12. Анацидность (рН желудочного сока >6,0) свидетельствует о значительной потере
слизистой оболочкой желудка обкладочных клеток, секретирующих соляную кислоту, что часто вызывает рак желудка.
При диагностике заболеваний желудка, кроме биохимических анализов, обязательно
проводят рентгенологические и эндоскопические исследования, а также биопсию.
41. Аминокислотный фонд клетки, пути использования аминокислот в клетке. Реакции метаболизма аминокислот, их значение в аминокислотном обмене. Роль витаминов.
Аминокислотный фонд клетки — основной источник азота для синтеза азотосодержащих соединений клетки. Аминокислоты, поступающие из желудочно-кишечного тракта, являются важным источником пополнения аминокислотного фонда клеток и тканей
