
Теория-1
.pdfожог, хирургическое вмешательство, интоксикация химическими веществами, кровотечение, боль, психическая травма) концентрация АКТГ в крови возрастает во много раз.
Механизм действия АКТГ включает взаимодействие с рецептором плазматической мембраны клеток, активацию аденилатциклазы и фосфорилирование белков, участвующих в синтезе кортикостероидов. Эти эффекты усиливаются в присутствии ионов Са2+.
Гормоны задней доли гипофиза
Задняя доля гипофиза, или нейрогипофиз, сек-ретирует 2 активных гормона - вазопрессин, или антидиуретический гормон (АДГ), и окситоцин.
Оба гормона образуются в гипоталамусе в нейронах разных гипоталамических ядер в форме прогормонов, из которых в результате посттрансляционной модификации образуются гормон и транспортный пептид нейрофизин. В процессе транспорта в клетки задней доли гипофиза гормоны остаются нековалентно связанными со своими транспортными пептидами.
Основные биологические эффекты вазопрессина проявляются через взаимодействие с 2 типами рецепторов. V1-рецепторы расположены в клетках гладкой мускулатуры сосудов в комплексе с фосфолипазой С. Результат трансдукции сигнала в эти клетки - сокращение сосудов. V2-рецепторы расположены в клетках почечных канальцев. Взаимодействие вазопрессина с V2-рецепторами активирует аденилатциклазную систему, увеличивая в клетках концентрацию цАМФ и активность протеинкиназы А.
Окситоцин стимулирует сокращение гладкой мускулатуры матки, а также играет важную роль в стимуляции лактации. Он вызывает сокращение миоэпителиальных клеток молочных желѐз, в результате чего происходит перераспределение молока из альвеолярных протоков в область соска.
61. Строение биологических мембран. Структурные факторы формирования липидного бислоя. Важнейшие белки, ферменты и липиды мембраны. Написать соответствующие формулы. Функции мембранных белков. Особенности строения эритроцитарной мембраны. Транспортные системы мембран.
Состав и строение биологических мембран. Биологические мембраны состоят из белков и липидов. Углеводы присутствуют лишь в качестве составных частей сложных белков (гликопротеинов) и сложных липидов (гликолипидов).
Липиды мембран представлены четырьмя основными группами: фосфолипидами (основная доля), сфинголипидами, гликолипидами и стероидами.
Фосфолипиды – это сложные эфиры фосфатидной кислоты. Основными фосфолипидами являются фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит и фосфатидилхолин.

Сфинголипиды, которые являются производными церамида и монофосфорных эфиров различных спиртов, представлены в основном сфингомиелином.
Гликолипиды – гликозильные производные церамида – представлены как нейтральными цереброзидами, так и их кислыми сульфоэфирами – сульфатидами.
Стероиды представлены холестерином.
Основу мембраны составляет двойной липидный слой, в формировании которого участвуют фосфолштиды и гликолипиды. Липидный бислой образован двумя рядами липидов, гидрофобные радикалы которых спрятаны внутрь, а гидрофильные группы обращены наружу и контактируют с водной средой. Белковые молекулы как бы "растворены" в липидном бислое. Мембранные липиды - амфифильные (амфипатические) молекулы, т.е. в молекуле есть как гидрофильные группы (полярные "головки"), так и алифатические радикалы (гидрофобные "хвосты"), самопроизвольно формирующие бислой
Функции мембранных белков.
Белки мембран различаются по своему положению в мембране . Они могут глубоко проникать в липидный бислой или даже пронизывать его - интегральные белки, либо разными способами прикрепляться к мембране - поверхностные белки.
Поверхностные белки
Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками липидного слоя.
Белки, образующие комплексы с интегральными белками мембраны
Ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к интегральным белкам мембран микроворсинок кишечника.
Примерами таких комплексов могут быть са-хараза-изомальтаза и мальтаза-гликоамилаза . Связь этих пищеварительных ферментов с мембраной позволяет с высокой скоростью гидролизовать субстраты и усваивать продукты гидролиза клеткой.
Белки, связанные с полярными «головками» липидов мембран
Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными "головками" липидов, образуя ионные и водородные связи. Иногда связывание белка -- необходимое условие проявления ферментативной активности. К таким белкам, например, относят протеинкиназу С, факторы свѐртывания крови.
Закрепление с помощью мембранного "якоря"
"Якорем" может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b5 мембраны
ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов
Трансмембранные (интегральные) белки
Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой
Трансмембранные домены, пронизывающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы, а неполярные контактируют с мембранными липидами.
Гликозилированные белки
Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина.
Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии.
Латеральная диффузия белков
Некоторые мембранные белки перемещаются вдоль бислоя (латеральная диффузия) или поворачиваются вокруг оси, перпендикулярно его поверхности.
Особенности строения эритроцитарной мембраны.
Мембрана эритроцитов отражает особенности биохимического строения мембран различных тканей, а именно представляет пластичную молекулярную мозаику, состоящую из белков,
липо- и гликопротеинов и, возможно, чисто липидных участков . В липидном бислое содержатся холестерин, фосфотидилсерин, фосфотидилэтаноламин, фосфотидилхолин, сфингомиелин, цереброзиды и другие липиды. Липиды в мембране эритроцита находятся исключительно в виде бислоя.
Белки в эритроцитарной мембране расположены неравномерно. Основная часть мембранных белков располагается на внутренней (цитоплазматической) стороне мембраны и образует сеть филаментов, которая служит для поддержания двояковогнутой формы эритроцита. Углеводная составляющая эритроцитарных мембран представлена в виде олигосахаридных цепей, ковалентно присоединенных к белкам (гликопротеины) и в меньшей степени к липидам (гликолипиды)
Фактор стабильности липидного бислоя определяется липидными порами. Эти поры образуются в местах дефектов жидкокристаллической структуры липидного бислоя
Транспортные системы мембраны.
Транспортные свойства мембраны характеризуются полупроницаемостью: некоторые соединения могут проникать через нее, а другие — нет:
Одна из главных функций мембран — регуляция переноса веществ. Существуют два способа переноса веществ через мембрану: пассивный и активный транспорт:
Пассивный транспорт. Если вещество движется через мембрану из области с высокой концентрацией в сторону низкой концентрации (т.е. по градиенту концентрации этого вещества) без затраты клеткой энергии, то такой транспорт называется пассивным, или диффузией. Различают два типа диффузии: простую и облегченную.
Простая диффузия характерна для небольших нейтральных молекул (H2O, CO2, O2), а
также гидрофобных низкомолекулярных органических веществ. Эти молекулы могут проходить без какого—либо взаимодействия с мембранными белками через поры или каналы мембраны до тех пор, пока будет сохраняться градиент концентрации.
Облегченная диффузия. Характерна для гидрофильных молекул, которые переносятся через мембрану также по градиенту концентрации, но с помощью специальных мембранных белков — переносчиков.
Активный транспорт имеет место в том случае, когда перенос осуществляется против градиента концентрации. Такой перенос требует затраты энергии клеткой. Активный транспорт служит для накопления веществ внутри клетки. Источником энергии часто является АТР. Для активного транспорта кроме источника энергии необходимо участие мембранных белков. Одна из активных транспортных систем в клетке животных отвечает за перенос ионов Na+ и K+ через клеточную мембрану. Эта система называется Na+ — K+ — насос.
Гемоглобин, строение, физиологические и патологические производные гемоглобина, роль в организме. Регуляция связывания кислорода с гемоглобином в тканях, схема Бора, роль 2,3- бифосфоглицерата. Синтез гема, роль микроэлементов, регуляция процесса.
Гемоглоби́н — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани.
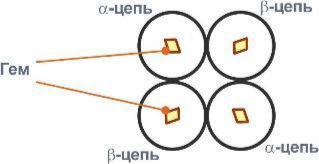
Строение гемоглобина
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком - контактной поверхностью
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно,
греч. - альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи Строение гемоглобина А
двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
HbР – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
HbF – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма обычно образуется спонтанно, в этом случае ферментативных мощностей клетки хватает на его восстановление
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической
гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
связывание кислорода гемоглобином регулируется специфическими компонентами

внутренней среды, а именно Н+, С02 и органическими фосфорными соединениями. Эти регуляторы оказывают сильнейшее влияние на способность гемоглобина связывать кислород, несмотря на то что они присоединяются к белку в участках, отстоящих далеко от гема.
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду. Это имеет особенное значение при подъеме на высоту, при нехватке кислорода во вдыхаемом воздухе.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются
ионы Н+ из гемоглобина.
В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород "вытесняет" ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Строение и синтез гема
Синтез гема в основном идет в предшественниках эритроцитов, клетках печени, почек, слизистой кишечника, и в остальных тканях. Первая реакция синтеза с участием ?- аминолевулинат-синтазы (греч. ? - "дельта") происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле.
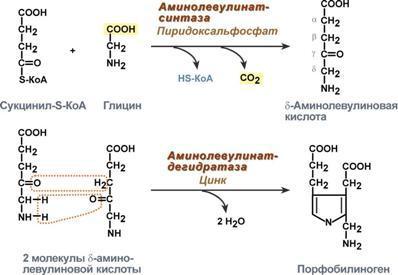
После синтеза порфобилиногена четыре его молекулы конденсируются в тетрапиррол.
Различают два вида тетрапирролов - уропорфириноген типа I и уропорфириноген типа
III. В синтезе обоих видов порфиринов принимает участие уропорфириноген I-синтаза, в образования уропорфириногена III дополнительно принимает участие фермент
уропорфириноген III-косинтаза.
Далее уропорфириногены превращаются в соответствующие копропорфириногены. Копропорфириноген III окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза
(гемсинтаза).
Регуляция синтеза гема
1.Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез "своих" белков.
2.Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
3.Положительным модулятором аминолевулинатсинтазы служит гипоксия тканей, которая в эритропоэтических тканях индуцирует синтез фермента.
4.В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления – при этом возрастает потребление гема для образования цитохрома Р450
Порфирии. Причины и метаболические нарушения, возникающие при порфириях. Диагностика порфирий.
Порфирины. В норме моча содержит лишь очень малые количества порфиринов I типа (до 300 мкг в суточном количестве). Однако выделение
порфиринов может резко возрасти (в 10–12 раз) при заболеваниях печени и пернициозной
анемии.
ПОРФИРИНЫ, прир. макрогетероциклич. пигменты, содержащие в молекуле цикл порфина
(цитохромы, каталаза, пероксидаза)
Порфирии — это группа наследственных заболеваний, в основе которых лежит нарушение биосинтеза гема, приводящее к избыточному накоплению в организме порфиринов и их предшественников. При порфирии из-за нарушения синтеза тема снимается механизм обратной связи, прекращается ингибирование скорость-лимитирующего фермента АЛК-
синтетазы, При порфирии врожденная мутация в одном из генов, отвечающих за синтез определенного фермента, приводит к дефициту фермента и накоплению порфиринов в организме. Порфирины присутствуют в организме любого человека, однако, у здоровых людей они не накапливаются.
Диагностика:
-моча: исследуется на содержание общих порфиринов, их предшественников — порфобилиногенов и δ-аминолевулиновой кислоты.
В норме общих порфиринов в моче не более 0.15 мг/л; порфобилиногена — 2 мг/л; δ-аминолевулиновой кислоты — 4.5 мг/л.
-кал: исследуется на содержание общих порфиринов. Нормальное количество — не более 200 нмоль/г.
Исследования проводятся методом высокоэффективной жидкостной хроматографии.
-Кровь(плазма и эритроциты): определяется количество общих порфиринов.
Симптомы.
Для заболевания свойственно образование на коже травматических или актинических пузырей чрезмерное повышение содержания в моче уропорфиринов по сравнению с нормой, некоторое повышение содержания копропорфиринов, наши чие в печени различного рода функциональных и органических изменений.
Механизм образования метгемоглобинемий, биохимические
принципы, лежащие в основе лечение метгемоглобинемий.
Метгемоглобинемии характеризуются повышенным содержанием в крови уровня метгемоглобина, представляющего собой одну из форм окисленного гемоглобина.
Этиология и патогенез
В эритроцитах имеется комплекс факторов, участвующих в восстановлении метгемоглобина в гемоглобин, среди которых важную роль играет метгемоглобин-редуктаза. У здоровых лиц метгемоглобин образуется всегда, но в незначительном количестве (0,1 — 1 %) под влиянием окислящих веществ, появляющихся в результате обмена веществ. При некоторых заболеваниях (легких, сердца) количество его может достигать 3—4 %. Метгемоглобин в отличие от оксигемоглобина содержит трехвалентное железо, стойко связывается с кислородом в легких и не отдает его тканям, что обусловливает развитие тканевой гипоксии.
Некоторые химические вещества могут изменять структуру гемоглобина, вызывая синдромы, которые называют по образующемуся при этом пигменту. К ним относится метгемоглобинемия: окисленный гемоглобин, содержащий трехвалентное железо вместо двухвалентного.
Лечение
Приобретенная метгемоглобинемия проходит самостоятельно после прекращения контакта с вызвавшим ее веществом. Однако содержание метгемоглобина порядка 30-40% опасно для жизни и требует введения метиленового синего , 1-2 мг/кг в/в. Этот краситель резко повышает активность НАДФН-метгемоглобинредуктазы и приводит к быстрому восстановлениюметгемоглобина в гемоглобин
Процесс и продукты распада гемоглобина, обмен желчных пигментов, роль в дифференциальной диагностике желтух.
Главными органами, в которых происходят разрушение эритроцитов и распад гемоглобина, являются печень, селезенка и костный мозг.
Распад гемоглобина в печени начинается с разрыва α-метиновой связи между I и II кольцами
порфиринового кольца. Этот процесс катализируется НАДФ-содержащей ок-сидазой и приводит к образованию зеленого пигмента вердоглобина
(холеглобина): 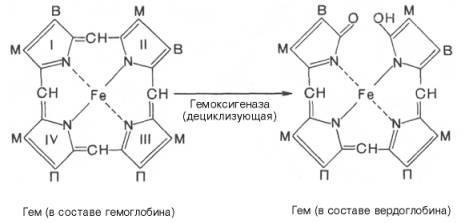
Дальнейший распад вердоглобина, вероятнее всего, происходит спонтанно с освобождением железа, белка-глобина и образованием одного из желчных пигментов – биливердина. Спонтанный распад сопровождается перераспределением двойных связей и атомов водорода в пиррольных кольцах и метиновых мостиках. Образовавшийся биливердин ферментативным путем восстанавливается в печени в билирубин, являющийся основным желчным пигментом у человека и плотоядных животных.
После этого билирубин вступает во взаимодействие с диазореактивом Эрлиха. При этом к билирубину присоединяются 2 остатка глюкуроновой кислоты с
образованием сравнительно индифферентного комплекса – билирубин-диглюкуронида, хорошо растворимого в воде и дающего прямую реакцию с диазореактивом.
Дальнейшая судьба желчных пигментов, точнее билирубина, связана с их превращениями в кишечнике под действием бактерий. Сначала глю-куроновая кислота отщепляется от комплекса с билирубином и освободившийся билирубин подвергается восстановлению в стеркобилиноген, который выводится из кишечника.
Диагностика.
В моче определяется два типа желчный пигментов: билирубин и уробилиноиды. Желчные пигменты образуются в печени при физиологическом распаде гемоглобина.
Далее из печени пигменты попадают в желчный пузырь, затем в кишечник. Из кишечника пигменты часть пигмента выделяется с калом, а часть всасывается в кровь. С током крови попадает в почки, из которых выводится вместе с мочой. Пигменты окрашивают мочу и кал в темный цвет.
Билирубин присутствует в моче в небольшом количестве, его увеличение свидетельствует о заболеваниях печени (гепатите) или застойных явлениях, например при желчекаменной болезни.
При гепатитах (из-за нарушения функции печени) уробилиноиды не перерабатываются и их количество в крови возрастает. Следовательно, и увеличивается их количество в моче. Повышение уробилиноидов в моче возникает на несколько дней раньше, чем билирубина, что помогает предположить гепатит на ранних стадиях еще до появления желтухи.
Надпеченочные желтухи обусловлены повышенным распадом эритроцитов и, как следствие, повышенным образованием билирубина, недостаточностью функции захвата билирубина печенью.
Печеночные желтухи обусловлены поражением гепатоцитов и, по некоторым данным, холангиол. По ведущему механизму можно выделить несколько вариантов печеночных
желтух. В одних случаях печеночная желтуха связана с нарушением экскреции и захвата билирубина, регургитацией билирубина. циррозе печени. В других случаях нарушаются экскреция билирубина и его регургитация.
Подпеченочные желтухи возникают в результате нарушения проходимости желчных протоков, ведущим механизмом при этом является нарушение экскреции и регургитации билирубина.
Антиоксидантная система / АОС / клетки. Ферменты АОС. Низкомолекулярные АО. Основные звенья антиоксидантной системы. Природные антиоксиданты (перечислить классы). Синергизм действия антиоксидантов. Значение АОС в ответной реакции организма на вредные факторы окружающей среды.
Для обеспечения максимальной защиты от окислительного стресса клетки имеют хорошо развитую антиоксидантную систему, которая содержит разные низко- и высокомолекулярные соединения, способные ―перехватывать‖ свободные радикалы или нейтрализовать источник из возникновения.
К высокомолекулярным антиоксидантам относят мембраносвязанные и цитозольные ферменты (супероксиддисмутаза, каталаза, глутатионзависимые пероксидазы и трансферазы).
Низкомолекулярные антиоксиданты разделяют на жирорастворимые (токоферолы, каротиноиды, убихинон) та водорастворимые (аскорбиновая кислота,
глутатион, тиоредоксин, билирубин, ураты). Следует отметить, что антиоксиданты бывают внутри и внешнеклеточные.
Ферменты антиоксидантной системы
Все ферменты антиоксидантной системы содержат в активном центре ионы металлов с переменной валентностью, которые в зависимости от условий выступают как окислитель, так и восстановитель.
Супероксиддисмутаза катализирует реакцию дисмутации супероксидных анион – радикалов:
О2.- + О2.- = О2 + Н 2О2
В ходе реакции образовался пероксид водорода, он способен инактивировать СОД, поэтому супероксиддисмутаза всегда «работает» в паре скаталазой, которая быстро и эффективно расщепляет пероксид водорода на абсолютно нейтральные соединения.
Каталаза (КФ 1.11.1.6) – гемопротеин, который катализирует реакцию обезвреживания пероксида водорода, образующегося в результате реакции дисмутации супероксидного радикала:
2H2O2 = 2H2O + O2
Природные антиоксиданты — токоферолы (витамины Е), нордигидрогваяретовую кислоту и др. — и синтетические антиоксиданты — пропиловый и додециловый эфиры галловой кислоты, бутилокситолуол (ионол) и др
Классификация антиоксидантов, являющихся по происхождению лекарственными
