
Теория-1
.pdf
CО2 — реакции карбоксилирования.
Водорододонорная функция — цикл Кребса поставляет на дыхательную цепь митохондрий протоны в виде трех НАДН.Н+ и одного ФАДН2.
Энергетическая функция — 3 НАДН.Н+ дает 7.5 моль АТФ, 1 ФАДН2 дает 1.5 моль АТФ на дыхательной цепи. Кроме того в цикле путем субстратного фосфорилирования синтезируется 1 ГТФ, а затем из него синтезируется АТФ посредствам трансфосфорилирования: ГТФ + АДФ = АТФ + ГДФ.
25.Взаимосвязь углеводного и белкового обменов (наличие общих метаболитов, пути их превращения).
Процессы обмена белков, углеводов, жиров и других соединений в живом организме неразрывно связаны друг с другом. Без этой взаимосвязи невозможно существование самого организма. Неразрывную связь и сопряженность различных сторон обмена веществ в организме можно проиллюстрировать на примере взаимосвязи процессов брожения и дыхания с реакциями белкового, липидного и углеводного обмена.
Анализ схемы свидетельствует о том, что белки в результате гидролиза образуют различные аминокислоты, которые в процессе окислительного дезаминирования дают аммиак и кетокислоты. Кетокислоты поступают в цикл Кребса. Наоборот, пировиноградная кислота, а также кетокислоты цикла три — и дикарбоновых кислот (а-кетоглутаровая, фумаровая, щавелевоуксусная) в результате аминирования или переаминирования образуют аминокислоты, которые организм использует в процессе биосинтеза белков.
Углеводы в результате гидролиза образуют моносахариды, которые способны дать фосфотриозы. Фосфотриозы в свою очередь образуют пировиноградную кислоту, поступающую в цикл Кребса. И, наоборот, фосфотриозы способны образовать глюкозу. Таким образом, цикл Кребса является связующим звеном обмена белков и углеводов в организме.
Апотомическое окисление глюкозы (написать реакции до стадии
образования пентоз). Биохимическая функция. Связь с антиоксидантной и детоксицирующей системами.
Пентозофосфатный путь представляет собой прямое окисление глюкозы и протекает в цитоплазме клеток. Наибольшая активность ферментов пентозофосфатного пути обнаружена в клетках печени, жировой ткани, коры надпочечников, молочной железы в период лактации, зрелых эритроцитах. Низкий уровень этого процесса выявлен в скелетных и сердечной мышцах, мозге, щитовидной железе, легких.
Пентозофосфатный путь называют также апотомическим путѐм, так как в его реакциях происходит укорочение углеродной цепи гексозы на один атом, который включается в молекулу СО2.
Пентозофосфатный путь выполняет в организме две важнейшие метаболические функции:
он является главным источником НАДФН для синтеза жирных кислот, холестерола, стероидных гормонов, микросомального окисления; в эритроцитах НАДФН используется для восстановления глутатиона – вещества, препятствующего пероксидному гемолизу;
он является главным источником пентоз для синтеза нуклеотидов, нуклеиновых кислот, коферментов (АТФ, НАД, НАДФ, КоА-SН и др.).
Исходным субстратом окислительной фазы является глюкозо-6-фосфат, который непосредственно подвергается дегидрированию с участием НАДФ-зависимой дегидрогеназы Таким образом, происходит укорочение углеродной цепи моносахарида на один

углеродный атом («апотомия»), и образуется рибулозо-5-фосфат.
Неокислительная фаза пентозофосфатного пути начинается с реакций изомеризации. В ходе этих реакций одна часть рибулозо-5-фосфата изомеризуется в рибозо-5-фосфат, другая - в ксилулозо-5-фосфат .
Значение этого пути в обмене веществ велико. Он поставляет восстановленный НАДФН, необходимый для биосинтеза жирных кислот, холестерина и т.д. За счет пентозофосфатного цикла примерно на 50% покрывается потребность организма в НАДФН.
Другая функция пентозофосфатного цикла заключается в том, что он поставляет пентозофосфаты для синтеза нуклеиновых кислот и многих коферментов. При ряде патологических состояний удельный вес пенто-зофосфатного пути окисления глюкозы возрастает.
Какие биохимические изменения характерны для сахарного диабета?
Биохимические тесты, используемые для дифференциальной диагностики инсулинзависимого и инсулиннезависимого сахарного диабета.
Сахарный диабет - заболевание, возникающее вследствие абсолютного или относительного дефицита инсулина.
1. Инсулинзависимый сахарный диабет
Инсулинзависимый сахарный диабет - заболевание, вызываемое разрушением р-клеток островков Лангерханса поджелудочной железы.
Деструкция β-клеток - результат аутоиммунных реакций. Провоцировать возникновение диабета I типа может вирусная инфекция, вызывающая деструкцию b-клеток. К таким вирусам, называемым β-цитотропными, относят вирусы оспы, краснухи, кори и т. д.
2. Инсулинонезависимый сахарный диабет
Инсулинонезависимый сахарный диабет - общее название нескольких заболеваний, развивающихся в результате относительного дефицита инсулина, возникающего вследствие нарушения секреции инсулина, нарушения превращения проинсулина в инсулин, повышения скорости катаболизма инсулина, а также повреждения механизмов передачи инсулинового сигнала в клетки-мишени
Возможными причинами ИНСД могут быть: образование антител к рецепторам инсулина; генетический дефект пострецепторного аппарата инсулинзависимых тканей; нарушения регуляции секреции инсулина
Нарушения при сахарном диабете. 1. Симптомы сахарного диабета
повышение концентрации глюкозы в крови - гипергликемия. После приѐма пищи концентрация глюкозы может достигать 300-500 мг/дл и сохраняется на высоком уровне в постабсорбтивном периоде, т.е. снижается толерантность к глюкозе.
Повышение концентрации глюкозы в плазме крови обусловлено снижением скорости использования глюкозы тканями вследствие недостатка инсулина или снижения биологического действия инсулина в тканях-мишенях.
При дефиците инсулина уменьшается количество белков-переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани и мышц). В
мышцах и печени глюкоза не депонируется в виде гликогена, в жировой ткани уменьшается скорость синтеза и депонирования жиров.
Повышение концентрации глюкозы в крови при сахарном диабете превышает концентрационный почечный порог, что становится причиной выделения глюкозы с мочой (глюкозурия).
К характерным признакам сахарного диабета относят также повышение концентрации в крови кетоновых тел - кетонемия.
Накопление кетоновых тел снижает буферную ѐмкость крови и вызывает ацидоз.
Ещѐ один характерный признак сахарного диабета - повышенный уровень в крови липопротеинов (в основном, ЛПОНП) - гипер-липопротеинемия. Пищевые жиры не депонируются в жировой ткани вследствие ослабления процессов запасания, а поступают в печень, где частично превращаются в триацилглицеролы, которые транспортируются из печени в составе ЛПОНП.
Высокие концентрации глюкозы, кетоновых тел, мочевины требуют усиленной экскреции их из организма. полиурия. Потеря воды вызывает постоянную жажду -
полидипсия.
Диагностика:
Определение концентрации глюкозы в крови. Это один из наиболее специфических тестов на сахарный диабет. Нормальная концентрация глюкозы в крови (гликеемия) натощак колеблется в пределах 3,3-5,5 ммоль/л. Повышение концентрации глюкозы выше этого уровня свидетельствует о нарушении метаболизма глюкозы.
глюкозотолерантный тест, . Тест проводится в утренние часы после 10-14 часов ночного голодания. Пациенту дают выпить раствор содержащий 75 граммов чистой глюкозы. Определение концентрации глюкозы в крови проводят через 1 час и спустя 2 после употребления глюкозы. Нормальным результатом считают концентрацию глюкозы менее 7,8 ммоль/л спустя два часа после употребления глюкозы. Если концентрация глюкозы колеблется от 7,8 до 11 ммоль/л, то состояние исследуемого расценивается как нарушение толерантности к глюкозе (предиабет). Диагноз диабет устанавливается если концентрация глюкозы превышает 11 ммоль/л через два часа с начала проведения теста.
Определение глюкозы в моче. В норме глюкоза в моче отсутствует. При сахарном диабете повышение гликемии достигает значений позволяющих глюкозе проникать через почечный барьер. Определение глюкозы в крови является дополнительным методом диагностики диабета.
Определение ацетона в моче (ацетонурия) – нередко диабет осложняется нарушением обмена веществ с развитие кетоацидоза (накопление в крови органических кислот промежуточных продуктов метаболизма жиров). Определение в моче кетоновых тел служит признаком тяжести состояния пациента с кетоацидозом.
Классификация липидов. Строение и биологическая роль
фосфолипидов. Синтез фосфолипидов. Пищевые факторы, необходимые для полноценного синтеза фосфолипидов в клетках организма.
Липиды - это разнообразная по строению группа органических веществ, которые объединены общим свойством - растворимостью в неполярных растворителях.
КЛАССИФИКАЦИЯ ЛИПИДОВ
Липиды по способности к гидролизу делят на омыляемые (двух и более компонентные) и
неомыляемые (однокомпонентные).
Омыляемые липиды в щелочной среде гидролизуются с образованием мыл, они содержат в своем в составе жирные кислоты и спирты глицерин (глицеролипиды) или сфингозин (сфинголипиды). По количеству компонентов омыляемые липиды делятся на простые (состоят из 2 классов соединений) и сложные (состоят из 3 и более классов).
К простым липидам относятся:
1)воска (сложный эфир высшего одноатомного спирта и жирной кислоты);
2)триацилглицериды, диацилглицериды, моноацилглицериды (сложный эфир глицерина
ижирных кислот).
3)церамиды (сложный эфир сфингозина и жирной кислоты С18-26) – лежат в основе сфинголипидов;
К сложным липидам относятся:
1)фосфолипиды (содержат фосфорную кислоту):
а) фосфоглицеролипиды (сложный эфир глицерина и 2 жирных кислот, содержит фосфорную кислоту и аминоспирт) - фосфатидилсерин, фосфатидилэтаноламин, фосфатидилхолин, фосфатидилинозитол, фосфатидилглицерол;
б) кардиолипины (2 фосфатидные кислоты, соединенные через глицерин); в) плазмалогены (сложный эфир глицерина и жирной кислоты, содержит
ненасыщенный одноатомный высший спирт, фосфорную кислоту и аминоспирт) – фосфатидальэтаноламины, фосфатидальсерины, фосфатидальхолины;
г) сфингомиелины (сложный эфир сфингозина и жирной кислоты С18-26, содержит фосфорную кислоту и аминоспирт - холин);
2)гликолипиды (производные сфингозина, содержащие углеводы):
а) цереброзиды (сложный эфир сфингозина и жирной кислоты С18-26, содержит гексозу: глюкозу или галактозу);
б) сульфатиды (сложный эфир сфингозина и жирной кислоты С18-26, содержит гексозу (глюкозу или галактозу) к которой присоединена в 3 положение серная кислота). Много в белом веществе;
в) ганглиозиды (сложный эфир сфингозина и жирной кислоты С18-26, содержит олигосахарид из гексоз и сиаловых кислот). Находятся в ганглиозных клетках;
К неомыляемым липидам относят:
8.стероиды;
9.жирные кислоты (структурный компонент омыляемых липидов),
10.витамины А, Д, Е, К;
Фосфолипи́ды — сложные липиды, сложные эфиры многоатомных спиртов и высших жирных кислот. Содержат остаток фосфорной кислоты и соединенную с ней добавочную группу атомов различной химической природы.
В зависимости от входящего в их состав многоатомного спирта принято делить фосфолипиды на три группы:
глицерофосфолипиды (глицерофосфатиды) — содержат остаток глицерина фосфосфинголипиды — содержат остаток сфингозина фосфоинозитиды — содержат остаток инозитола
Фосфолипиды — сложные липиды, в которых содержатся жирные кислоты, фосфорная кислота и дополнительная группа атомов, во многих случаях содержащая азот. Они есть во всех живых клетках. Содержатся в нервной ткани, участвуют в транспорте жиров, жирных кислот и холестерина.
Фосфолипиды входят в состав всех клеточных мембран.
Состав.
Они состоят из полярной «головки», в состав которой входит глицерин или другой

многоатомный спирт, отрицательно заряженный остаток фосфорной кислоты и часто несущая положительный заряд группа атомов, и двух неполярных «хвостов» из остатков жирных кислот. Главная особенность фосфолипидов состоит в том, что «головка» у них гидрофильна, а «хвосты» гидрофобны. Это позволяет при нахождении в толще водной среды образовывать бислой — двойной слой фосфолипидных молекул, где гидрофильные головы с обеих сторон соприкасаются с водой, а гидрофобные хвосты упрятаны внутрь бислоя и тем самым защищены от контакта с водой.
Это определяет многие физические и химические свойства фосфолипидов, например, способность формировать липосомы и биологические мембраны (липидный бислой).
Биороль:
Фосфолипиды являются важной частью клеточных мембран.
Фосфолипиды участвуют в транспорте жиров, жирных кислот и холестерина. Между плазмой и эритроцитами происходит обмен фосфолипидами, которые играют важнейшую роль, поддерживая в растворимом состоянии неполярные липиды.
Фосфолипиды замедляют синтез коллагена и повышают активность коллагеназы
Биосинтез фосфатидилэтаноламина. Первоначально этаноламин при участии соответствующей киназы фосфорилируется с образованием фосфоэтаноламина:
Затем фосфоэтаноламин взаимодействует с ЦТФ, в результате чего образуются цитидиндифосфатэтаноламин (ЦДФ-этаноламин) и пирофосфат (PPi):
В следующей реакции ЦДФ-этаноламин, взаимодействуя с 1,2-дигли-церидом, образующимся при дефосфорилировании фосфатидной кислоты, превращается в фосфатидилэтаноламин. Реакция катализируется ферментом этаноламинфосфотрансферазой:
ЦДФ-этаноламин |
+ |
1,2-диглицерид |
–> |
Фосфатидилэтаноламин |
+ |
ЦМФ. |
||
Биосинтез |
фосфатидилхолина |
(лецитина). |
Фосфатидилэтаноламин |
|
является |
|||
предшественником фосфатидилхолина. В результате последовательного переноса трех
метальных групп от трех молекул S-аденозилметионина |
к аминогруппе остатка этаноламина |
образуется |
фосфатидилхолин: |
Биосинтез фосфатидилсерина. У млекопитающих фосфатидилсерин образуется в реакции обмена этаноламина на серин следующим путем:
Биосинтез сфингомиелина. Интермедиатом в биосинтезе сфингомиелина является церамид (N-ацилсфингозин), который образуется при взаимодействии сфингозина с ацил-КоА. Сфингомиелин синтезируется в результате взаимодействия (реакции) церамида с ЦДФхолином:
Липотропные факторы – вещества, способствующие синтезу фосфолипидов и препятствующие отложению триацилглицеролов в тканях.(холин, метианин,фолиевая кислота и витамин В12 фолиевая кислота и витамин В12)
Липотропный эффект этих соединений связан с тем, что общим предшественником триацилглицеролов и фосфолипидов является фосфатидная кислота. При недостатке липотропных факторов фосфатидная кислота используется преимущественно для синтеза

триацилглицеролов.
Полиненасыщенные жирные кислоты, строение, - 6 и - 3 жирные
кислоты, образование эйкозаноидов. Пути биотрансформации арахидоновой кислоты и 3 - жирных кислот в организме,
биологическая роль.
Кислоты, имеющие одну двойную связь, называются мононенасыщенные, две и более двойные связи — полиненасыщенные.
ПНЖК, необходимые человеку, но не синтезируемые в их организмах, называют незаменимыми. К незаменимым ПНЖК относятся 18-атомные кислоты семейств n-6 и n-3.
Омега-3 полиненасыщенные жирные кислоты (ПНЖК) относятся к семейству ненасыщенных жирных кислот, имеющих двойную углерод-углеродную связь в омега-3 позиции, то есть после третьего атома углерода, считая от метилового конца цепи жирной кислоты.
Наиболее важными омега-3 полиненасыщенными жирными кислотами являются альфалиноленовая кислота (АЛК), эйкозапентаеновая кислота (ЭПК) идокозагексаеновая кислота (ДГК). Организм человека не способен синтезировать эти жирные кислоты из более простых веществ.
Омега-6 полиненасыщенные жирные кислоты (ПНЖК) относятся к семейству ненасыщенных жирных кислот, имеющих двойную углерод-углеродную связь в омега-6 позиции, то есть между шестым и седьмым атомами углерода, считая от метилового конца цепи жирной кислоты. (линолевая, линоленовая и арахидоновая).
Источники
Растительные масла (кроме пальмового и оливкового), рыба.
Полиненасыщенные жирные кислоты обладают весьма широкими функциями:
1.Структурная - является составной частью фосфолипидов мембран;
2.Защита витамина А от окисления;
3.Предшественник регуляторных соединений, носящих название эйкозаноиды – простагландинов (в том числе простациклинов), тромбоксанов, лейкотриенов. Простациклины, тромбоксаны, лейкотриены являются "местными гормонами", т.е. после синтеза действуют только на соседние клетки.
функцией простагландинов является регуляция тонуса гладких мышц сосудов, ЖКТ, бронхолегочной системы, мочеполовой системы.
функция простациклинов – уменьшение агрегации тромбоцитов и расширение мелких сосудов.
функция тромбоксанов – усиление агрегации тромбоцитов и сужение мелких сосудов.
функция лейкотриенов – активация лейкоцитов, увеличение их подвижности, а также регуляция тонуса сосудов.
В процессе биотрансформации арахидоновой кислоты в организме вырабатываются не
только ПГ, но и другие физиологически активные вещества (тромбоксан, лейкотриены). Синтез ПГ происходит под влиянием фермента циклооксигеназы (ЦОГ), простациклина (ПГ2) — простациклинсинтетазы, а тромбоксана (ТХА2) — тромбоксансинтетазы.
Главный субстрат для синтеза эйкозаноидов у человека - арахидоновая кислота (20:4, ω-6), так как еѐ содержание в организме человека значительно больше остальных полиеновых кислот-предшественников эйкозаноидов (см, выше табл. 8-1).
В меньшем количестве для синтеза эйкозаноидов используются эйкозапентаеновая (20:5, ω-3) и эйкозатриеновая (20:3, ω-6) жирные кислоты.
Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются только в тромбоцитах, откуда и происходит их название, и стимулируют их агрегацию при образовании тромба.
Эйкозаноиды - гормоны местного действия по ряду признаков:
образуются в различных тканях и органах, а не только в эндокринных железах; действуют по аутокринному или паракринному механизмам;
концентрация эйкозаноидов в крови меньше, чем необходимо, чтобы вызвать ответ в клетках-мишенях.
Многие эйкозаноиды выполняют функцию медиаторов воспаления и действуют на всех этапах воспаления. В результате увеличивается проницаемость капилляров, транссудат и лейкоциты проходят через сосудистую стенку.
Переваривание и всасывание липидов в желудочно-кишечном
тракте. Роль желчных кислот. Ресинтез липидов в стенке кишечника. Транспорт эндогенных липидов.
Эмульгирование жиров
Переваривание жиров происходит в тонком кишечнике, однако уже в желудке небольшая часть жиров гидролизуется под действием "липазы языка". Эмульгирование (смешивание жира с водой) происходит в тонком кишечнике под действием солей жѐлчных кислот. Жѐлчные кислоты синтезируются в печени из холестерола и сек-ретируются в жѐлчный пузырь.После приѐма жирной пищи жѐлчный пузырь сокращается и жѐлчь изливается в просвет двенадцатиперстной кишки. Жѐлчные кислоты действуют как детергенты, располагаясь на поверхности капель жира и снижая поверхностное натяжение. В результате крупные капли жира распадаются на множество мелких, т.е. происходит эмульгирование жира. Эмульгирование приводит к увеличению площади поверхности раздела фаз жир/вода, что ускоряет гидролиз жира панкреатической липазой. Эмульгированию способствует и перистальтика кишечника.
Гормоны, активирующие переваривание жиров.
При поступлении пищи в желудок, а затем в кишечник клетки слизистой оболочки тонкого кишечника начинают секретировать в кровь пептидный гормон холецистокинин. Этот гормон действует на жѐлчный пузырь, стимулируя его сокращение, и на экзокринные клетки поджелудочной железы, стимулируя секрецию пищеварительных ферментов, в том числе панкреатической липазы.
Другие клетки слизистой оболочки тонкого кишечника в ответ на поступление из желудка кислого содержимого выделяют гормон секретин. Секретин - гормон пептидной природы,
стимулирующий секрецию бикарбоната (НСО3-) в сок поджелудочной железы.
Переваривание жиров панкреатической липазой

Переваривание жиров - гидролиз жиров панкреатической липазой. Панкреатическая липаза гидролизует жиры преимущественно в положениях 1 и 3, поэтому основными продуктами гидролиза являются свободные жирные кислоты и 2-моноацилглицеролы (β- моноацилглицеролы). Колипаза своим гидрофобным доменом связывается с поверхностью мицеллы эмульгированного жира, а другой частью ускоряет переваривание.
Переваривание других липидов
Кроме жиров, с пищей поступают фосфолипиды, эфиры холестерола.
Переваривание глицерофосфолипидов
В переваривании глицерофосфолипидов участвуют несколько ферментов, синтезирующихся в поджелудочной железе. Фосфолипаза А2 гидролизует сложноэфирную связь у второго
атома углерода глицерола, превращая глицерофосфолипиды в соответствующие лизофосфолипиды. Жирная кислота в положении 1 отщепляется под действием лизофосфолипазы, а глицерофосфохолин гидролизуется далее до глицерола, холина и фосфорной кислоты, которые всасываются.
Ресинтез жиров в слизистой оболочке тонкого кишечника
После всасывания продуктов гидролиза жиров жирные кислоты и 2-моноацилглицеролы в клетках слизистой оболочки тонкого кишечника включаются в процесс ресинтеза с образованием триацилглицеролов (рис. 8-16). Жирные кислоты вступают в реакцию этерификации только в активной форме в виде производных коэнзима А, поэтому первая стадия ресинтеза жиров - реакция активации жирной кислоты:
HS КоА + RCOOH + АТФ → R-CO ~ КоА + АМФ + Н4Р2О7.
Затем ацил~КоА участвует в реакции этерификации 2-моноацилглицерола с образованием сначала диацилгли-церола, а затем триацилглицерола.
Транспорт эндогенных липидов
Транспортной формой эндогенного жира и холестерина из печени в другие ткани являются ЛОНП - липопротеины очень низкой плотности. Ядро этих частиц состоит из эндогенных триацилглицеринов и холестерина, а оболочка - из фосфолипидов, белка апоВ100 (образуется в печени, молекулярная масса 100кДа).
Из печени ЛОНП поступают в кровь, где к ним присоединяются белки апоЕ и апоС.
АпоС - активатор липопротеин-липазы капилляров, расщепляет триглицериды, образуются глицерин и жирные кислоты - они поступают в ткань. Затем ЛОНП теряет апоС, превращаясь в ЛПП - липопротеины промежуточной плотности. ЛПП, теряя апоЕ, превращается липопротеины низкой плотности (ЛНП).
Желчные кислоты, образование, строение, роль в организме.
В печени из холестерина образуются желчные кислоты. Эти стероидные соединения с 24 атомами углерода являются производные холановой кислоты. В организме человека наиболее важна холевая кислота.
Кроме холевой кислоты в желчи содержится также хенодезоксихолевая кислота. Она отличается от холевой отсутствием гидроксильной группы при С-12. Оба соединения

принято называть первичными желчными кислотами. В количественном отношении это наиболее важные конечные продукты обмена холестерина.
Другие две кислоты, дезоксихолевая и литохолевая, называются вторичными желчными кислотами, поскольку они образуются путем дегидроксилирования по С-7 первичных кислот
в |
|
желудочно-кишечном |
|
тракте. |
||
|
|
|
Cинтез. |
|
|
|
Первичные |
жѐлчные |
кислоты |
(холевая и хенодезоксихолевая) |
синтезируются |
||
в гепатоцитах печени |
из холестерина. |
Жѐлчные |
кислоты |
образуются |
||
в митохондриях гепатоцитов и вне их изхолестерина с участием АТФ. |
|
|||||
В кишечнике |
часть |
первичных желчных |
кислот под |
действием кишечных |
||
бактерий подвергается деконъюгированию и 7a-дегидроксилированию, в результате чего образуются вторичные желчные кислоты: из холевой кислоты - дезоксихолевая кислота и из хенодезоксихолевой кислоты - литохолевая кислота .
По химическому строению эти соединения близки к холестерину. Для желчных кислот характерно наличие укороченной разветвлённой боковой цепи с карбоксильной группой на конце. Двойная связь в кольце В отсутствует, а кольца А и В сочленены в цис-положении
Роль желчи
1.Наряду с панкреатическим соком нейтрализация кислого химуса, поступающего из желудка. При этом карбонаты взаимодействуют с НСl, выделяется углекислый газ и происходит разрыхление химуса, что облегчает переваривание.
2.Усиливает перистальтику кишечника.
3.Обеспечивает переваривание жиров:
эмульгирование для последующего воздействия липазой, необходима комбинация [желчные кислоты+жирные кислоты+моноацилглицеролы],
уменьшает поверхностное натяжение, что препятствует сливанию капель жира,
образование мицелл, способных всасываться.
4.Благодаря п.п.1 и 2 обеспечивает всасывание жирорастворимых витаминов (витамин A, витамин D, витамин K, витамин E).
5.Экскреция избытка ХС, желчных пигментов, креатинина, металлов Zn, Cu, Hg, лекарств. Для холестерина желчь – единственный путь выведения, с ней может выводиться 1-2 г/сут.
32.Пути энергетического использования липидов (написать соответствующие реакции). Роль высших жирных кислот в энергетическом метаболизме. Энергетический баланс на примере
стеариновой |
кислоты. |
Окисление жирных кислот (β-окисление)
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2 и воды, тесно связанный
с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление,
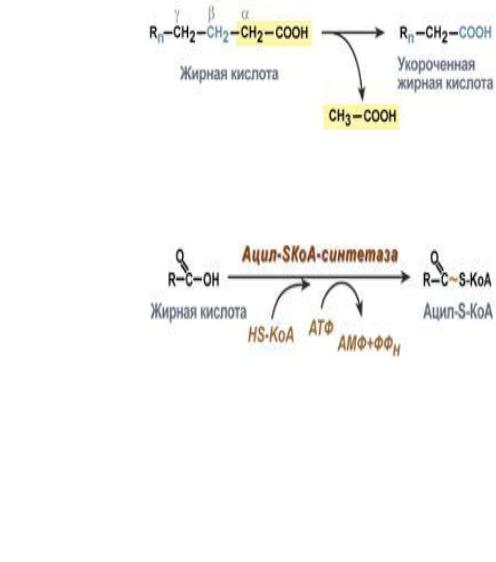
т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа,
включающая С1 и С2 исходной жирной кислоты.
Этапы окисления жирных кислот
1.Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная кислота должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с образованием ацил-S-КоА.
2.Ацил-S-КоА не способен проходить через митохондриальную мембрану, поэтому существует способ его переноса в комплексе с витаминоподобным веществом карнитином
3.После связывания с карнитином жирная кислота переносится через мембрану транслоказой. Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь образует ацил-S-КоА который вступает на путь β-окисления.
4.Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. В
них последовательно происходит окисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА- дегидрогеназа).
Энергетический эффект β-окисления ВЖК. Поскольку природные ВЖК содержат, как правило, четное число атомов углерода, обозначим количество атомов углерода как 2n. В каждом этапе β-окисления ацил ВЖК уменьшается на 2 углеродных атома, следовательно, ацил ВЖК с 2n углеродными атомами подвергается (п - 1) этапу β-окисления. При полном окислении ВЖК образуется пмоль ацетил-КоА и по (п - 1) моль восстановленных НАД и ФАД. В каждом этапе окисления ВЖК оба кофермента - 5 моль АТФ, а при полном окислении - 5 (п - 1) моль АТФ. Полный распад ацетил-КоА в цикле Кребса дает 12 моль АТФ, а п моль ацетил-КоА - 12n моль АТФ. Вспомним, что на активацию ВЖК затрачивается 1 моль АТФ. В итоге энергетический эффект β-окисления ВЖК можно выразить формулой: (17п - 6) АТФ, где п равно половине числа атомов углерода, содержащихся в конкретной ВЖК. Например, энергетический эффект β-окисления 1 моль стеариновой кислоты равен 147 моль АТФ.
Синтез кетоновых тел в печени. При низком соотношении инсулин/глюкагон в крови в жировой ткани активируется распад жиров. Жирные кислоты поступают в печень в большем количестве, чем в норме, поэтому увеличивается скорость β-окисления (рис. 8-32). Скорость реакций ЦТК в этих условиях снижена, так как оксалоацетат используется для
