
- •Введение
- •1. Аналитический обзор. Выбор направления исследований
- •1.1. Флотация, электрофлотация, электрофлотокоагуляция, современные направления извлечения взвешенных веществ, цветных, редкоземельных металлов и органических веществ. Научные школы
- •2. Методическая часть
- •2.3. Определение характеристик дисперсной фазы
- •2.4. Информация об использованных в работе ПАВ, флокулянтах и коагулянтах
- •2.5. Характеристика некоторых образцов дисперсной фазы
- •4. Новые области применения электрофлотационных процессов. Основные научные результаты
- •5.2. Роль дисперсной фазы в эффективности электрофлотацинного процесса
- •Заключение
- •Список сокращений и условных обозначений
- •Список литературы
- •Приложение 1
- •Акты и протоколы опытно-промышленных и промышленных испытаний установок для очистки сточных вод
- •Приложение 2
86
2.5. Характеристика некоторых образцов дисперсной фазы
Химический состав порошков исследовали методом рентгенофлуоресцентной спектрометрии на энергодисперсинном спектрометре EDX-7000 (Shimadzu, Япония).
Результаты анализа представлены в таблице 2.10.
Таблица 2.10 – Состав исследованных в работе неорганических порошков
TiO2 |
Ti – 99,43%, K – 0,27 %, Nb – 0,25%, Cu – 0,046% и др. |
|
TiN |
Ti – 99,2%, Fe – 0,2%, Ni – 0,14%, Cu – 0,12%, Ca – 0,12%, Cr – 0,06%, |
|
Mn – 0,06% и др. |
||
|
||
Sc2O3 |
Sc – 99,4%, Fe – 0,026%, Th – 0,027%, Zr – 0,019%, Y – 0,015% |
|
FeCx |
Fe – 82,7%, Co – 10,4%, S – 1,9%, Ti – 1,1%, Cu – 1,0%, Ni – 0,9%, |
|
Cr – 0,7%, Zn – 0,6% |
||
|
||
SiC |
Si – 95–99%, C – 1–5%, Na – 1–5% Al – 1–5% Fe – 1–5% |
Морфологические исследования поверхности порошков проводили с помощью объектива MPLAPONLEXT 100 на конфокальном лазерном микроскопе LEXT–OSL 4100
(OLYMPUS Corporation, Япония). Оценивалась структура слоя, а также степень развития поверхности. Измерения проводили в двух- и трехмерной системе координат.
Определение химического состава и морфологические исследования выполнены на кафедре Инновационных материалов и защиты от коррозии РХТУ им. Д.И. Менделеева.
Фотографии исследованных порошков при различных увеличениях: 107, 429, 1069, 2147
представлены в главе 5.
Уголь активный марки ОУ-А – это высококачественный уголь активный изготавливается из экологически чистого сырья (древесины березы) под воздействием водяного пара при температуре 800–950 °С с последующим измельчением, представляет собой тонкодисперсный пористый материал, состоящий в основном из углерода, имеет сильно развитую общую пористость, широкий диапазон пор и большую величину удельной поглощающей поверхности (более 1200м2 в 1 г угля). Технические характеристики «Уголь активный осветляющий древесный порошкообразный ОУ-А и ОУ-Б» приведены в таблице 2.11.

87
Уголь ОУ-Б – это уголь активный, получаемый из экологически чистого сырья –
древесины березы методом обработки водяным паром при температуре 800–950 °C с
последующим измельчением и выщелачиванием в растворе соляной кислоты. Уголь
активный ОУ-Б представляет собой углеродосодержащий тонкодисперсный порошок с
сильно развитой внутренней пористостью, широким диапазоном пор и большой величиной удельной поглощающей поверхности (не менее 850 м2 в 1 г угля).
Технические характеристики «Уголь активный древесный дробленый БАУ»
представлены в таблице 2.12.
Таблица 2.11 – Технические характеристики «Уголь активный осветляющий древесный
порошкообразный ОУ-А и ОУ-Б»
Наименование показателя |
ОУ-А |
|
ОУ-Б |
|
|
|
|
|
|
ГОСТ |
|
4453-74 |
||
|
|
|||
Внешний вид угля активного |
Тонкодисперсионный порошок черного цвета без |
|||
механических примесей |
||||
|
||||
|
|
|
|
|
Активность по метиленовому |
225 |
|
210 |
|
голубому, мг/г, не менее |
|
|||
|
|
|
||
|
|
|
|
|
Адсорбционная активность по |
100 |
|
100 |
|
мелассе, %, не менее |
|
|||
|
|
|
||
|
|
|
|
|
Массовая доля водорастворимой |
2 |
|
1 |
|
золы, %, не более |
|
|||
|
|
|
||
|
|
|
|
|
Массовая доля влаги, %, не |
10 |
|
10 |
|
более |
|
|||
|
|
|
||
|
|
|
|
|
Степень измельчения, остаток |
|
|
|
|
на сетке с размером ячейки 100 |
5 |
|
Не нормируется |
|
мкм, %, не более |
|
|
|
|
|
|
|
|
|
Массовая доля золы, %, не более
pH водной вытяжки
Массовая доля соединений железа в пересчете на Fe, %, не более
10 |
6 |
|
|
Не нормируется |
4–6 |
|
|
0,2 |
0,2 |
|
|
Содержание водорастворимых |
Отсутствует |
Не нормируется |
||
соединений железа |
||||
|
|
|||
|
|
|
|
|
Основной размер частиц, мм |
Не нормируется |
Менее 0,1 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

88
Таблица 2.12 – Технические характеристики «Уголь активный древесный дробленый
БАУ» [ГОСТ 6217-74]
Наименование показателя |
Норма |
|
|
|
|
Внешний вид угля БАУ-А |
Зерна черного цвета без |
|
механических примесей |
||
|
||
|
|
|
Размер зерен: |
|
|
>3,6 мм, %, не более |
2,5 |
|
3,6–1,0 мм, %, не менее |
95,5 |
|
<1,0 мм, %, не более |
2,0 |
|
|
|
|
Адсорбционная активность по йоду, %, не |
60 |
|
менее |
||
|
||
|
|
|
Суммарный объем пор по воде, см3/г, не менее |
1,6 |
|
Насыпная плотность, г/дм3, не более |
240 |
|
Массовая доля золы, %, не более |
6,0 |
|
|
|
|
Массовая доля влаги, %, не более |
10,0 |
|
|
|
89
3. Основные результаты научных исследований электрофлотационного процесса
для очистки сточных вод от труднорастворимых соединений металлов
Рассмотрим теоретические предположения и результаты экспериментов по оценке эффективности электрофлотационных процессов, протекающих в водных растворах в
электрофлотационных установках непроточного типа.
Лабораторные эксперименты в установках непроточного типа дают общую информацию о протекании процесса электрофлотационного извлечения, в первую очередь, о влиянии на степень извлечения таких факторов, как размер и заряд частиц,
изменение рН, адсорбция ионов электролита, присутствие флокулянтов и ПАВ различной
природы, природа коагулянта, концентрация и газонасыщение раствора.
Для электрофлотации модель учитывает формирование двух газов: H2 на катоде и О2 на аноде, газонасыщение и скорость барботирования газа через электрофлотационный аппарат заданного объема, с учетом высоты аппарата и площади газонасыщения может
быть рассчитана. Схема формирования флотокомплекса представлена в работе [5]
|
На практике для анализа кинетики часто используют уравнения [11]: |
|
|
α = 1 – е-K/τ, |
(10) |
где α – степень извлечения дисперсной фазы, %; τ – время, мин. |
|
|
K – константа скорости перехода дисперсной фазы в пенный продукт |
|
|
|
Величина К = P1·P2·P3·P4, |
(11) |
где P1 – вероятность столкновения комплекса «частица – пузырек»; |
|
|
P2 |
– вероятность прилипания комплекса «частица – пузырек»; |
|
P3 |
– вероятность удержания комплекса «частица – пузырек» в растворе; |
|
P4 |
– вероятность удержания комплекса «частица – пузырек» в пенном слое на границе |
|
раздела фаз «раствор – воздух». |
|
|
|
Величина К связана с эффективностью захвата «частица–пузырек» |
Е, |
газонасыщением Jv, размером пузырьков Dпуз, размером частиц Dчаст и
полидисперсностью частицы и пузырька K0’ и может быть оценена по формуле:
|
E∙Iv∙Dчаст∙K0’ |
|
|
K = |
|
, |
(12) |
|
|||
|
Dпуз∙K0 |
|
|
где E – эффективность захвата комплекса «частица–пузырек», трудно-определяемая экспериментальная величина, зависящая от многих факторов.
90
Анализ показывает, что вероятность столкновения частиц размером меньше 10 мкм с пузырьками с размером 40–60 мкм близка к нулю.
Вероятность P2 зависит от химических свойств поверхности, структуры поверхностных слоев, гидрофобности или гидрофильности поверхности, заряда поверхности и заряда пузырьков (ζ-потенциал), адсорбции анионов, катионов ПАВ;
флокуляции частиц и пузырьков, гетерокоагуляции «частица – коагулянт», краевого угла смачивания «пузырек – частица» и ряда других факторов.
Вероятность P3 и P4 имеет большие значения для мелких пузырьков, характерных для электрофлотации в отличии от других флотационных процессов. ПАВ стабилизирует пузырьки в ЭФ аппарате на уровне 5–30 мкм [117].
Величина К имеет большие значения для гидрофильных частиц, чем для гидрофобных. Предложены основные подходы к повышению эффективности электрофлотационного процесса:
1)Гидрофобизация поверхности дисперсной фазы (H2O↔ПАВ);
2)Создание нового флотокомплекса:
дисперсная фаза – флокулянт, ПАВ;
дисперсная фаза – коагулянт (Fe, Al, Ti);
дисперсная фаза – композиция (коагулянт – ПАВа);
3)Увеличение размера частиц (30 – 100 мкм) (флокулянт, pH, ζ – потенциал,
концентрация, коагулянт);
4)Изменение электрокинетического потенциала, ζ→0 (pH, ПАВ, катионы –
Ca2+, Mg2+, анионы – SO42-, PO43-);
5)Изменение природы и структуры дисперсной фазы (аморфная, рыхлая),
(гидроксиды, фосфаты, сульфиды, карбонаты);
6)Стабилизация размера пузырьков в присутствии ПАВ;
7)Управление режимом газонасыщения (Jv, Js, τ, Г, объем газа).
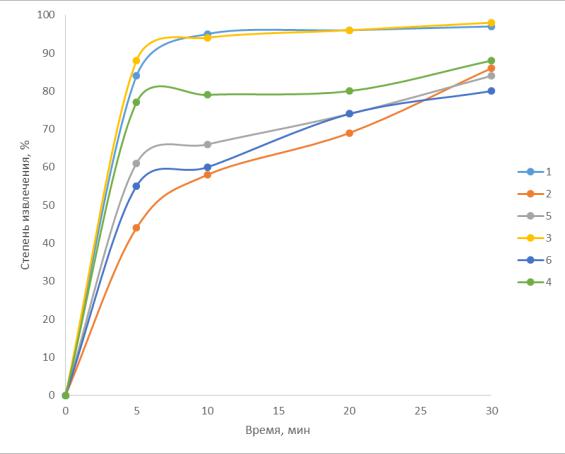
Проанализировано большое количество экспериментальных зависимостей кинетики процесса электрофлотационного извлечения дисперсной фазы на лабораторной установке согласно методике исследования, представленной в главе 2. На рисунке 3.1
представлены зависимости α=f(τ) для случаев, где флотация протекает с очень высокой
(кривая 5) и с очень низкой (кривая 1) эффективностью.
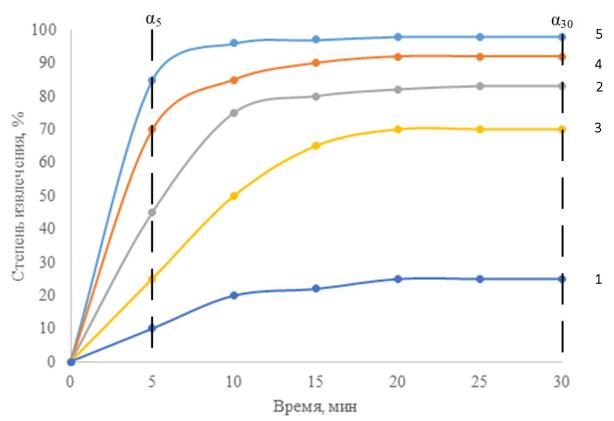
91
Рисунок 3.1 – Эффективность электрофлотационного процесса в различных системах: 1 – очень низкая; 2 – низкая; 3 – средняя; 4 – высокая; 5 – очень высокая
На основании анализа уравнения (10) определены величины константы скорости перехода дисперсной фазы в пенный продукт – К. Путем анализа экспериментальных значений величин степени извлечения α5 и α30 (через 5 и 30 мин) электрофлотации и расчетной величины К предложен подход к оценке эффективности протекания ЭФ процесса на лабораторной установке непроточного типа. Результаты анализа представлены в таблице 3.1.
Таблица 3.1 – Базовые параметры электрофлотационного процесса
|
|
Эффективность процесса |
|
||
Параметр |
очень высокая |
высокая |
средняя |
низкая |
очень низкая |
|
(5) |
(4) |
(3) |
(2) |
(1) |
К |
0,2–0,3 |
0,1–0,2 |
0,01–0,1 |
менее 10-2 |
менее 10-3 |
α5, % |
80–95 |
60–75 |
40–555 |
20–25 |
5–10 |
α30, % |
98 |
92 |
83 |
70 |
25 |
Предложен подход к оценке эффективности электрофлотационного процесса,
включающий стадию тестирования системы в непроточном аппарате. Величина степени извлечения α5 в течении 5 мин характеризует качественное формирование флотокомплекса «частица – пузырек» и способность всплытия на границу «раствор –
92
воздух». Величина α5 коррелируется с высокими значениями К (константы скорости перехода дисперсной фазы в пенный продукт). Величина α30 характеризует эффективность ЭФ процесса в целом, стабильность пенного продукта, возможные процессы разрушения пены и снижения величины α30 по сравнению с α5.
Предложено разделить исследуемые системы на пять групп в зависимости от величины α5, α30, и К. Системы, в которых, α5 = 80–95%, α30 = 98–99%, К = 0,2–0,3
рекомендуется для промышленного применения. Системы, где α5 = 20–25%, α5 = 60–70%,
К ≥ 10-2 требуют дополнительных исследований, приводящих к интенсификации процессов и повышению эффективности ЭФ процессов. Основные подходы к таким системам представлены в разделах 3–5.
Предлагаемый подход удобен для тестирования реальных объектов, например,
сточных вод промышленных предприятий. При поставке в лабораторию 5–10 литров сточной воды удается протестировать систему в различных условиях с добавлением необходимых компонентов до 10 раз. Указанный подход получил развитие при выполнении данной диссертационной работы автора.
3.1. Основные закономерности интенсификации и повышения эффективности электрофлотационного процесса извлечения гидроксидов Fe, Al, Cr, Cu, Ni,
Zn, сульфидов и фосфатов Cu, Ni, Zn в присутствии ПАВ различной природы
К настоящему времени опубликовано большое количество результатов исследования по электрофлотационному извлечению гидроксидов цветных металлов,
включая обзоры [5, 7] и монографию [8]. С другой стороны, сточные воды промышленных предприятий, связанных с обработкой поверхности металлов и пластмасс, фольгированного диэлектрика (производство печатных плат) и анодного оксидирования алюминия, а также лакокрасочное производство имеют очень сложный состав до 40–50 компонентов и трудно обезвреживаются физико-химическими методами.
В сточных водах присутсвует достаточно много различных органических веществ
(растворители, красители, ПАВ, лиганды и сложные композиции). В ряде случаев в воде есть дисперсные соединения (взвешенные вещества), однако флотационные и электрофлотационные технологии работают неэффективно, степень извлечения составляет 10–15%.
93
Получение новых экспериментальных результатов, позволяющих интенсифицировать ЭФ процесс и повысить степень извлечения, является актуальной задачей.
Объекты исследования – водные растворы на основе Na2SO4 и NaCl, содержащие труднорастворимые соединения Al(OH)3, Fe(OH)3, Cr(OH)3, Ti(OH)4, Sc(OH)3,
гидроксиды, фосфаты, сульфиды Cu, Ni, Zn, смеси 3-х и 5-ти компонентов, а также коагулянт UltraPAC (Al), Al3+, Fe3+.
Исследования проводили с добавками:
-анионные ПАВ – додецилсульфат натрия (NaDDS), додецибензолсульфонат натрия (NaDBS), алкилбензолсульфонат натрия (А-40);
-катионные ПАВ – алкилбензилдиметиламмоний хлорид (Катамин АБ, КатаПАВ),
алкилдиметил (2-гидроксиэтил) аммоний хлорид (Катинол),
дидецилдиметиламмоний хлорид (СептаПАВ);
- неионогенные ПАВ – синтанол АЛМ-10, препарат ОС-20 и полиэтиленоксид ПЭО-1500, МТМх, МТМл
Флокулянтов: С-494(к), А-130(а), N-300(н)
Композиций: Vigon, Zestron, Gardostrip, Decorrdal
Рассмотрим влияние различных факторов на ЭФ процесс извлечения дисперсной фазы различной природы в аппарате непроточного типа, представленного в разделе 2
(рис. 3.2). Методы анализа и формулы расчета степени извлечения (α, %), адсорбции органических соединений (А, мг/г) представлены в подразделе 2.2.
В данном разделе представлены новые результаты ЭФ извлечения гидроксида алюминия из водных растворов хлорида и сульфата натрия, в которых гидроксид был использован в качестве сорбента, коагулянта, флокулирующей композиции для повышения эффективности ЭФ процессов извлечения порошков. Исследован процесс ЭФ извлечения гидроксида алюминия (Al(OH3)·nH2O), коагулянтов Al(OH)SO4·nH2O и (Al(OH)2Cl).
Исследованы следующие системы:
H2O – Al(OH)3 – ПАВ (анионный, катионный, неионогенный) – электролит (NaCl, Na2SO4);
H2O – Al(OH)2Cl (Ultra PAC) – ПАВ – электролит (NaCl, Na2SO4, NaNO3, Na3PO4); H2O – Al(OH3) – органические соединения – ПАВ – электролит (NaCl, Na2SO4).
94
Результаты электрофлотационного процесса извлечения дисперсной фазы на основе гидроксида алюминия показали, что процесс протекает достаточно эффективно.
Стационарные значения степени извлечения (α, %) достигают максимальных значений за 15–30 мин. Величина степени извлечения зависит от объемной плотности тока, состава раствора, области рН, концентрации и природы дисперсной фазы, а также других параметров.
Установлено, что процесс в лабораторной установке протекает в ламинарном режиме при объемной плотности тока 0,2–0,4 А/л, где обеспечивается максимальная эффективность процесса. Показано, что осадки гидроксидов алюминия в растворах сульфата натрия значительно хуже извлекаются, чем в растворах NaCl. При высоких значениях газонасыщения (Jv > 0,6 А/л) ламинарность процесса нарушается, степень извлечения снижается до 20–30%.
На рисунке 3.2 представлена зависимость степени извлечения дисперсной фазы гидроксида алюминия в водном растворе Na2SO4 при рН 6–8. Установлена низкая флотационная активность осадка вероятнее всего состава Al(OH)3-х·(SO4)x·nH2O (кривая
1). Рост величины α наблюдается при добавлении ПАВ, в первую очередь NaDDS, что связано с заменой молекулы воды на анионный ПАВ и увеличением гидрофобности поверхности осадка (кривые 3–5)

95
3 4
5 |
2 |
|
1
Рисунок 3.2 – Кинетическая зависимость степени извлечения труднорастворимых соединений алюминия от времени электрофлотации в присутствии катионного и анионного ПАВ: 1 – без добавки; 2 – СептаПАВ ХЭВ.70; 3 – NaDDS (рН – 7,0)
4 – NaDDS (рН – 6,0); 5 – NaDDS (рН – 8,0): условия эксперимента: с (Al3+) – 100 мг/л;
с (Na2SO4) – 1 г/л; с (ПАВ) – 5 мг/л; Jv – 0,4 А/л; рН – 7,0; ξ± = –1–(–3) мВ
Важно отметить, что природа электролита (хлорид, сульфат) существенно влияет на степень извлечения осадка гидроксида алюминия. В концентрированных растворах
NaCl, вследствие образования комплекса, степень извлечения ниже, чем в Na2SO4
(рисунок 3.3).
Введение анионного ПАВ в раствор приводит к росту степени извлечения и расширению области рН, где наблюдаются высокие степени извлечения, до 5–9 (кривые
2, 4).
96
4
3
2
1
Рисунок 3.3 – Влияние рН и природы ПАВ на электрофлотационное извлечение гидроксида алюминия: 1 – NaCl + Al3+; 2 – NaCl + Al3+ + аПАВ; 3 – Na2SO4 + Al3+; 4 – Na2SO4 + Al3++ аПАВ: условия эксперимента: c NaCl – 1 г/л; c Na2SO4 – 1 г/л; c Al3+ – 100 мг/л; с ПАВ – 5 мг/л; Jv – 0,4 А/л
Важным фактором для определения условий работы гидроксида алюминия как коагулянта-сорбента являются значения электрокинетических потенциалов в области рН
5–11, где существует дисперсная фаза. При низких концентрациях алюминия
(50–100 мг/л) при рН ≤ 5 и при рН > 10 наблюдается частичное растворение осадка. В
таблице 3.2 представлены значения ξ-потенциалов для разных систем.
97
Таблица 3.2 – Влияние рН и состава среды на электрокинетический потенциал
коагулянта-сорбента на основе алюминия
Система |
рН |
|
|
ξ±, мВ |
|
|
|
|
|
|
|
|
|
|
5 |
6 |
7 |
|
8 |
9 |
|
|
|
|
|
|
|
H2O – Na2SO4 – Al2(SO4)3 |
+5 |
0 |
–3 |
|
–5 |
–7 |
|
|
|
|
|
|
|
H2O – Na2SO4 – AlСl3 |
+7 |
+4 |
–1 |
|
–4 |
–6 |
|
|
|
|
|
|
|
H2O – NaCl – AlСl3 |
+33 |
+32 |
+30 |
|
+21 |
+5 |
|
|
|
|
|
|
|
H2O – NaCl – Al(OH)2Cl |
+30 |
+28 |
+26 |
|
+20 |
+10 |
|
|
|
|
|
|
|
Условия эксперимента: с NaCl – 1 г/л, с Na2SO4 – 1 г/л, с Al3+ – 50 мг/л
Можно видеть, что только в растворах NaCl коагулянт Al(OH)2Cl, Al(OH)3-x·Cl
имеет положительную величину ξ-потенциала и может использоваться для коагуляции осадков с отрицательными значениями ξ-потенциала, например – высокодисперсных углеродных материалов.
Для интенсификации процессов осаждения, фильтрации и флотации активно используются промышленно-выпускаемые коагулянты, например, UltraPAC.
Исследования ЭФ процессов извлечения дисперсной фазы такого коагулянта ранее не проводилось.
В таблице 3.3 представлены экспериментальные результаты по влиянию рН и природы электролита (состав сточных вод) на эффективность извлечения дисперсной фазы гидроксихлорида алюминия (UltraPAC).
98
Таблица 3.3 – Влияние рН и природы электролита на электрофлотационное извлечение
композиции коагулянт «UltraPAC» – ПАВ
pH |
|
Степень извлечения, α, % |
|
||
Na2SO4 |
NaCl |
NaNO3 |
Na3(PO4)2 |
||
|
|||||
5 |
50 |
6 |
5 |
3 |
|
6 |
93 |
81 |
13 |
16 |
|
7 |
97/63* |
93/90* |
87/6* |
85**/11* |
|
8 |
97 |
66 |
56 |
40 |
|
9 |
93 |
46 |
32 |
34 |
|
10 |
71 |
39 |
13 |
15 |
|
Условия эксперимента: с электролита – 1 г/л, с Al3+ – 100 мг/л; Jv – 0,4 А/л, τ – 20 мин,
сNaDDS – 5 мг/л * – без ПАВ; ** – СептаПАВ.
Снизкой эффективностью процесс протекает только в растворах Na3PO4, что связано с адсорбцией отрицательно заряженных анионов PO43- на поверхности дисперсной фазы. Как отмечено в литературном обзоре, отрицательно заряженные частицы обладают низкой флотационной активностью.
Проведена оценка размера частиц коагулянта-сорбента гидроксида алюминия в зависимости от рН и природы электролита. Экспериментальные данные представлены в таблице 3.4.
Таблица 3.4 – Влияние рН и состава среды на размер частиц коагулянта-сорбента на основе алюминия
Система |
рН |
|
|
dср, мкм |
|
|
H2O – Al(OH)3-хАх |
5 |
6 |
7 |
|
8 |
9 |
H2O – Na2SO4 – Al2(SO4)3 |
24 |
27* |
16 |
|
14 |
14 |
H2O – Na2SO4 – AlСl3 + NaOH |
16 |
22 |
34* |
|
24 |
19 |
H2O – NaCl – AlСl3 + NaOH |
36 |
40 |
42 |
|
30 |
14 |
H2O – NaCl – Al(OH)2Cl + NaOH |
38 |
42 |
40 |
|
25 |
12 |
Условия эксперимента: с NaCl – 1 г/л, с Na2SO4 – 1 г/л, с Al3+ – 50 мг/л
* – Изоэлектрическая точка: ξ± = 0
Анализ показал, что в Na2SO4 наиболее крупные частицы наблюдаются в изоэлектрической точке рН = 6–7. В растворах NaCl в диапазоне рН = 5–8 размер частиц мало изменяется и составляет 36–42 мкм, ξ-потенциал частиц – положительный). В
щелочных растворах ξ-потенциал снижается, в растворе формируется алюминат натрия,
и размер частиц сокращается до 12–15 мкм.
99
Установлено, что электрофлотация алюминатов и гидроксидов алюминия,
сформированных из щелочных растворов (рН = 11 → рН = 7) протекает с низкой эффективностью, степень извлечения α = 10–15%.
Определено, что процесс электрофлотации Al(OH)2Cl протекает неэффективно в растворах Na2CO3, NaF, Na3PO4, что связано с изменением структуры поверхностного слоя (CO32-, PO43-) и формированием растворимых поликомплексов ионов Al3+ с F-
ионами, степень извлечения даже при фильтрации не превышает 60%. Анионный ПАВ приводит к гидрофобизации поверхности осадка за счет замены молекулы воды и росту степени извлечения до 90–99%. Экспериментальные данные для растворов различного состава представлены в таблице 3.5.
Таблица 3.5 – Степень ЭФ извлечения Al(OH)2Cl, % (UltraPAC)
Фоновый электролит |
|
Степень извлечения α, % |
|
||
|
Без ПАВ |
|
Ф |
+аПАВ |
Ф |
Na2SO4 |
52 |
|
97 |
99 |
99 |
NaCl |
82 |
|
97 |
95 |
99 |
NaNO3 |
8 |
|
76 |
89 |
98 |
Na2CO3 |
4 |
|
80 |
37 |
99 |
NaF |
13 |
|
58 |
5 |
60 |
Na3PO4 |
7 |
|
99 |
17 (*74) |
99 |
Условия эксперимента: с Al3+ – 50 мг/л; с фон – 1г/л; c аNaDDS – 5 мг/л; Jv – 0,4 А/л; τ – 20 мин, pH = 7; Ф – фильтрация (дополнительно).
* – СептаПАВ ХСВ.50.
Проведенный анализ показал, что добавление в систему додецилсульфата натрия значительно улучшает процесс ЭФ извлечения алюминия, увеличивая степень извлечения до 95–99% при фоновых электролитах NaCl и Na2SO4 соответственно.
Установлено, что в широком диапазоне концентрации коагулянта UltraPAC
электрофлотация не всегда протекает эффективно. Экспериментальные данные представлены в таблице 3.6.
При высоких концентрациях (> 100 мг/л) эффективно протекают процессы седиментации. Указанные эффекты характерны для растворов NaCl и Na2SO4.
Эффективность ЭФ в хлоридных растворах выше, что связано в первую очередь с более крупным размером частиц и положительным значением ξ-потенциала.

100
Таблица 3.6 – Зависимость степени ЭФ извлечения Al(OH)2Cl (%) от исходной концентрации
с исх. |
|
|
|
α, % |
|
|
|
Al3+, |
|
|
|
|
|
|
|
|
Na2SO4 |
|
|
NaCl |
|||
мг/л |
|
|
|
|
|
|
|
Без ПАВ |
|
+аПАВ |
|
Без ПАВ |
|
+аПАВ |
|
|
|
|
|
|
|
|
|
25 |
75 |
|
99 |
|
85 |
|
97 |
|
|
|
|
|
|
|
|
50 |
62 |
|
99 |
|
82 |
|
95 |
|
|
|
|
|
|
|
|
100 |
50 |
|
97 |
|
90 |
|
95 |
|
|
|
|
|
|
|
|
200 |
14 |
|
85 |
|
11 |
|
97 |
|
|
|
|
|
|
|
|
Условия эксперимента: с Na2SO4 / NaCl – 1г/л; с NaDDS – 50 мг/л; Jv – 0,4 А/л; τ – 20 мин; pH – 7; α (при τ = 20 мин + Ф) – 97 ÷ 100%.
Добавление ПАВ позволяет интенсифицировать процесс, увеличить степень извлечения и расширить диапазон концентраций используемого коагулянта.
Проведена оценка процесса седиментации осадка коагулянта UltraPAC.
Экспериментальные результаты приведены в таблице 3.7.
Таблица 3.7 – Влияние концентрации коагулянта Ultra PAC” на процессы седиментации труднорастворимого соединения алюминия Al(OH)2Cl
с исх. |
τ, |
Na2SO4 |
(1 г/л) |
NaCl (1 г/л) |
|||
мин |
|||||||
«Ultra PAC», |
|
|
|
|
|
||
|
Без добавок |
|
NaDDS |
Без добавок |
NaDDS |
||
мг/л |
|
|
|||||
|
β, % |
|
β, % |
β, % |
β, % |
||
|
|
|
|||||
|
10 |
38 |
|
28 |
|
40 |
|
|
20 |
64 |
|
46 |
Нет границы |
64 |
|
100 |
30 |
70 |
|
66 |
72 |
||
|
раздела |
||||||
|
45 |
75 |
|
72 |
78 |
||
|
|
|
|||||
|
60 |
78 |
|
75 |
|
80 |
|
|
10 |
9 |
|
5 |
Нет границы |
Нет границы |
|
|
|
раздела |
раздела |
||||
|
|
|
|
|
|||
200 |
20 |
22 |
|
21 |
85 |
78 |
|
30 |
36 |
|
34 |
86 |
82 |
||
|
|
||||||
|
45 |
52 |
|
51 |
86 |
84 |
|
|
60 |
59 |
|
60 |
86 |
85 |
|
Условия эксперимента: pH = 7.
101
Установлено, что в присутствии NaCl процесс протекает более эффективно (размер частиц – 40 мкм) степень осаждения достигает 80% за 60 мин седиментации. В растворах
Na2SO4 – 60–75%. Анионный ПАВ не оказывает влияния на седиментацию осадков
UltraPAC.
В практике очистки сточных вод, например, на участках анодного оксидирования алюминия в растворах серной кислоты в сточные воды попадает Al2(SO4)3 в больших концентрациях до 200 мг/л. В этом случае процессы ЭФ извлечения дисперсной фазы затруднены (таблица 3.8).
Таблица 3.8 – Степень ЭФ извлечения Al(OH)3
|
Na2SO4 |
|
|
NaCl |
||
α, % |
Без ПАВ |
|
+аПАВ |
Без ПАВ |
|
+аПАВ |
|
20 |
|
95 |
27 |
|
96 |
Условия эксперимента: c Al3+ – 200 мг/л; с Na2SO4/ NaCl – 1г/л;
c NaDDS – 5 мг/л; Jv – 0.4 А/л; τ = 20 мин; α (при τ = 20мин + Ф) = 97÷100%; pH=7.
Эффективность ЭФ резко возрастает в присутствии небольшого количества ПАВ 5
мг/л, (5 г/м3 сточной воды).
Известно, что гидроксид алюминия обладает хорошими сорбционными характеристиками по отношению к органическим веществам. В ряде случаев степень извлечения может быть достаточно высока. С другой стороны, органические вещества могут затруднять протекание электрофлотационного процесса, адсорбируясь на новых осадках. В таблице 3.9 представлены экспериментальные данные по влиянию органических соединений, часто встречающихся в сточных водах гальванического производства, производства печатных плат и анодного оксидирования алюминия на степень извлечения Al(OH)3. Приведены данные по степени извлечения органических соединений и дисперсной фазы алюминия. Структура некоторых исследуемых красителей представлена на рисунке 3.4.

102
Таблица 3.9 – Влияние природы органических соединений на электрофлотационное
извлечение Al(OH)3 и органических компонентов
Система электролит + органическое |
Степень извлечения, α, % |
||
вещество |
органические |
Al3+ |
Al3+ |
|
вещества |
(ЭФ) |
(ЭФ + Ф) |
|
(ЭФ) |
|
|
Без органики |
- |
75 |
94 |
БТС1 – гидрофобный |
58 |
95 |
98 |
КО2 |
24 |
13/85* |
99 |
АФ2 |
44 |
82 |
99 |
ПД2 |
52 |
90 |
99 |
МГ2 |
35 |
58 |
87 |
триэтиламин |
89 |
11/82* |
93 |
моноэтаноламин |
82 |
3/90* |
96 |
пропанол-2 |
93 |
96/85* |
95 |
Условия эксперимента: c Na2SO4 – 1 г/л; c Al(ОН)3 – 100 мг/л;
c орг. комп. – 1 мл/л; c ПАВк – 1–5 мг/л; Jv – 0,4 А/л; τ – 20 мин; рН = 7,0; ХПКисх – 1000 мгО/л.
1 – гидрофобный краситель; 2 – гидрофильный краситель. * – добавление катионного флокулянта.
а |
б |
|
в |
г |
д
Рисунок 3.4 – Структура красителей: а – Бромтимоловый синий (БТС); б – Прямой диазоалый (ПД); в – Активный фиолетовый (АФ); г – Метиленовый голубой (МГ);
д – Ксиленоловый оранжевый (КО)
103
Анализ показывает, что степень извлечения органических веществ достаточно высока и достигает 70–80%, а для гидрофобного красителя БТС доходит до 95%. При увеличении количества Al(OH)3 до 150–200 мг/л степень извлечения органических соединений возрастает до 90–95%. Эффективность электрофлотационного извлечения гидроксида алюминия удается увеличить при введении ПАВ и флокулянтов до 5 мг/л при концентрации органических соединений до 100 мг/л.
Проведена оценка величины адсорбции различных поверхностно-активных веществ на свежеосажденном осадке гидроксида алюминия. Экспериментальные результаты представлены в таблице 3.10.
Таблица 3.10 – Влияние природы ПАВ на показатель адсорбции (Аадс, мг/г) на адсорбенте гидроксид алюминия (III)
с |
|
|
|
Природа ПАВ |
|
|
|
|
ПАВ, |
Анионные |
Катионные |
Неионогенные |
Амфотерные |
||||
мг/л |
NaDDS |
NaDBS |
СептаПАВ |
СептаПАВ |
ОС- |
АЛМ- |
БетаПАВ |
БетаПАВ |
|
|
|
ХСВ50 |
ХЭВ70 |
20Б |
10 |
А30 |
А45 |
50 |
40 |
215 |
50 |
110 |
135 |
205 |
145 |
30 |
100 |
150 |
225 |
280 |
220 |
170 |
370 |
310 |
130 |
250 |
170 |
405* |
660 |
920 |
750 |
945* |
455 |
445 |
500 |
455* |
430* |
1800* |
2400* |
575 |
1175* |
480 |
810 |
750 |
610* |
215* |
2900* |
3600* |
745 |
1285* |
625 |
2150* |
1000 |
615* |
245* |
3620* |
4700* |
675 |
1200* |
665 |
5110* |
Условия эксперимента: с Al3+ – 100 мг/л рН =7,0;
время контакта – 60 мин. * – мицелообразование.
Наиболее высокие значения адсорбции наблюдаются для катионных ПАВ.
Адсорбция анионных, неионогенных и амфотерных ПАВ связана с заменой молекулы воды. Адсорбция катионных ПАВ происходит по атомам кислорода гидроксидов металлов. Высокие значения адсорбции при концентрациях выше 250–300 мг/л связаны с процессами мицелообразования ПАВ в растворах и формировании полидисперсных слоев на свежесформированных осадках.
В сточных водах гальванического производства наряду с ионами Al3+, Fe3+, Cu2+, Zn2+, Ni2+ присутствует отдельный сток, содержащий трех- и шестивалентный хром.
При восстановлении Cr(VI) реагентами формируется плохофлотируемый осадок гидроксида хрома, особенно в сульфатных растворах, где образуется труднорастворимое соединение типа Cr(OH)3-x·(SO4)x·nH2O.
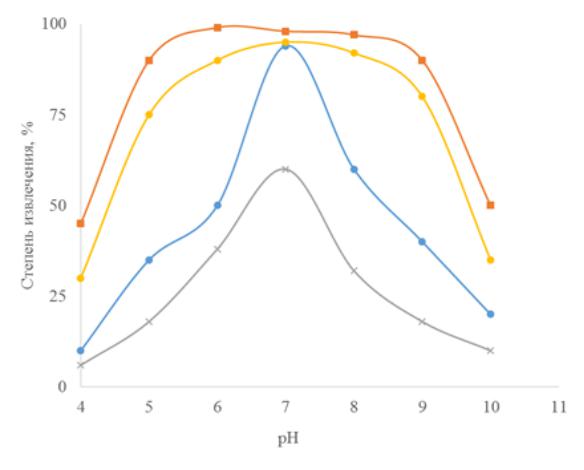
104
Электрофлотация осадка без ПАВ протекает неэффективно, при рН 6,5±0,5 степень извлечения не превышает 60%. При добавлении небольших количеств (5 мг/л) анионного ПАВ (NaDDS, NaDBS) степень извлечения возрастает до 95–98% в области рН 7–9.
Катионный ПАВ Катамин АБ вследствие формирования отрицательных зарядов
(ξ-потенциала) на Cr(OH)3 при рН 8–11 за счет кислородсодержащих групп,
адсорбируемых на осадке, ведет к гидрофобизации поверхности и достижению высоких степеней извлечения 91–92%. Использование смеси (композиции) двух ПАВ NaDDS и
Катамин АБ в соотношении (80% + 20%) расширяет рабочую область электрофлотационного извлечения Cr(OH)3-x·(SO4)x до рН 6,5–11 при высокой степени извлечения 85–95%.
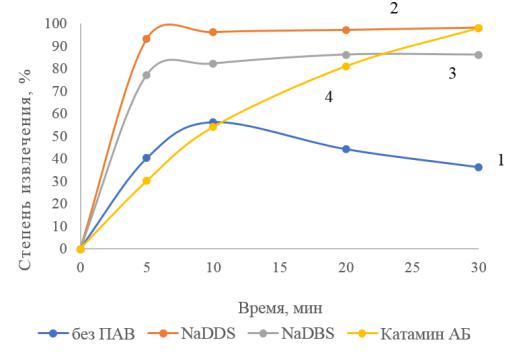
Известно, что соединения хрома (III) извлекаются в процессе электрофлотации не эффективно, в первую очередь в растворах сульфата натрия вследствие образования
Cr(OH)3-xSO4 степень извлечения не превышает 50%. Экспериментальные данные представлены на рисунке 3.5.
Рисунок 3.5 – Кинетика электрофлотационного процесса извлечения Cr(OH)3 в присутствии ПАВ: условия эксперимента: с Cr3+ – 50 мг/л; с Na2SO4 – 1 г/л; Jv – 0,4 А/л;
рН – 6,5; τ – 20 мин;
1 – без ПАВ; 2 – NaDDS; 3 – NaDBS; 4 – Катамин АБ
Извлекаемый осадок формирует неустойчивую пену, степень извлечения падает
(кривая 1). Добавление ПАВ интенсифицирует процесс и стабилизирует пенный продукт.
105
Таблица 3.11 – Влияние рН и природы ПАВ на степень извлечения Cr(OH)3
рН |
|
|
Степень извлечения, α, % |
|
||
без ПАВ |
NaDDS |
NaDBS |
Катамин |
|
NaDBS + Катамин |
|
|
|
|||||
6,0 |
5 |
71 |
47 |
17 |
|
21 |
6,5 |
60 |
90 |
89 |
33 |
|
87 |
7 |
20 |
91 |
95 |
43 |
|
91 |
8 |
17 |
98 |
87 |
56 |
|
96 |
9 |
5 |
88 |
80 |
75 |
|
86 |
10 |
2 |
69 |
49 |
91 |
|
75 |
11 |
2 |
36 |
30 |
92 |
|
70 |
Условия эксперимента: с (Cr3+) – 50 мг/л; с (Na2SO4) – 1 г/л; с (ПАВ) – 5 мг/л; Jv – 0,4 А/л; τ – 20 мин.
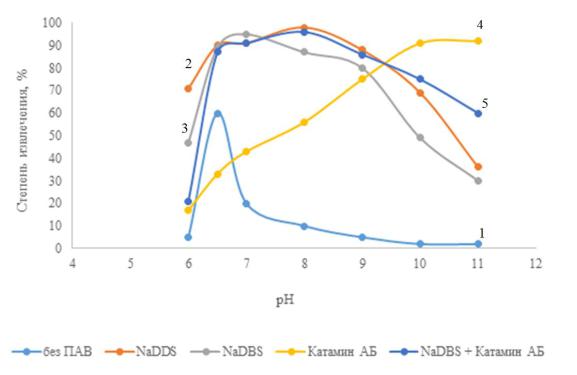
Достаточно наглядно эффект влияния ПАВ можно видеть на рисунке 3.6.
Рисунок 3.6 – Влияние рН и природы ПАВ на степень извлечения Cr(OH)3: условия эксперимента: с (Cr3+) – 50 мг/л; с (Na2SO4) – 1 г/л; с (ПАВ) – 5 мг/л; Jv – 0,4 А/л;
τ – 20 мин;
1 – без ПАВ; 2 – NaDDS; 3 – NaDBS; 4 – Катамин АБ; 5 – композиция NaDBS + Катамин АБ
106
Положительный эффект влияния ПАВ сохраняется в широком диапазоне концентрации до 100 мг/л, величина степени извлечения α несколько снижается на
10–15% при высокой концентрации 200 мг/л (таблица 3.12).
Таблица 3.12 – Влияние концентрации и природы ПАВ на степень извлечения Cr(OH)3
|
|
|
Степень извлечения, α, % |
|
|||
|
|
|
|
|
|
|
|
с (ПАВ) |
NaDDS |
|
|
NaDBS |
Катамин |
||
|
|
|
|
|
|
|
|
|
рН 6,5 |
|
рН 8,0 |
рН 6,5 |
|
рН 8,0 |
рН 10 |
|
|
|
|
|
|
|
|
0 |
60 |
|
17 |
60 |
|
17 |
20 |
|
|
|
|
|
|
|
|
5 |
90 |
|
98 |
89 |
|
87 |
91 |
|
|
|
|
|
|
|
|
10 |
68 |
|
70 |
88 |
|
96 |
80 |
|
|
|
|
|
|
|
|
20 |
67 |
|
80 |
99 |
|
94 |
74 |
|
|
|
|
|
|
|
|
50 |
75 |
|
84 |
99 |
|
90 |
81 |
|
|
|
|
|
|
|
|
100 |
89 |
|
98 |
89 |
|
87 |
92 |
|
|
|
|
|
|
|
|
200 |
80 |
|
70 |
65 |
|
70 |
80 |
|
|
|
|
|
|
|
|
Условия эксперимента: с Cr3+ – 50 мг/л; с Na2SO4 – 1 г/л; с (ПАВ) – 5 мг/л; Jv – 0,4 А/л; τ – 20 мин.
Важно отметить, что высокие значения степени извлечения гидроксида хрома получены при низких концентрациях ПАВ (5 мг/л) и соотношении Cr(OH)3:ПАВ = 10:1 в
отличие от ионной флотации, где обычно соотношение Me3+:ПАВ = 1:3
Результаты исследования влияния объемной плотности на степень извлечения взвешенных веществ, гидроксидов металлов представлены в ряде работ [5, 14]. В
диссертационной работе отображены данные для Cr(OH)3 в присутствии различных ПАВ в диапазоне объемных плотностей тока 0,1–1 А/л (таблица 3.13).
107
Таблица 3.13 – Влияние объемной плотности тока, времени процесса и природы ПАВ на
степень извлечения Cr(OH)3
Jv, А/л |
τ, мин |
|
Степень извлечения, α, % |
|
||
NaDDS |
NaDBS |
Катамин |
без ПАВ |
|||
|
|
|||||
|
5 |
80 |
68 |
24 |
5 |
|
0,2 |
10 |
94 |
72 |
52 |
12 |
|
20 |
96 |
76 |
81 |
18 |
||
|
||||||
|
30 |
97 |
76 |
99 |
22 |
|
|
5 |
93 |
77 |
30 |
40 |
|
0,4 |
10 |
96 |
82 |
54 |
56 |
|
20 |
97 |
86 |
81 |
44 |
||
|
||||||
|
30 |
98 |
86 |
98 |
36 |
|
|
5 |
95 |
73 |
71 |
16 |
|
0,6 |
10 |
97 |
77 |
99 |
21 |
|
20 |
98 |
82 |
99 |
26 |
||
|
||||||
|
30 |
98 |
82 |
99 |
30 |
|
|
5 |
93 |
80 |
48 |
|
|
0,8 |
10 |
96 |
84 |
86 |
максимум 20% |
|
20 |
97 |
88 |
99 |
|||
|
|
|||||
|
30 |
98 |
92 |
99 |
|
|
|
5 |
90 |
55 |
82 |
|
|
1,0 |
10 |
95 |
82 |
91 |
максимум 10% |
|
20 |
95 |
86 |
99 |
|||
|
|
|||||
|
30 |
98 |
91 |
99 |
|
|
Условия эксперимента: с Cr3+ – 50 мг/л; с Na2SO4 – 1 г/л; с ПАВ – 5 мг/л; рН = 6,5.
Установлено, что без ПАВ изменяя значение токовой нагрузки с 0,2 до 1,0 А/л
степень извлечения достигает 40–55%. Введение ПАВ, в первую очередь анионного
NaDDS, стабилизирует процесс ЭФ в широком диапазоне Jv = 0,2–1,0 А/л и позволяет достигать за достаточно быстрое время (5–10 мин) высокие значения степени извлечения при объемной плотности тока 0,2–0,4 А/л 97–98 %.
Для проведения электрофлотационного процесса в проточном режиме на практике часто используют 2-камерные аппараты. Эффективность процесса зависит от объемной плотности тока в 1 и 2 камере. В 1-й камере обеспечивается прямоточный режим движения очищаемой воды и пузырьков газа (H2, O2), во 2-й камере противоточный режим. жидкость движется вниз – пузырьки вверх.
В таблице 3.14 представлены зависимости степени извлечения Cr(OH)3 в
проточной 2-камерной установке.

108
Основное газонасыщение происходит в 1-й камере, при этом степени извлечения достигают 70–80%. Доочистка воды происходит во 2-й камере при более низких значениях объемной плотности тока Jv. Эффективность очистки достигает 95–98%, время пребывания жидкости в аппарате – не более 10 минут. Кратность обмена – 6. Для проведения экспериментов использовалась лабораторная установка объемом 10 л.
Таблица 3.14 – Зависимость степени извлечения гидроксида хрома от объемной плотности тока во флотокамерах (1 и 2) проточной установки
Степень извлечения, α, %
Объемная плотность тока
1-я камера, |
|
2-я камера, Jv, А/л |
|
|
Jv, А/л |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
0,1 |
0,05 |
0,025 |
0,02 |
|
|
|
|
|
0,05 |
70 |
86 |
94 |
98 |
|
|
|
|
|
0,1 |
78 |
94 |
96 |
98-99 |
|
|
|
|
|
0,15 |
64 |
96 |
95 |
91 |
|
|
|
|
|
0,2 |
53 |
78 |
76 |
75 |
|
|
|
|
|
Условия эксперимента: с Cr(OH)3 – 50 мг/л; с NaDDS – 5 мг/л; с Na2SO4 – 1 г/л; рН = 7,0.
Наиболее высокие значения степени извлечения гидроксида хрома, при минимальных энергозатратах наблюдаются для JvI – 0,1 А/л, JvII – 0,02 А/л, т.е. при соотношении JvI: JvII = 5:1, что подтверждено на промышленных установках.
Гидроксид железа (III) часто присутствует в сточных водах гальванического производства или вводится дополнительно в процессах очистки сточных вод в качестве коагулянта. Электрофлотация указанных осадков протекает достаточно эффективно в диапазоне рН = 6–8. Экспериментальные данные представлены в таблице 3.15.
109
Таблица 3.15 – Влияние кислотности среды на степень извлечения гидроксида железа (III)
в присутствии анионных ПАВ NaDDS и NaDBS при электрофлотации
|
|
Степень извлечения, α, % |
|
||
рН |
Без ПАВ |
+ NaDBS |
+NaDDS |
||
|
α (Fe3+), % |
α NaDBS, % |
α (Fe3+), % |
α NaDDS, % |
|
|
|
||||
2 |
20 |
25 |
20 |
20 |
15 |
4 |
89 |
89 |
89 |
94 |
85 |
6 |
94 |
94 |
97 |
96 |
88 |
8 |
92 |
92 |
98 |
98 |
91 |
9 |
87 |
87 |
92 |
95 |
87 |
10 |
21 |
21 |
21 |
84 |
15 |
11 |
6 |
6 |
6 |
21 |
14 |
Условия эксперимента: с ПАВ – 100 мг/л; с Fe3+ – 20 мг/л; с Na2SO4) – 1 г/л; τ – 20 мин; Jv – 0,4 А/л.
Примечание: для NaDBS величина ХПКисх. – 250 мгО/л; для NaDDS – 200 мгО/л.
Наличие анионного ПАВ в очищаемой воде повышает степень извлечения гидроксида железа (III) во всем изученном интервале рН. Максимальная степень извлечения наблюдается при рН=8 и составляет 98%. В щелочной среде при рН 10 и 11 в
присутствии ПАВ степень извлечения увеличивается на 70 и 38 % соответственно.
Как видно из данных таблицы 3.15, ПАВ наиболее эффективно извлекается в слабокислой и нейтральной области рН. Установлено, что наиболее эффективно извлекаются ПАВ, содержащие в своей структуре ароматическую группу.
Увеличение рН до 8 снижает степень извлечения до 24%, а в щелочных растворах степень извлечения уменьшается до 5%. Такая закономерность степени извлечения от рН скорее всего связана с изменением знака электрокинетического потенциала на поверхности дисперсной фазы. В кислой и нейтральной областях заряд имеет положительное значение, поэтому в этих условиях АПАВ хорошо сорбируется на коагулянте.
В ходе электрофлотационного процесса анионные ПАВ NaDBS и NaDDS за счет адсорбции на поверхности дисперсной фазы гидроксида железа извлекаются достаточно эффективно, степень извлечения 99,0–99,5%; остаточное значение величины ХПК составляет 15–20 мгО/л

110
Определены величины адсорбции ПАВ различной природы на свежесформированных осадках Fe(OH)3 экспериментальные данные представлены в таблице 3.16.
Таблица 3.16 – Влияние природы ПАВ на показатель адсорбции (Аадс, мг/г) на адсорбенте гидроксид железа (III)
С |
Природа ПАВ |
|
|
|
|
|
|
|
ПАВ |
Анионные |
Катионные |
|
Неионогенны |
Амфотерные |
|||
, мг/л |
|
|
|
|
е |
|
|
|
|
NaDD |
NaDB |
СептаПА |
СептаПА |
ОС- |
АЛМ- |
БетаПА |
БетаПА |
|
S |
S |
В ХСВ50 |
В ХЭВ70 |
20Б |
10 |
В А30 |
В А45 |
50 |
5 |
25 |
60 |
70 |
15 |
5 |
17 |
15 |
100 |
90 |
40 |
82 |
80 |
20 |
50 |
80 |
75 |
250 |
110 |
355 |
380* |
330* |
185 |
125 |
140 |
160 |
500 |
100 |
825* |
940* |
1460* |
240 |
175 |
65 |
415 |
750 |
105 |
905* |
900* |
2118* |
415 |
70 |
510 |
800 |
1000 |
105 |
850* |
1116* |
2888* |
150 |
80 |
885* |
1685* |
Условия эксперимента: с Fe3+ – 100 мг/л; рН = 7,0; время контакта – 60 минут. * – мицелообразование.
Наиболее высокие значения величины адсорбции на гидроксидах железа наблюдаются для катионных ПАВ, что связано, как и для большинства гидроксидов
(оксидов), возможностью адсорбции по атомам кислорода с заменой протона H3O+
вследствие кислотно-основной диссоциации поверхностных групп по схеме:
+
Me - OH + R р-р → Me - OH + H+р-р
При высоких концентрациях ПАВ наблюдается мицелообразование и формирование полислоев на осадках Fe(OH)3, вследствие чего величины адсорбции превышают значения 1000–2000 мг/г
Как отмечалось ранее, ПАВ адсорбируются не только на гидроксидах алюминия и железа (рН = 7), но и на других гидроксидах, в частности Cu, Zn, Ni при рН = 10, где формируются свежеосажденные осадки Me(OH)2.
Экспериментальные данные представлены в таблице 3.17. Сорбционные характеристики осадков Cu(OH)2, Zn(OH)2, Ni(OH)2 сопоставимы с Al(OH)3.
111
Таблица 3.17 – Влияние природы адсорбента (гидроксидов металлов) на величину
адсорбции анионного ПАВ NaDDS Аадс, мг/г
Концентрация |
NaDDS, |
Fe |
Al |
Cu |
Ni |
Zn |
мг/л |
|
рН = 7 |
|
рН = 10 |
|
|
50 |
|
5 |
40 |
145 |
155 |
105 |
100 |
|
90 |
150 |
315 |
310 |
210 |
|
|
|
|
|
|
|
250 |
|
110 |
170 |
650 |
525 |
320 |
500 |
|
100 |
455 |
620 |
875 |
530 |
|
|
|
|
|
|
|
750 |
|
105 |
610 |
705 |
955 |
830 |
|
|
|
|
|
|
|
1000 |
|
105 |
615 |
665 |
840 |
915 |
|
|
|
|
|
|
|
Условия процесса: с (адсорбента) – 100 мг/л; τ время контакта – 30 мин.
Анализ показывает, что величины адсорбции для гидроксидов меди, никеля и цинка больше, чем на гидроксиде алюминия в 6 – 9 раз чем на гидроксиде железа. Рост адсорбции анионного ПАВ, вероятно, связан с более эффективным процессом замены молекул воды на анионный ПАВ на гидроксидах металлов, склонных к комплексообразованию в щелочных растворах (Cu, Ni, Zn).
Для нейтрализации сточных вод часто используют щелочные реагенты NaOH, Mg(OH)2, Ca(OH)2, CaCO3, BaCO3. Экспериментально установлено, что при концентрации ионов кальция и магния более 0,2 г/л эффективность электрофлотационного извлечения гидроксидов металлов Cu, Ni, Zn, снижается на
70–80% по сравнению с растворами, обработанными NaOH или Na2CO3. В таблице 3.18
представлены данные по влиянию ионов Ca2+ на эффективность извлечения гидроксидов
Al3+, Fe3+, Cr3+
Таблица 3.18 – Влияние состава раствора на электрофлотационное извлечение гидроксидов железа, алюминия и хрома в присутствии катионов кальция и анионного ПАВ – NaDDS
|
|
|
|
|
|
Степень извлечения, α, % |
|
|
|
|||
Время, |
|
|
Fe(OH)3 |
|
Al(OH)3 |
|
|
Cr(OH)3 |
|
|||
τ, |
|
NaOH |
|
CaCl2 |
NaOH |
CaCl2 |
NaOH |
CaCl2 |
||||
мин. |
|
- |
- |
|
+ |
- |
- |
+ |
- |
- |
|
+ ПАВ |
|
|
|
ПАВ |
ПАВ |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||
5 |
|
80 |
15 |
|
80 |
58 |
10 |
81 |
25 |
11 |
|
96 |
10 |
|
86 |
17 |
|
88 |
60 |
14 |
83 |
40 |
14 |
|
99 |
20 |
|
98 |
28 |
|
98 |
75 |
18 |
92 |
48 |
19 |
|
99 |
Условия эксперимента: с Me3+ – 100 мг/л; с Na2SO4 – 1 г/л; с NaDDS – 5 мг/л; |
|
|||||||||||
с CaCl2 |
– 0,5 г/л; Jv – 0,4 А/л; τ – 20 мин; рН = 7,0. |
|
|
|
|
|
||||||

112
Исследования показали, что в избытке ионов Ca2+ в растворе эффективность процесса электрофлотационного извлечения резко падает до 20–30%. Причиной снижения степени извлечения является адсорбция Ca2+ на гидроксидах металлов, что ведет к росту положительного значения ξ±-потенциала и затруднению процесса ЭФ флотации. Максимальная эффективность наблюдается при значении ξ±-потенциала близком к нулю (±5 мВ). Величина ξ-потенциала в присутствии Ca2+ достигает +25 мВ.
Введение в систему анионного ПАВ NaDDS интенсифицирует процесс извлечения гидроксидов, наиболее высокие значения степени извлечения (99%) наблюдаются для осадков Cr(OH)3-x·(SO4)x в течении 10 мин.
Исследован процесс извлечения Sc(OH)3 в растворах различного состава NaCl, Na2SO4, NaNO3, Na2CO3. Необходимо отметить, что процесс протекает достаточно быстро, стационарные значения степени извлечения устанавливаются за 5–10 мин в хлоридном и нитратном растворе) максимальное значение степени извлечения 95–98%
при рН 7±0,5. Зависимость степени извлечения Sc(OH)3 от рН в растворах различного состава представлена на рисунке 3.7.
Степень извлечения, %
100 |
|
|
|
|
90 |
|
|
|
|
80 |
|
|
|
|
70 |
|
|
|
2 |
60 |
|
|
|
|
50 |
|
|
1 |
|
|
|
|
|
|
|
|
|
3 |
|
40 |
|
|
|
5 |
|
|
|
|
|
30 |
|
|
|
|
20 |
|
|
|
|
|
|
|
4 |
|
10 |
|
|
|
|
0 |
|
|
|
|
6 |
7 |
8 |
9 |
10 |
|
|
рН ,ед. |
|
|
Рисунок 3.7 – Влияние рН на электрофлотационное извлечение труднорастворимых соединений скандия в различных фоновых электролитах:1 – NaNO3, 2 – NaCl,
3– Na2SO4, 4 – Na2CO3, 5 – Na2CO3 + NaDDS: условия эксперимента: с Sc3+ – 50 мг/л;
сфонового электролита – 1 г/л; τ – 20 мин; JV – 0,4 A/л
113
Отметим, что в присутствии анионов SO42-, CO32- процесс электрофлотационного извлечения подавляется вследствие изменения дисперсной фазы Sc(OH)3 на Sc(OH)3-x
SO42- и Sc(OH)3-x CO32-. Флотация сульфатов и карбонатов протекает менее эффективно.
Добавление анионного ПАВ NaDDS повышает эффективность извлечения в растворе Na2CO3 до 90% (без ПАВ α = 42%). Указанный эффект связан с увеличением гидрофобности осадка по причине адсорбции ПАВ и вытеснения молекул воды.
Проведено сравнение эффективности извлечения некоторых гидроксидов трехвалентных металлов Sc, Al, Cr, La в растворах NaCl и Na2SO4. Экспериментальные данные представлены в таблице 3.19.
Таблица 3.19 – Степень извлечения некоторых гидроксидов трехвалентных металлов в ЭФ процессе в растворах NaCl и Na2SO4
|
|
|
|
α, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
τ, мин |
Sc(OH)3 |
Al(OH)3 |
La(OH)3 |
Cr(OH)3 |
||||
|
|
|
|
|
|
|
|
|
|
NaCl |
Na2SO4 |
NaCl |
Na2SO4 |
NaCl |
Na2SO4 |
NaCl |
Na2SO4 |
|
|
|
|
|
|
|
|
|
5 |
94 |
91 |
40 |
60 |
51 |
79 |
64 |
40 |
|
|
|
|
|
|
|
|
|
10 |
98 |
92 |
45 |
75 |
80 |
68 |
72 |
55 |
|
|
|
|
|
|
|
|
|
20 |
98 |
93 |
60 |
90 |
56 |
33 |
80 |
40 |
|
|
|
|
|
|
|
|
|
Условия эксперимента: с NaCl / Na2SO4 –1 г/л; Jv – 0,4 А/л; c Me – 50; 100 мг/л; pH –7,0 (Sc, Al, Cr); pH – 10 (La)
Установлено, что в NaCl степень извлечения Sc(OH)3 составляет 95–98 % за время электрофлотации 20 мин, тогда как для Al(OH)3 – 60%, La(OH)3 – 56%, Cr(OH)3 – 80%.
Высокая эффективность ЭФ Sc(OH)3 определяется рыхлой структурой осадка,
оптимальным размером частиц (50–70 мкм) и низким значением ξ±-потенциала ±3 мВ при pH = 7±0,5.
Проведено исследование электрофлотационного извлечения многокомпонентной смеси гидроксидов двухвалентных металлов (Fe, Ni, Zn, Cu, Co), часто встречающихся в сточных водах гальванических производств. Обобщенные экспериментальные данные представлены в таблице 3.20.
114
Таблица 3.20 – Влияние природы электролита на степень электрофлотационного
извлечения ∑Me(OH)2 в слабощелочной области рН
Электролит |
|
|
|
Степень извлечения, α, % |
|
|
|
|
||||
|
|
|
рН = 9 |
|
|
|
|
|
рН = 10 |
|
|
|
|
Fe |
Ni |
Zn |
Co |
Cu |
Fe |
Ni |
|
Zn |
|
Co |
Cu |
NaCl** |
94 |
94 |
96 |
94 |
96 |
98 |
98 |
|
99 |
|
98 |
99 |
Na2SO4** |
91 |
91 |
93 |
91 |
94 |
92 |
92 |
|
94 |
|
92 |
96 |
NaNO3** |
94 |
94 |
96 |
96 |
98 |
95 |
94 |
|
92 |
|
92 |
96 |
Na2CO3* |
94 |
96 |
96 |
96 |
98 |
92 |
92 |
|
96 |
|
95 |
98 |
Na3PO4* |
90 |
92 |
94 |
92 |
96 |
93 |
95 |
|
98 |
|
96 |
98 |
Условия эксперимента: с Me2+ – 20 мг/л; с ∑Me2+ – 100 мг/л; с электролита – 1 г/л;
Jv – 0,4 А/л; τ – 20 мин.
*катионный ПАВ (СептаПАВ) – 5 мг/л.
**промышленный анионный ПАВ (МТМх) – 5 мг/л.
Врастворах NaCl, Na2SO4, NaNO3 эффективность электрофлотационного процесса
достаточна высокая, даже в отсутствии ПАВ и флокулянтов составляет 90–96%.
Отмечено, что плохо извлекается осадок Fe(OH)2. Низкая эффективность наблюдается в растворах Na3PO4, формируются осадки Me3(PO4)2; Me2(OH)PO4 и др.,
которые плохо флотируются. Анализ причин низкой эффективности процесса электрофлотации представлен в разделе, описывающем электрофлотационное извлечение фосфатов металлов. Высокие степени извлечения наблюдаются в присутствии катионных ПАВ для растворов Na2CO3, Na3PO4 и анионных ПАВ для NaCl, NaNO3, Na2SO4.
Сульфиды металлов часто присутствуют в сточных водах предприятий горно-
химического профиля. Особенностью сульфидов является малый размер частиц
(≤ 10 мкм) и высокий отрицательный ξ±-потенциал от –30 до –45 мВ). В связи с этим система является коллоидно-устойчивой и электрофлотационное извлечение протекает неэффективно [5].
Рассмотрим экспериментальные результаты по электрофлотационному извлечению сульфидов меди, никеля и цинка в присутствии флокулянтов, ПАВ и коагулянта Fe3+ в слабощелочном растворе в интервале рН = 6–12.
В литературе опубликованы данные, полученных по электрофлотационному извлечению сульфидов в присутствии флокулянтов, ПАВ и коагулянта Fe3+.
Исследование систем H2O – электролит – MeS – ПАВ ранее не проводилось. Рассмотрим
115
влияние рН и природы дисперсной фазы на электрофлотационное извлечение сульфидов
(таблица 3.21).
Таблица 3.21 – Влияние рН на электрофлотационное извлечение сульфидов Cu, Ni, Zn без
добавок
|
|
|
|
Степень извлечения, α, % |
|
|
|||
рН |
|
NiS |
|
ZnS |
|
CuS |
|||
|
ЭФ |
|
Ф |
ЭФ |
|
Ф |
ЭФ |
|
Ф |
6 |
18 |
|
30 |
22 |
|
83 |
23 |
|
50 |
8 |
38 |
|
50 |
40 |
|
90 |
88 |
|
89 |
10 |
42 |
|
95 |
52 |
|
96 |
84 |
|
90 |
11 |
88 |
|
99 |
69 |
|
97 |
64 |
|
99 |
12 |
68 |
|
99 |
53 |
|
88 |
50 |
|
99 |
Условия эксперимента: с Me2+ – 50 мг/л; с Na2S – 100 мг/л; с Na2SO4 – 1 г/л;
Jv – 0,2 А/л; τ – 30 мин.
Анализ показывает, что доля дисперсной фазы при рН > 10 для NiS – 95–99%, ZnS – 90–96%, CuS – 90–99%. Степень извлечения достаточно высокая и составляет 88%
70% и 88% соответственно. В то же время, 12% дисперсной фазы для CuS, NiS и 30% для
ZnS не извлечено.
Как показали исследования положительное влияние на частицы сульфида никеля
(отрицательно заряженные) оказывает катионный ПАВ СептаПАВ ХСВ.50, который интенсифицирует процесс и повышает степень извлечения до 98% (pH = 12).
Экспериментальные данные и влияние флокулянтов различной природы приведены в таблице 3.22. Указанный эффект связан с адсорбцией ПАВ и гидрофобизацией поверхности сульфида.
Таблица 3.22 – Влияние рН раствора, природы флокулянта и катионного ПАВ на кинетику электрофлотационного извлечения сульфида никеля
Время |
|
|
Степень извлечения α, % |
|
|||
τ, |
рН |
Без добавок |
Септапав (к) |
С-496 (к) |
А-137 (а) |
N-300 (н) |
|
мин |
|
||||||
|
|
|
|
|
|
||
10 |
10 |
11 |
89 |
83 |
63 |
79 |
|
20 |
42 |
95 |
88 |
88 |
89 |
||
|
|||||||
10 |
12 |
19 |
97 |
87 |
66 |
94 |
|
20 |
68 |
98 |
88 |
89 |
96 |
||
|
|||||||
Условия эксперимента: с Ni2+ – 50 мг/л; с Na2S – 100 мг/л; с ПАВ – 5 мг/л; с Na2SO4 – 1
г/л; Jv – 0,2 А/л; τ – 20 мин.
116
Флокулянты увеличивают размер частиц, что ведет к росту степени извлечения, в
первую очередь в щелочных растворах рН = 12. Результаты ЭФ извлечения CuS
представлены в таблице 3.23.
Таблица 3.23 – Результаты электрофлотационного извлечения сульфида меди (II) в
присутствии ПАВ, флокулянтов и коагулянтов
Время |
|
|
Степень извлечения α, % |
|
|
||||
Без |
|
СЕПТА- |
ПЭО- |
|
|
|
|
||
τ, мин |
NaDDS |
А-137 |
N-300 |
С-496 |
FeCl3 |
||||
добавок |
ПАВ |
1500 |
|||||||
|
|
|
|
|
|
||||
5 |
65 |
90 |
34 |
6 |
86 |
64 |
74 |
90 |
|
15 |
73 |
96 |
73 |
35 |
82 |
63 |
63 |
94 |
|
30 |
70 (98*) |
97 |
92 |
40 |
85 |
63 |
60 |
90 |
|
Условия эксперимента: с Cu2+ – 50 мг/л; с Na2S – 100 мг/л; с ПАВ – 5 мг/л;
с флок. – 5 мг/л; с Na2SO4 – 1 г/л; Jv – 0,2 А/л; τ – 30 минут, рН = 10. * – дополнительная фильтрация.
Установлено, что добавление в систему H2O – CuS – Na2SO4 анионного ПАВ
NaDDS приводит к интенсификации (α5, %) и повышению эффективности процесса (α30, %). Максимальное значение 96–97%. Влияние анионного ПАВ связано с гидрофобизацией поверхности вытеснением молекул H2O с поверхности дисперсной фазы CuS.
Результаты электрофлотационного извлечения сульфида цинка в присутствии ПАВ различной природы не дали положительного эффекта, максимальная степень извлечения
48–53%, что связано с малым размером частиц ZnS, который не изменяется при введении ПАВ. Экспериментальные данные приведены в таблице 3.24.
Таблица 3.24 – Влияние ПАВ на электрофлотационное извлечение сульфида цинка и последующую фильтрационную доочистку
|
|
|
|
Степень извлечения α, % |
|
|
|||
рН |
Без добавок |
Катинол (к) |
NaDDS (а) |
ОС-20-Б (н) |
|||||
|
ЭФ |
ЭФ+Ф |
ЭФ |
|
ЭФ+Ф |
ЭФ |
ЭФ+Ф |
ЭФ |
ЭФ+Ф |
6 |
22 |
83 |
50 |
|
79 |
45 |
80 |
15 |
87 |
11 |
53 |
88 |
48 |
|
95 |
47 |
88 |
15 |
86 |
Условия эксперимента: с Zn2+ – 50 мг/л; с Na2S – 100 мг/л; с ПАВ – 5 мг/л;
с Na2SO4 – 1 г/л, Jv – 0,2 А/л; τ – 30 мин.
117
Выявление причин отсутствия влияния ПАВ на электрофлотационное извлечение сульфидов цинка требуют дальнейших исследований.
С другой стороны, добавление в систему H2O – ZnS – Na2SO4 флокулянтов приводит к росту размера частиц (наблюдается визуально) и, как следствие, к увеличению степени извлечения до 90–99%. Некоторые экспериментальные данные представлены в таблице 3.25.
Таблица 3.25 – Влияние природы флокулянта на процесс ЭФ извлечения сульфида цинка
|
|
|
Степень извлечения α, % |
|
|
||
рН |
Без |
PRAESTOL |
FERROCRY |
PRAESTOL |
ZETAG |
PRAESTO |
М 345 (а) |
|
добавок |
2500 (н) |
L 8737 (н) |
859 (к) |
8185 (к) |
L 2530 (а) |
|
|
|
||||||
6 |
22 / 83* |
68 |
95 |
72 |
56 |
36 |
64 |
11 |
53 / 88* |
70 |
91 |
90 |
85 |
72 |
75 |
Условия эксперимента: с Zn2+ – 50 мг/л; с Na2S – 100 мг/л; с флокулянта – 5 мг/л;
с Na2SO4 – 1 г/л, Jv – 0,2 А/л; τ – 30 мин. * – фильтрация.
Выявлено, что электрофлотационное извлечение сульфида цинка можно увеличить до 95% введением в систему неионогенного флокулянта FERROCRYL 8737.
Наилучший эффект наблюдается при добавлении флокулирующей композиции
Al(OH)3 + ПАВа; Fe(OH)3+ПАВа в соотношении MeS:коагулянт:ПАВ – 5:1:0,5. В этом случае степень извлечения достигает 95–98%.
Низкая флотационная активность наблюдается для дисперсной фазы фосфатов никеля и цинка, максимальное значение степени извлечения 60–65%. Для Cu3(PO4)2
степень извлечения высока и составляет 90–93%, что связано с большими размерами частиц (~50 мкм). В свою очередь, низкие значения степени извлечения для фосфатов никеля и цинка обусловлены малыми размером частиц (8–12 мкм) и высокими отрицательными ξ±-потенциалами. Введение катионного ПАВ увеличивает размер частиц
Ni3(PO4)2 и Zn3(PO4)2 до 35–40 мкм, что обеспечивает высокую эффективность извлечения, степень извлечения достигает 90 – 96%.
В последнее время для удаления ионов SO42- из сточных вод гальванического производства используют реагент BaCO3, при добавлении которого формируется труднорастворимый осадок BaSO4, степень извлечения которого за 30 мин электрофлотации не превышает 5%. Добавление коагулянта Fe3+ повышает степень извлечения до 80%, Al3+ до 52%. Экспериментальные результаты представлены на рисунке 3.8.
118
Рисунок 3.8 – Кинетика электрофлотационного процесса извлечения сульфата бария с различными коагулянтами в присутствии ПАВ: 1 – Fe3+ + ПАВа; 2 – Al3+ + ПАВа;
3 – Cu2+ – ПАВк; 4 – Zn2+ + ПАВк; 5 – Cu2+; 6 – Zn2+: условия эксперимента:
c BаSO4 – 0,2 г/л; c коагулянта – 10 мг/л; c ПАВ – 5 мг/л; c NaCl / Na2SO4 – 0,5 г/л; Jv – 0,4 А/л; рН = 10
Наиболее эффективно процесс электрофлотационного извлечения сульфата бария протекает при добавлении флокулирующей композиции Fe3+ – ПАВа, Fe3+ – ПАВк,
Al3+ – ПАВ. В этом случае степень извлечения достигает 98% при извлечении ВВ BaSO4
до 0,2 г/л, концентрация ПАВ не превышает 10 мг/л, коагулянта 10–20 мг/л.
BaSO4 хорошо извлекается в присутствии гидроксидов меди и цинка в области рН
9–10, в присутствии катионного ПАВ степень извлечения 96–98%. Указанные системы
H2O – ВВ (BaSO4)+ВВ(∑Me(OH)2) часто встречаются в очистке сточных вод гальванохимических производств.
119
3.2. Электрофлотационное извлечение гидроксидов металлов и органических соединений из сточных вод сложного состава (взвешенных веществ,
цветных металлов, поверхностно-активных веществ и композиций Vigon,
Zestron, Gardostrip и Deccordal)
В сточных водах гальванического производства и производства печатных плат электронной техники встречается большое количество органических загрязнений,
применяемых в различных технологических процессах. Так, например, для изготовления печатных плат электронной техники сейчас используют промывочные жидкости для очистки трафаретов VIGON SC-200, ZESTRON FA+.
При обработке стали, алюминия, титана и их сплавов: щелочную добавку
GARDOSTRIP Q 5628/3 для удаления порошковых и жидких полимерных покрытий методом погружения, активатор Q7940, композицию Deccordal.
Анализ данных, представленных в таблице 3.26, показывает, что наличие в сточной воде композиций Vigon приводит к существенному снижению степени извлечения дисперсной фазы труднорастворимых соединений алюминия при добавлении 1 мл композиции 32%. Введение катионного ПАВ приводит к повышению эффективного извлечения до 75%, при этом 15–17% ионов алюминия находится в виде растворимого комплекса [Al – Lx]-, где L – органические компоненты раствора Vigon.
Влияние композиции Zestron проявляется иначе. С одной стороны, % дисперсной фазы Al(OH)2Cl составляет 99%, что свидетельствует об отсутствии комплексообразования алюминия с компонентами композиции, с другой стороны,
происходит подавление ЭФ процесса извлечения дисперсной фазы Al(OH)2Cl. Указанный эффект объясняется адсорбцией органических компонентов на поверхности дисперсной фазы, изменению ее электрокинетического потенциала и приданию поверхности гидрофильных свойств.
120
Таблица 3.26 – Влияние органических композиций на электрофлотационное извлечение коагулянта «UltraPAC» из водного раствора
Степень извлечения α, %
Время, τ, мин
Композиция
1,0 мл/л
0 0,5 мл/л 2,0 мл/л
ЭФ/Ф
Vigon (УМ-С1) |
93 |
75 |
49/83 |
32 |
|
|
|
|
|
Vigon + ПАВк |
93 |
90 |
75/85 |
- |
|
|
|
|
|
Zestron (УМ-С2) |
93 |
23 |
14/99 |
20 |
|
|
|
|
|
Zestron + ПАВк |
93 |
93 |
92/99 |
- |
|
|
|
|
|
Deccordal |
93 |
27 |
10/99 |
16 |
|
|
|
|
|
Deccordal+ ПАВа |
93 |
90 |
89/99 |
- |
|
|
|
|
|
Gardostrip |
93 |
12 |
10/99 |
10 |
|
|
|
|
|
Gardostrip+ПАВа |
93 |
91 |
90/99 |
- |
Условия эксперимента: c NaCl – 1 г/л; pH – 7,0; c Al3+ – 100 мг/л; τ – 20 мин; Jv – 0,4 А/л; c ПАВ – 5 мг/л; ПАВа – NaDDS, ПАВк – СептаПАВ.
Композиции Deccordal и Gardostrip отрицательно влияют на электрофлотационный процесс извлечения дисперсной фазы алюминия, снижая степень извлечения при концентрации композиции 5 мл/л раствора до 10–20%. Добавление ПАВ приводит к повышению извлечения до 90–92% вследствие гидрофобизации поверхности.
Исследовано влияние указанных выше композиций на ЭФ извлечение гидроксидов
Fe(III). Установлено, что композиции Vigon, Zestron и Gardostrip оказывают меньшее влияние на электрофлотационное извлечение Fe(OH)3, чем на Al(OH)3.
Экспериментальные данные представлены в таблице 3.27.
В отсутствии композиций процент дисперсной фазы Fe(OH)3 при рН = 7,0
составляет 94–95%. Добавление в раствор композиций Vigon и Zestron снижают степень извлечения на 20–30%, при добавлении Deccordal – на 80–85%. Для повышения степени извлечения Fe(OH)3 наиболее эффективно применение катионных ПАВ КатаПАВ,
Катамин АБ и СептаПАВ, при их использовании степень извлечения возрастает до
80–95%.
121
Таблица 3.27 – Кинетика электрофлотационного извлечения Fe(OH)3 в присутствии композиций, применяемых в обработке поверхности металлов и пластмасс
|
|
|
Степень извлечения α, % |
|
||
|
|
|
|
|
|
|
Система |
|
|
|
Время, τ, мин |
|
|
|
|
|
|
|
|
|
|
5 |
|
20 |
|
20* ПАВ |
Фильтрация |
|
|
|
|
|
|
|
без добавок |
68 |
|
86 |
|
92 |
94 |
|
|
|
|
|
|
|
|
|
Vigon (УМ-С1) (печ. платы) |
|
|||
|
|
|
|
|
||
0,5 мл/л |
59 |
|
89 |
|
- |
93 |
|
|
|
|
|
|
|
1,0 мл/л |
39 |
|
80 |
|
90 |
94 |
|
|
|
|
|
|
|
2,0 мл/л |
20 |
|
55 |
|
86 |
95 |
|
|
|
|
|
|
|
|
|
Zestron (УМ-С2) (печ. платы) |
|
|||
|
|
|
|
|
||
0,5 мл/л |
70 |
|
64 |
|
90 |
95 |
|
|
|
|
|
|
|
1,0 мл/л |
72 |
|
62 |
|
90 |
95 |
|
|
|
|
|
|
|
2,0 мл/л |
73 |
|
75 |
|
93 |
95 |
|
|
|
|
|
|
|
|
|
Gardostrip (обработка алюминия) |
|
|||
|
|
|
|
|
||
0,5 мл/л |
81 |
|
93 |
|
- |
94 |
|
|
|
|
|
|
|
1,0 мл/л |
75 |
|
91 |
|
- |
94 |
|
|
|
|
|
|
|
2,0 мл/л |
80 |
|
51 |
|
- |
94 |
|
|
|
|
|
|
|
|
|
Deccordal 40-80-2 (обработка стали) |
|
|||
|
|
|
|
|
||
0,5 мл/л |
44 |
|
29 |
|
63 |
94 |
|
|
|
|
|
|
|
1,0 мл/л |
54 |
|
27 |
|
68 |
93 |
|
|
|
|
|
|
|
2,0 мл/л |
66 |
|
15 |
|
74 |
88 |
|
|
|
|
|
|
|
Условия эксперимента: c Na2SO4 – 1 г/л; pH = 7,0; c Fe3+ – 100 мг/л; Jv – 0,4 А/л. * – при добавлении катионного c СептаПАВ – 5 мг/л.
Проведены исследования по влиянию кислого фосфатирующего состава Deccordal 40-80-2, применяемого для мойки крупногабаритных стальных деталей перед нанесением ЛКП на электрофлотационное извлечение гидроксида железа в присутствии ПАВ различной природы. Состав раствора представлен в подразделе 2.4. Экспериментальные данные приведены в таблице 3.28.

122
Таблица 3.28 – Влияние концентрации композиции Decorrdal на электрофлотационное
извлечение гидроксида железа (III) в присутствии ПАВ
|
Концентрация |
Степень извлечения, α, % |
|||
|
|
|
|
|
|
Система Fe(OH)3 |
Decorrdal, |
|
Время, τ, мин |
|
|
|
мл/л |
|
|
|
|
|
5 мин |
30 мин |
|
Фильтр |
|
|
|
|
|
|
|
Без добавок Deccordal |
- |
68 |
86 |
|
95 |
|
|
|
|
|
|
|
0,5 |
23 |
29 |
|
96 |
|
|
|
|
|
|
Deccordal |
1,0 |
6 |
27 |
|
96 |
|
|
|
|
|
|
|
2,5 |
2 |
15 |
|
96 |
|
|
|
|
|
|
|
0,5 |
44 |
63 / 84 * |
|
96 |
|
|
|
|
|
|
Deccordal + СептаПАВ |
1,0 |
54 |
68 / 88 * |
|
96 |
|
|
|
|
|
|
|
2,5 |
66 |
74 / 90 * |
|
96 |
|
|
|
|
|
|
Deccordal + NaDDS |
1,0 |
45 |
19 |
|
96 |
|
|
|
|
|
|
Deccordal + ОС-20 |
1,0 |
2 |
8 |
|
96 |
|
|
|
|
|
|
Deccordal + БетаПАВ |
1,0 |
13 |
9 |
|
96 |
|
|
|
|
|
|
Условия эксперимента: c Na2SO4 – |
1 г/л; pH – 7,0; c Fe3+ |
– 50 мг/л; Jv |
– 0,2 А/л; |
||
c ПАВ – 5 мг/л; c ПАВ* – 10 мг/л. |
|
|
|
|
|
Композиция Decorrdal, попадая в сточные воды, может оказывать негативное влияние на электрофлотационное извлечение ∑Me(OH)2 Cu, NI, Zn, Co, Fe. Эффекты могут быть связаны с адсорбцией компонентов композиций на поверхности гидроксидов и формированием труднофлотируемого комплекса. Экспериментальные данные приведены в таблице 3.29.
123
Таблица 3.29 – Влияние концентрации композиции Decorrdal на электрофлотационное
извлечение смеси труднорастворимых соединений Сu, Ni, Zn, Co и Fe из 5-компонентной
смеси
Время, |
|
|
|
|
|
|
pH 10 |
|
|
||
мин |
|
|
Cu |
|
Ni |
|
Zn |
Co |
Fe |
||
|
|
|
|
|
Без добавок |
|
|
|
|
|
|
5 |
72 |
|
92 |
|
88 |
|
|
83 |
56 |
||
10 |
78 |
|
97 |
|
95 |
|
|
93 |
70 |
||
20 |
92 |
|
98 |
|
96 |
|
|
94 |
85 |
||
30 |
94 |
|
98 |
|
98 |
|
|
94 |
94 |
||
30+Ф* |
98 |
|
99 |
|
99 |
|
|
98 |
97 |
||
|
|
|
|
С(Decorrdal)= 0,5 мл/л |
|
|
|||||
5 |
|
20 |
|
63 |
|
20 |
|
|
21 |
23 |
|
10 |
|
33 |
|
64 |
|
40 |
|
|
43 |
41 |
|
20 |
|
42 |
|
68 |
|
44 |
|
|
45 |
48 |
|
30 |
|
54 |
|
74 |
|
56 |
|
|
58 |
57 |
|
30+Ф* |
|
95 |
|
98 |
|
94 |
|
|
98 |
96 |
|
|
|
|
|
|
С(Decorrdal)= 1 мл/л |
|
|
||||
5 |
|
32 |
|
32 |
|
30 |
|
|
32 |
27 |
|
10 |
|
|
44 |
|
35 |
|
36 |
|
|
35 |
29 |
20 |
|
|
58 |
|
40 |
|
41 |
|
|
45 |
34 |
30 |
|
|
68 |
|
54 |
|
58 |
|
|
51 |
60 |
30+Ф* |
|
|
93 |
|
93 |
|
92 |
|
|
92 |
95 |
|
|
|
|
С(Decorrdal)= 2,5 мл/л |
|
|
|||||
5 |
|
20 |
20 |
|
28 |
|
|
22 |
47 |
||
10 |
|
|
27 |
24 |
|
29 |
|
|
33 |
49 |
|
20 |
|
|
43 |
28 |
|
32 |
|
|
43 |
57 |
|
30 |
|
|
51 |
48 |
|
41 |
|
|
58 |
61 |
|
30+Ф* |
|
|
70 |
77 |
|
71 |
|
|
78 |
80 |
|
Условия эксперимента: cΣ – 100 мг/л (c Cu2+ – 20 мг/л; c Ni2+ – 20 мг/л; c Zn2+ – 20 мг/л; c Co2+ – 20 мг/л; c Fe2+ – 20 мг/л); с Decorrdal – 1 мл/л; Jv – 0,4 A/л; pH = 10.
* – фильтрация раствора(30+Ф) после 30 мин электрофлотации.
Установлено снижение степени извлечения при добавлении 0,5, 1,0 и 2,5 мл/л
композиции Decorrdal с 94–98% до 50–60%. для всех ионов Cu, NI, Zn, Co, Fe.
Анализируя степени извлечения после фильтрации можно констатировать, что в растворе формируются растворимые комплексы. При концентрации Decorrdal 2,5 мл/л в растворе находится 30% комплекса Cu, 23% Ni, 29% Zn, 22% Co, 20% Fe. Все это осложняет процессы очистки таких сточных вод с использованием процессов фильтрации, седиментации и электрофлотации.
124
Один из подходов к очистке сложных многокомпонентных сточных вод связан с возможностью адсорбции компонентов композиций на свежесформированных осадках
Fe(OH)3, Al(OH)3, Me(OH)2 или порошкообразных углеродных материалах. Результаты по адсорбции некоторых композиций представлены в таблице 3.30. Величины адсорбции приведены в единицах ХПК/г, так как точный состав композиций по органическим
веществам неизвестен.
Таблица 3.30 – Влияние природы адсорбента на величину адсорбции Аадс (ХПК/г) GARDOSTRIP Q7940 и DECORRDAL 40-80-2
Композиция |
|
Величина адсорбции, Аадс (ХПК/г) |
|
||
Концентрация, мл/л |
|
GARDOSTRIP Q7940 |
|
||
Fe3+ |
|
Al3+ |
|
ОУ-Б |
|
|
|
|
|||
0,3 |
50 |
|
150 |
|
200 |
0,4 |
60 |
|
130 |
|
390 |
0,5 |
200 |
|
140 |
|
500 |
Концентрация, мл/л |
|
DECORRDAL 40-80-2 |
|
||
Fe3+ |
|
Al3+ |
|
ОУ-Б |
|
|
|
|
|||
3 |
230 |
|
400 |
|
660 |
4 |
760 |
|
790 |
|
800 |
5 |
670 |
|
600 |
|
850 |
6 |
720 |
|
1770 |
|
850 |
Условия эксперимента: время: τ – 60 минут; pH–7; c адсорбента – 200 мг/л.
Установлено, что наличие в сточной воде Al(OH)3, Fe(OH)3, порошков углеродных материалов (ОУ-Б) обеспечивает извлечение органических компонентов в широком диапазоне концентраций до 1000 мгО/л.
Современное высокотехнологичное наукоемкое производство включает в себя не только гальванические цеха и участки линии размерной обработки стали и сплавов, но и механические и сборочные цеха, участки изготовления композиционных материалов и сбора изделий из них, линии и цеха по производству печатных плат электронной техники,
участки нанесения лакокрасочных покрытий.
Для получения изделий требуемого качества применяются сложные композиции,
имеющие в своем составе компоненты, затрудняющие очистку: монофениловый эфир этиленгликоля, бензотриазол и его модификации, диэтиленгликоль, моноэтиловый эфир,
диметилсульфоксид, изодециловый спирт, этиленгликоль, бензиловый и изопропиловый спирт, циклогексанол и другие органические спирты, этоксилаты органических спиртов
125
С9-С11, обезжириватель ДВ-301, сульфонол НП-3, средства моющие: ТМС-31, ТМС-31А, «Вертолин-74», «Лабомид-203», МЛ-51, МЛ-52, различные лаки и растворители и другие органические композиции.
В таблице 3.31 представлено влияние компонента ЛЖ-6А (основа – бутиловый спирт) – люминесцирующей жидкости желто-зеленого цвета, применяемой в капиллярной дефектоскопии для определения качества покрытия.
Таблица 3.31 – Влияние органической добавки ЛЖ-6А и ПАВ на электрофлотационное извлечение смеси гидроксидов меди, никеля и цинка
Система |
Степень извлечения ∑Ме(ОН)n, α, % |
|||
|
|
|
||
|
|
Zn(OH)2 |
Ni(OH)2 |
Cu(OH)2 |
|
|
|
|
|
без добавок |
90 |
86 |
88 |
|
|
|
|
|
|
+ 5 мг/л ЛЖ-6А |
45 |
50 |
60 |
|
|
|
|
|
|
+ 10 мг/л ЛЖ-6А |
14 |
11 |
15 |
|
|
|
|
|
|
+ 10 |
мг/л ЛЖ-6А + NaDBSа |
96 |
90 |
98 |
|
|
|
|
|
+ 10 |
мг/л ЛЖ-6А + СептаПАВк |
96 |
97 |
95 |
|
|
|
|
|
+ 10 |
мг/л ЛЖ-6А + ОС-20Бн |
90 |
93 |
92 |
|
|
|
|
|
+ 10 |
мг/л ЛЖ-6А + ПЭО-1500н |
89 |
88 |
89 |
|
|
|
|
|
Условия эксперимента: с ∑Ме2+ – 45 мг/л; с ЛЖ-6А – 5, 10 мг/л; с ПАВ – 5 мг/л;
с Na2SO4 – 1г/л; Jv – 0,2 А/л; τ – 20 мин; рН = 10.
Как показали исследования, для осадков гидроксидов меди композиции Vigon и Zestron являются лигандами, за счет того, что в их состав входят триэтиламин, 2-
аминоэтанол, моноэтаноламин, триэтаноламин при концентрации композиции 1 мл/л (ХПК 1000±100 ед. мгО/л) и Cu2+ – 50 мг/л, процентное содержание меди в осадке составляет без композиции – 99%, в присутствии Vigon – 43%, Zestron – 96%,
моноэтаноламин – 34%, триэтаноламин – 32%, 2-аминоэтанол – 60%.
С целью исключения попадания композиций Vigon и Zestron в сточные воды производства печатных плат, где высокая концентрация ионов меди, предложено извлекать указанные композиции на свежеосажденном осадке Al(OH)3, а также на порошках углей, например, ОУ-Б.
В таблице 3.32 представлены данные по сорбции композиций Vigon и Zestron на гидроксиде алюминия и порошкообразном угле ОУ-Б.
126
Таблица 3.32 – Величины адсорбции композиций Vigon и Zestron на гидроксиде
алюминия и порошках ОУ-Б
|
|
|
|
Аадс (ХПК/г) |
|
|
|
Концентрация, |
|
Vigon |
|
|
Zestron |
||
|
|
|
сорбент |
|
|
||
мл/л |
|
|
|
|
|
||
|
Al(OH)3 |
|
ОУ-Б |
|
Al(OH)3 |
|
ОУ-Б |
|
|
|
|
|
|
|
|
0,3 |
410 |
|
10 |
|
530 |
|
45 |
0,4 |
690 |
|
30 |
|
680 |
|
230 |
0,5 |
670 |
|
130 |
|
1070 |
|
250 |
0,6 |
590 |
|
130 |
|
1160 |
|
240 |
Условия эксперимента: τ – 30 мин; c адсорбента – 200 мг/л.
Отмечено, что адсорбция на осадках Al(OH)3 в 4–5 раз выше, чем на порошках
углей.
В состав композиций Vigon и Zestron по литературным данным входит до пяти различных органических компонентов.
С целью определения базовых компонентов композиции Vigon SC200 проведено снятие рамановских спектров образцов жидкости, используемых при производстве печатных плат в качестве промывочных жидкостей.
Полученные образцы спектров промывочной жидкости Vigon SC200 с наиболее интенсивными пиками при времени интегрирования 50 с и 100% мощности лазера представлены на рисунке 3.9
127
Рисунок 3.9 – Рамановский спектр промывочной жидкости Vigon SC200
128
Исследования показали, что в состав композиции входит пять базовых органических компонентов, в том числе: 2-бутоксиэтанол; моноэтаноламин;
триэтаноламин; додециловый спирт и фосфорная кислота.
Точная концентрация компонентов и их российский аналог УМС-1 (Vigon)
представлена в Государственном контракте «Электролит», выполненным РХТУ им. Д.И.
Менделеева в 2016–2018 г. по заданию Минпромторга России.
Проведенный анализ сточной воды растворов, содержащих Vigon SC200 после обработки сорбентами: порошками углей и свежеосажденным гидроксидом алюминия показал существенное снижение концентраций после обработки, что свидетельствует о полном удалении всех органических компонентов в исследуемых растворах.
С целью определения базовых компонентов композиции Zestron проведено снятие рамановских спектров образцов жидкости, используемой при производстве печатных плат в качестве промывочной жидкости.
Полученные образцы спектров промывочной жидкости Zestron с наиболее интенсивными пиками при времени интегрирования 50 с и 100% мощности лазера представлены на рисунке 3.10.
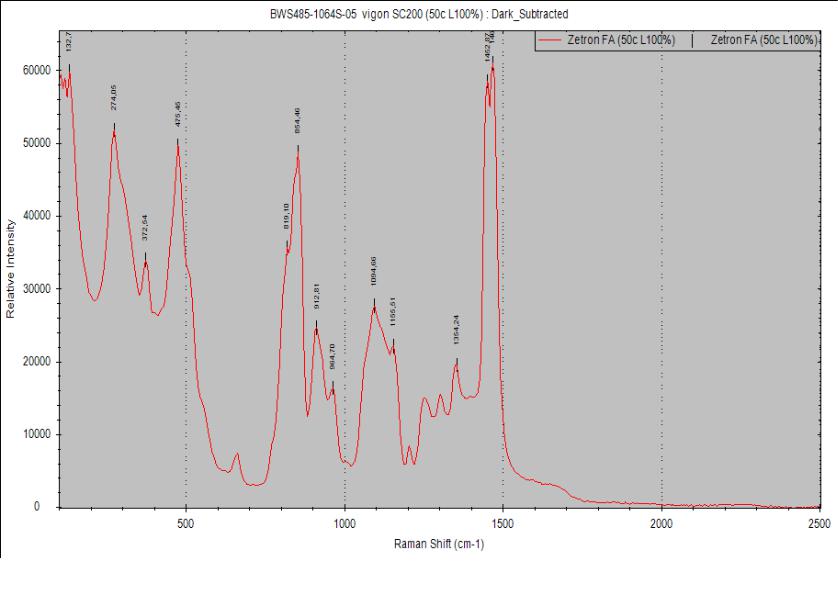
129
Рисунок 3.10 – Рамановский спектр промывочной жидкости Zestron
130
Исследования показали, что в состав композиции входит пять базовых органических компонентов:2-бутоксиэтанол; моноэтаноламин; диметилформамид;
диацетоновый спирт; бутанол.
Проведенный анализ сточной воды с добавлением Zestron после обработки сорбентами (порошками углей и свежеосажденным гидроксидом алюминия) показал существенное снижение концентрации композиции в воде.
. Экспериментальные данные по адсорбции композиций Vigon и Zestron
представлены ранее для Al(OH)3 и ОУ-Б (таблица 3.33). Проведены исследования по возможности извлечения отдельных компонентов органических соединений, входящих в композиции Vigon и Zestron с использованием порошкообразных сорбентов (ОУ-Б) и
осадков Al(OH)3.
Таблица 3.33 – Влияние природы адсорбента на величину адсорбции органических соединений
cисх., |
|
|
|
А, мг/г |
|
|
|
||
моноэтаноламин |
бутилгликоль |
бутанол |
ДМФА |
||||||
мг/л |
|||||||||
Al |
ОУ-Б |
Al |
ОУ-Б |
Al |
ОУ-Б |
Al |
ОУ-Б |
||
|
|||||||||
250 |
1090 |
290 |
730 |
390 |
440 |
150 |
540 |
130 |
|
500 |
1430 |
340 |
800 |
450 |
940 |
550 |
1150 |
290 |
|
750 |
1620 |
720 |
820 |
400 |
1030 |
500 |
1700 |
300 |
|
1000 |
1860 |
800 |
790 |
380 |
1020 |
540 |
2440 |
600 |
|
Условия эксперимента: рН = 7,0; c адсорбента – 200 мг/л; перемешивание +
фильтрование; τ – 30 минут.
Из данных таблицы можно видеть, что величины адсорбции на гидроксиде алюминия в 2–3 раза выше в расчете на 1 г сорбента, чем на порошках ОУ-Б, что делает более перспективным применение Al(OH)3 при очистке сточных вод от органических загрязнений для участков производства печатных плат.
Сравнительный состав композиций Vigon и Zestron представлен в таблице 3.34.
Необходимо отметить, что в состав Vigon входят два компонента, способных образовывать комплексы с Cu2+, Zn2+, Cd2+, Ni2+, что будет затруднять процесс водоочистки.
131
Таблица 3.34 – Состав композиций Vigon и Zestron
Компонент, % |
Vigon |
Zestron |
|
|
|
2-бутоксиэтанол |
+ |
+ |
|
|
|
Моноэтаноламин |
+ |
+ |
|
|
|
Триэтиламин |
+ |
- |
|
|
|
Додециловый спирт |
+ |
- |
|
|
|
Диметилформамид |
- |
+ |
|
|
|
Бутанол |
- |
+ |
|
|
|
Диацетоновый спирт |
- |
+ |
|
|
|
Фосфорная кислота |
+ |
- |
|
|
|
Примечание: «+» – входит в состав; «–» – не входит в состав.
Полученные результаты использованы в разделе 4 для разработки технологий очистки сточных вод производства печатных плат, в частности для удаления органических загрязнений, входящих в состав композиций Vigon и Zestron.
Таким образом, для разработки технологии очистки сточных вод сложного состава,
содержащих ионы металлов Al, Fe, Cu, Zn, Ni, органические вещества необходимо оценивать величину ХПКобщ (общее содержание органических веществ) и ХПКраст после фильтрации и ХПКвзв, а также концентрации ПАВ.
При высоком содержании органических компонентов ХПКвзв (80–90%) ЭФ обеспечит высокую эффективность при добавлении композиции: коагулянт (< 30 мг/л) –
ПАВ (5–10 мг/л). При высоком содержании растворимых соединений ХПКраст (30–80%)
ЭФ обеспечивает высокую эффективность при добавлении сорбентов (50–200 мг/л),
порошков активированных углей ОУ-Б и высокой дозы Al(OH)3 (> 50 мг/л)+ПАВ
(1–10 мг/л).
