
ВИЧ-инфекция
.pdf6.3. АРТ 2015/2016: Там, за горизонтом 163
Ahmad A, Ahmad R, Iannello A, et al. IL-15 and HIV infection: lessons for immunotherapy and vaccination. Curr HIV Res 2005, 3:261-70.
Anaya JP Sias JJ.The use of interleukin-2 in human immunodeficiency virus infection. Pharmacotherapy 2005, 25:86-95. Angel JB, High K, Rhame F, et al. Phase III study of granulocyte-macrophage colony-stimulating factor in advanced HIV disease: effect on infections, CD4 cell counts and HIV suppression. Leukine/HIV Study Group. AIDS 2000, 14:387-95. Angel JB, Jacobson MA, Skolnik PR, A multicenter, randomized, double-blind, placebo-controlled trial of recombinant human interleukin-10 in HIV-infected subjects. AIDS 2000; 14:2503-8.
Asmuth DM, Murphy RL, Rosenkranz SL, et al. Safety, tolerability, and mechanisms of antiretroviral activity of pegylated interferon Alfa-2a in HIV-1-monoinfected participants: a phase II clinical trial. J Infect Dis 2010, 201:1686-96.
Azzoni L, Foulkes AS, Papasavvas E, et al. Pegylated Interferon alfa-2a monotherapy results in suppression of HIV type 1 replication and decreased cell-associated HIV DNA integration. J Infect Dis 2013, 207:213-22.
Bahr GM, De La Tribonniere X, et al. Clinical and immunological effects of a 6 week immunotherapy cycle with murabutide in HIV-1 patients with unsuccessful long-term antiretroviral treatment. J Antimicrob Chemother 2003, 51:1377-88.
Baum MK, Campa A, Lai S, et al. Effect of micronutrient supplementation on disease progression in asymptomatic, antiretroviral-naive, HIV-infected adults in Botswana: a randomized clinical trial. JAMA 2013, 310:2154-63. Blanckenberg DH, Wood R, Horban A, et al. Evaluation of nevirapine and/or hydroxyurea with nucleoside reverse transcriptase inhibitors in treatment-naive HIV-1-infected subjects. AIDS 2004, 18:631-40.
Bredt BM, Higuera-Alhino D, Shade SB, et al. Short-term effects of cannabinoids on immune phenotype and function in HIV- 1-infected patients. J Clin Pharmacol 2002; 42:82S-89S.
Brites C, Gilbert MJ, Pedral-Sampaio D, et al.A randomized, placebo-controlled trial of granulocyte-macrophage colonystimulating factor and nucleoside analogue therapy in AIDS. J Infect Dis 2000, 182: 1531-5.
Calabrese LH, Lederman MM, Spritzler J, et al. Placebo-controlled trial of Cyclosporin-A in HIV-1 disease: Implications for solid organ transplantation. J Acquir Immune Defic Syndr 2002, 29:359-362.
Carcelain G, Saint-Mezard P Altes HK, et al. IL-2 therapy and thymic production of naive CD4 T cells in HIVinfected patients with severe CD4 lymphopenia. AIDS 2003;17:841-50.
Chahroudi A, Silvestri G. Interleukin-7 in HIV pathogenesis and therapy. Eur Cytokine Netw 2010, 21:202-7. Chun TW, Engel D, Mizell SB, et al. Effect of interleukin-2 on the pool of latently infected, resting CD4+ T cells in HIV-1-infected patients receiving HAART. Nat Med 1999, 5:651-5.
Davey RT JR, Murphy RL, Graziano FM, et al. Immunologic and virologic effects of subcutaneous interleukin 2 in combination with ART: A randomized controlled trial. JAMA 2000, 284: 183-9.
Davidson M, Min YI, Holbrook JT, et al. Use of filgrastim as adjuvant therapy in patients with AIDS-related cytomegalovirus retinitis. AIDS 2002, 16: 757-65.
Fagard C, Le Braz M, Gunthard H, et al. A controlled trial of GM-CSF during interruption of HAART. AIDS 2003, 17:148792.
Haas DW, Lavelle J, Nadler JP, et al. A randomized trial of interferon alpha therapy for HIV type 1 infection. AIDS Res Hum Retrovir 2000, 16:183-90.
Hatzakis A, Gargalianos P Kiosses V, et al. Low-dose IFN-alpha monotherapy in treatment-naive individuals with HIV-1 infection: evidence of potent suppression of viral replication. J Interferon Cytokine Res 2001, 21:861-9. Havlir DV, Gilbert PB, Bennett K, et al. Effects of treatment intensification with hydroxyurea in HIV-infected patients with virologic suppression. AIDS 2001; 15: 1379-88.
Isanaka S, Mugusi F, Hawkins C, et al. Effect of high-dose vs standard-dose multivitamin supplementation at the initiation of HAART on HIV disease progression and mortality in Tanzania: a randomized controlled trial. JAMA 2012, 308:1535-44 Jacobson JM, Lederman MM, Spritzler J, et al. GM CSF induces modest increases in plasma HIV type 1 RNA levels and cd4+ lymphocyte counts in patients with uncontrolled HIV infection. J Infect Dis 2003; 188: 1804-14. Jacobson MA, Spritzler J, Landay A, et al. A Phase I, placebo-controlled trial of multi-dose recombinant human interleukin-12 in patients with HIV infection. AIDS 2002; 16:1147-54.
Kahn JO, Cherng DW, Mayer K, et al. Evaluation of HIV-1 immunogen, an immunologic modifier, administered to patients infected with HIV having 300 to 549 x 10(6)/L CD4 cell counts: A randomized controlled trial. JAMA 2000, 284:2193-202. Kovacs JA, Lempicki RA, Sidorov IA, et al. Induction of prolonged survival of CD4+ T lymphocytes by intermittent IL-2 therapy in HIV-infected patients. J Clin Invest 2005; 115: 2139-2148.
Kuritzkes DR, Parenti D, Ward DJ, et al. Filgrastim prevents severe neutropenia and reduces infective morbidity in patients with advanced HIV infection: results of a randomized, multicenter, controlled trial. AIDS 1998, 12:65-74. Lederman MM, Smeaton L, Smith KY, et al. Cyclosporin A provides no sustained immunologic benefit to persons with chronic HIV-1 infection starting suppressive antiretroviral therapy: results of ACTG 5138. JID 2006, 194:167785.
Levy Y, Lacabaratz C, Weiss L, et al. Enhanced T cell recovery in HIV-1-infected adults through IL-7 treatment. J Clin Invest 2009, 119:997-1007.
Lévy Y, Sereti I, Tambussi G, et al. Effects of recombinant human interleukin 7 on T-cell recovery and thymic output in HIVinfected patients receiving antiretroviral therapy: results of a phase I/IIa randomized, placebo-controlled, multicenter study. Clin Infect Dis 2012, 55:291-300.
Lisziewicz J, Foli A, Wainberg M, Lori F. Hydroxyurea in the treatment of HIV infection: clinical efficacy and safety concerns. Drug Saf 2003; 26:605-24.
Lisziewicz J, Rosenberg E, Lieberman J, et al. Control of HIV despite the discontinuation of antiretroviral therapy. NEJM 1999, 340:1683-4.
Lori F, Malykh A, Cara A, et al. Hydroxyurea as an inhibitor of HIV-type 1 replication. Science 1994, 266:801-5. Margolis D, Mukherjee L, Hogg E, et al.A phase I/II randomized, double-blind, placebo-controlled pilot study of b-D-2,6-diaminopurine
164 Антиретровирусная терапия (АРТ)
dioxolane vs DAPD + mycophenolate mofetil in treatment-experienced Subjects (ACTG 5165). Abstract 517, 13th CROI 2006, Denver.
Margolis DM, Kewn S, Coull JJ, et al. The addition of mycophenolate mofetil to antiretroviral therapy including abacavir is associated with depletion of intracellular deoxyguanosine triphosphate and a decrease in plasma HIV- 1 RNA. J AIDS 2002, 31:45-9.
Markowitz M, Vaida F, Hare CB, Boden D, et al. The virologic and immunologic effects of cyclosporine as an adjunct to antiretroviral therapy in patients treated during acute and early HIV-1 Infection. J Infect Dis 2010 Mar 17. [Epub ahead of print]
McComsey GA, Whalen CC, Mawhorter SD, et al. Placebo-controlled trial of prednisone in advanced HIV-1 infection. AIDS 2001;15:321-7.
Mexas A, Papasavvas E, Azzoni L, et al. Concurrent Measurements of Total and Integrated HIV DNA Provide Insight into the Mechanism of Reduced Reservoir Size in an Interferon-alpha followed by Structured Treatment Interruption Trial. Abstract 374, 19th CROI 2012, Seattle.
Mildvan D, Bassiakos Y, Zucker ML, et al. Synergy, activity and tolerability of zidovudine and interferon-alpha in patients with symptomatic HIV-1 infection: ACTG 068. Antivir Ther 1996; 1: 77-88.
Miro J, Lopez-Dieguez M, Plana M, et al. Randomized clinical trial with immune-based therapy in patients with primary hiv-1 infection. Abstract 531, 16th CROI 2009, Montréal.
Mitsuyasu R. Immune therapy: non-HAART management of HIV-infected patients. J Infect Dis 2002, 185 (Suppl 2): S11522.
Moore RD, Keruly JC, Chaisson RE.Incidence of pancreatitis in HIV-infected patients receiving nucleoside reverse transcriptase inhibitor drugs. AIDS 2001, 15:617-20.
Moore RD, Wong WM, Keruly JC, McArthur JC.Incidence of neuropathy in HIV-infected patients on monotherapy versus those on combination therapy with didanosine, stavudine and hydroxyurea. AIDS 2000, 14: 273-8. Papasavvas E, dawany N, Azzoni L, et al. Immune Correlates of Sustained IFN-alpha-mediated Suppression of HIV Replication: Association with IFN- alpha-mediated Signaling and Increased NK Cell Responses. Abstract 93, 19th CROI 2012, Seattle.
Press N, Kimel G, Harris M, et al. Case series assessing the safety of mycophenolate as part of multidrug rescue treatment regimens. HIV Clin Trials 2002, 3:17-20.
Rizzardi GP, Harari A, Capiluppi B, et al. Treatment of primary HIV-1 infection with cyclosporin A coupled with HAART. J Clin Invest 2002, 109:681-688.
Rutschmann OT, Opravil M, Iten A, et al. A placebo-controlled trial of didanosine plus stavudine, with and without hydroxyurea, for HIV infection.The Swiss HIV Cohort Study. AIDS 1998, 12: F71-7.
Rutschmann OT, Opravil M, Iten A, et al. Didanosine plus stavudine with or without hydroxyurea in HIV-1- infected patients: 1 year follow-up. Antivir Ther 1998, 3 (Suppl 4): 65-7.
Sankatsing SU, Jurriaans S, van Swieten P et al. Highly active antiretroviral therapy with or without mycophenolate mofetil in treatment-naive HIV-1 patients. AIDS 2004, 18:1925-31.
Sereti I, Dunham RM, Spritzler J, et al. IL-7 administration drives T cell-cycle entry and expansion in HIV-1 infection. Blood 2009, 113:6304-6314.
Sereti I, Imamichi H, Natarajan V, et al. In vivo expansion of CD4+CD45RO-CD25+ T cells expressing foxP3 in IL-2-treated HIV-infected patients. J Clin Invest 2005; 115: 1839-1847.
Sereti I, Lane HC. Immunopathogenesis of HIV: implications for immune-based therapies. Clin Infect Dis 2001, 32: 1738-55. Skowron G, Stein D, Drusano G, et al. The safety and efficacy of granulocyte-macrophage colony-stimulating factor (Sargramostim) added to indinaviror ritonavir-based antiretroviral therapy: a randomized double-blind, placebo-controlled trial. J Infect Dis 1999, 180:1064-71.
Stebbing J, Nelson M, Orkin C, et al. A randomized trial to investigate the recycling of stavudine and didanosine with and without hydroxyurea in salvage therapy (RESTART). J Antimicrob Chemother 2004, 53:501-5. Swindells S, Cohen CJ, Berger DS, et al. Abacavir, efavirenz, didanosine, with or without hydroxyurea, in HIVinfected adults failing initial nucleoside/protease inhibitor-containing regimens. BMC Infect Dis 2005, 5:23. Tavel JA; INSIGHT STALWART Study Group, et al. Effects of intermittent IL-2 alone or with peri-cycle antiretroviral therapy in early HIV infection: the STALWART study. PLoS One 2010, 5:e9334.
Vento S, Cainelli F, Temesgen Z. Interleukin-2 therapy and CD4+ T cells in HIV-1 infection. Lancet 2006, 367:93-5. Wallis RS, Kalayjian R, Jacobson JM, et al. A Study of the immunology, virology, and safety of prednisone in hiv- 1-infected subjects with CD4 cell counts of 200 to 700 mm-3. J AIDS 2003; 32: 281-6.
Zala C, Salomon H, Ochoa C, et al. Higher rate of toxicity with no increased efficacy when hydroxyurea is added to a regimen of stavudine plus didanosine and nevirapine in primary HIV infection. J Acquir Immune Defic Syndr 2002, 29: 368-73.
6.4. Цели лечения 165
6.4. Цели лечения
Ввиду продолжающейся дискуссии об излечении ВИЧ-инфекции, которая в последние годы была подкреплена несколькими интересными сообщениями, эта глава перемещена в Часть 2. Раздел 4.1 посвящен целям длительной антиретровирусной терапии, раздел 4.2 посвящен стратегической цели лечения и проблемам, возникающим на пути к ней.
6.4.1. Цели длительной терапии
CHRISTIAN HOFFMANN
При имеющихся в настоящее время антиретровирусных препаратах важнейшая (с теоретической точки зрения) цель лечения, включающая в себя излечение ВИЧ-инфекции (термин боле подробно разъяснен ниже, в главе 6.4.2), до настоящего времени не достигнута. Возможность ее потенциального достижения для многих пациентов по-прежнему под вопросом.
Реальность такова, что АРТ является пожизненной, и это необходимо принять как данность. Сегодня термин «пожизненный» означает несколько десятилетий, поскольку многое говорит о том, что при достаточно здоровом образе жизни ожидаемая продолжительность жизни ВИЧ-инфицированных пациентов приближается к нормальной (Obel 2011, Nakagawa 2012). Пациенты и лечащий врач также должны быть неизменно настроены на длительное лечение. Важнейшая цель антиретровирусной терапии в каждом случае должна звучать так:
Продление жизни пациента по возможности при хорошем состоянии здоровья и высоком качестве жизни на длительный срок.
В ходе повседневной диагностической работы, включающей в себя рутинные лабораторные анализы на содержание клеток CD4 и вирусную нагрузку, анализы на резистентность и тропизм, HLA-типирование и измерение плазменной концентрации препарата, эта цель теряется из виду. Необходимо постоянно напоминать себе о том, к чему, собственно говоря, мы должны стремиться. Конечно, на пути к здоровью пациента любят ориентироваться на высокий уровень клеток CD4 и низкую вирусную нагрузку, однако вопрос самочувствия пациента как минимум так же важен, как и лабораторные показатели! Сами пациенты также нередко не могут видеть сути лечения. Довольно часто в ответ на вопрос «Как Вы себя чувствуете?» врач может увидеть косой взгляд пациента на бланк с новыми данными анализа на уровень CD4 и услышать: «Это я у Вас хотел спросить!»
Такое лечение, которое направлено только на улучшение лабораторных показателей и оставляет без внимания физическое и психическое состояние пациента, не может быть хорошим. Мы лечим именно пациента, а не вирусную нагрузку или уровень клеток CD4.
Успех лечения и неудача в лечении
Вывод об успехе или неудаче терапии можно сделать на основании вирусологических, иммунологических и клинических критериев. Несмотря на то, что эти критерии часто взаимосвязаны, необходимо их разграничивать.
Чаще всего вирусологический успех и вирусологическую неудачу терапии можно распознать уже на самых ранних стадиях лечения. Об этом свидетельствует снижение вирусной нагрузки или отсутствие ее снижения (и даже повышение) соответственно. По прошествии некоторого времени часто возникает возможность оценить иммунологический успех/иммунологическую неудачу лечения на основании количества клеток CD4. Клиническая неудача чаще всего будет заметна значительно позже: сначала ухудшаются лабораторные показатели, затем – состояние пациента. Пациенты, не имеющие жалоб, часто вообще не ощущают клинического успеха. Несмотря на то, что риск развития оппортунистических инфекций снижается приблизительно вдвое уже после трех месяцев
166 Антиретровирусная терапия (АРТ)
антиретровирусной терапии (Ledergerber 1999), пациент никогда не заметит тех состояний, которые были предотвращены.
Вирусологический успех и вирусологическая неудача
Вирусологическим успехом обычно считается снижение вирусной нагрузки ниже порога количественного определения, равного 50 копий/мл. Это основано на опыте, свидетельствующем о том, что чем быстрее и (прежде всего) сильнее упадет уровень вирусной нагрузки, тем дольше сохранится эффект терапии (Kempf 1998, Powderly 1999). Уже в исследовании INCAS относительный риск неудачи в лечении (определяется как повышение вирусной нагрузки более 5000 копий/мл) у пациентов, достигших вирусной нагрузки менее 20 копий/мл, был в 20 раз ниже, чем у пациентов с вирусной нагрузкой менее 400 копий/мл (Raboud 1998). В недавно проведенном исследовании ACTG 5202 было установлено, что сравнительно слабое снижение вирусной нагрузки в течение первых 4 недель может свидетельствовать о последующей вирусологической неудаче (Grant 2013). Связь этих факторов была значительной: снижение скорости падения вирусной нагрузки на 1 Log повышает риск, в зависимости от типа терапии, на 30-80 %.
Вирусная нагрузка на фоне терапии снижается двухфазно. После первичного крайне быстрого снижения в течение первых нескольких недель следует медленная фаза, в которой плазменная виремия снижается постепенно. Показатели ниже порога количественного определения должны быть достигнуты приблизительно через 3-4 месяца. При крайне высокой вирусной нагрузке на начальном этапе это может продолжаться несколько дольше. Определяемый уровень вирусной нагрузки через 6 месяцев практически всегда следует расценивать как неудачу. То же можно сказать о повторном повышении вирусной нагрузки после краткосрочного контроля – в данной ситуации следует обдумать, каким образом можно усовершенствовать терапию (увеличить резорбцию препарата или комплаентность пациента? Снизить резистентность вируса?). Вирусологическую неудачу можно распознать уже на ранних этапах лечения, поэтому первое контрольное обследование после 4 недель терапии является целесообразным не только по психологическим соображениям («сказать пациенту, что вирусная нагрузка снижается, уровень Т-хелперов повышается»): она позволяет получить важные данные о дальнейшем успехе терапии. Если после 4 недель терапии вирусная нагрузка составляет, по крайней мере, не ниже 5000 копий/мл, вероятна последующая неудача в лечении (Maggiolo 2000). Если после 8 недель терапии вирусная нагрузка составляет не ниже 500 копий/мл или как минимум не снизилась на 1 Log от исходного значения, вероятность ее снижения менее 500 копий/мл через 24 недели составляет только 9 % (Demeter 2001). В исследовании ACTG 5202 при снижении скорости падения вирусной нагрузки в течение первых 4 недель на 1 Log риск вирусологической неудачи повышался, в зависимости от терапии, на 30-80 % (Grant 2013). Согласно данным проспективного исследования, ответ на лечение через 48 недель можно прогнозировать уже через 7 дней (Haubrich 2011) – однако оценка вирусологического контроля на столь ранних сроках не является стандартом рутинной клинической практики. Причем прогнозирование не является настолько точным, как, к примеру, при гепатите С, вследствие этого подобные расчеты не применяются в повседневной клинической практике.
В качестве критерия успеха произвольно был выбран пороговый уровень вирусной нагрузки, равный 20 или 50 копиям/мл. Он определяется имеющимися в настоящее время методами оценки вирусной нагрузки. Тот факт, что вирусная нагрузка 60 копий/мл действительно хуже, чем 30 копий/мл, и характеризуется снижением шансов на терапевтический успех, однозначно не доказан. Есть данные о том, что при стойко низком уровне вирусной нагрузки (LLV, «низкий уровень виремии»), равном 20-50 копий/мл, как минимум в среднесрочной перспективе (в течение года) у пациента отсутствует повышенный риск вирусологической неудачи, по сравнению с пациентами, у которых вирусная нагрузка остается на уровне ниже 20 копий/мл (Charpentier 2012). В других исследованиях, напротив, даже при низких показателях виремии была выявлена прямая взаимосвязь между уровнем вирусной нагрузки
6.4. Цели лечения 167
и вероятностью вирусологической неудачи (Maggiolo 2012, Pugliese 2013). В настоящее время значение LLV продолжает обсуждаться с различных точек зрения.
Кроме того, при низких показателях виремии должна учитываться погрешность измерений. Однократное повышение вирусной нагрузки выше значений, считающихся низкими («скачок»), часто не является значимым (см. ниже). Следует отличать подобные «скачки» от повторно определяемой вирусной нагрузки (50-400 копий/мл). Результаты многочисленных исследований свидетельствуют о том, что такие случаи уже указывают на развитие резистентности. Репликация вируса и формирование новых типов резистентности могут продолжаться сами по себе, даже при низком содержании вируса (Gunthard 1998, Nettles 2004, Taiwo 2012). Об иммунной активации и показателях воспаления при превышении LLV были сделаны иные выводы. Как минимум в двух исследованиях сдвиг в сторону LLV не сопровождался неблагоприятным эффектом (Eastburn 2011, Taiwo 2012), по данному вопросу уже проводится дополнительное исследование (Reus 2013).
Снижением вирусной нагрузки «ниже порога количественного определения» в настоящее время следует считать только снижение менее 50 копий/мл, не больше и не меньше. Согласно грубым оценкам, при вирусной нагрузке 50 копий/мл с учетом, того, что общее количество крови составляет 5 литров, в каждом организме находится 250000 вирусов; максимальная концентрация существует в лимфатических органах. С учетом этих значений, кажется теоретически возможным, что наличие незначительной, но определяемой виремии предупреждает развитие резистентности в течение длительного времени. Вероятно, между пациентами, имеющими уровень вирусной нагрузки 50 копий/мл и 10 копий/мл, существуют актуальные различия, влияющие на риск развития резистентности, но мы можем их оценить лишь приблизительно.
Самыми важными факторами риска вирусологической неудачи являются предшествующая антиретровирусная терапия (возникновение резистентности) и низкая комплаентность. На вопрос о том, играет ли роль уровень вирусной нагрузки у наивных пациентов и количество клеток CD4 на момент начала терапии, до настоящего времени не было получено достоверного ответа (см. также обсуждение в разделе Когда начинать АРТ?). Вероятно, многие другие факторы, влияющие на успех лечения, остаются неизвестными. Новое направление в науке, которое сегодня стоит у своих истоков, но приобретает все большее значение, – это фармакогенетика. Она изучает индивидуальные генетические факторы, влияющие на успех лечения. До настоящего времени были изучены, в основном, факторы, позволяющие прогнозировать непереносимость или аллергию на определенные препараты, к примеру, абакавир или невирапин (см. соответствующий раздел). Но могут появиться анализы, которые при использовании в повседневной практике позволят еще больше индивидуализировать АРТ и повысить шансы на достижение успеха в лечении. Это касается различных аспектов, от индивидуального подбора дозировки до прогнозирования ответа на лечение. Так, к примеру, выполнение теста на тропизм вируса уже стало стандартом для терапии антагонистами CCR5 (см. главу, посвященную резистентности).
Хорошая новость: заболеваемость и смертность могут в значительной мере снизиться даже в том случае, если вирусологический успех не является полным, и вирусная нагрузка не стала неопределяемой (Grabar 2000, Deeks 2002). У многих пациентов сохраняется относительно длительная иммунологическая стабильность, несмотря на недостаточное подавление репликации вируса. В одном из когортных исследований уровень клеток CD4 не снижался до тех пор, пока вирусная нагрузка не снижалась менее 10 000 копий/мл или как минимум на 1,5 Log от индивидуальной установочной точки (Lederberger 2004).
Тем не менее: Сегодня появление новых лекарственных средств и классов препаратов более возможно, чем несколько лет назад. У лиц, ранее получавших интенсивную терапию, следует прилагать особые усилия, чтобы снизить вирусную нагрузку ниже порога количественного определения.
168 Антиретровирусная терапия (АРТ)
Как долго сохраняется вирусологический успех лечения?
О продолжительности действия АРТ известно достаточно мало. Упорно сохраняются слухи о том, что каждый препарат действует лишь в течение нескольких лет. Они берут свое начало с тех лет, когда «ВААРТ» только появилась. Тогда многие пациенты еще получали неадекватное лечение, включавшее в себя один или два препарата, в связи с чем создавались обширные условия для развития резистентности. У этих пациентов длительность сохранения эффекта АРТ часто действительно ограничена, поскольку для того, чтобы комбинация препаратов перестала работать, часто хватает одной точечной мутации. У наивных пациентов без существующих мутаций, получающих терапию сегодня, риск неудачи в лечении в значительной мере снизился.
С учетом того, что мы оцениваем приблизительно 15-летний период применения «ВААРТ», удивителен тот факт, что многие пациенты по истечении столь длительного времени сохраняют неопределяемый уровень вирусной нагрузки. Это относится, прежде всего, к тем пациентам, которые с самого начала получали адекватную по сегодняшним меркам терапию (трехкомпонентная терапия с самого начала и/или непрерывная замена одного препарата другим). В одном из немногих исследований по длительному наблюдению приняли участие 336 наивных пациентов, которые в течение 24 недель терапии достигли вирусной нагрузки ниже 50 копий/мл (Phillips 2001). Установлено, что через 3,3 года риск вирусологического рецидива составил 25,3 %, таким образом, он был относительно высоким уже при первом скачке вирусной нагрузки. Тем не менее, в ходе уточняющего анализа было установлено, что большинство пациентов с вирусологическим рецидивом в течение этого времени прекратили АРТ. Истинная вирусологическая неудача была зарегистрирована только у 14 пациентов, что соответствует риску 5,2 % через 3,3 года. Скажем даже больше: риск вирусологической неудачи в значительной мере снижался с течением времени. Это также подтверждается результатами когортных исследований, которые свидетельствуют о том, что в последние годы частота вирусологической неудачи, обусловленной резистентностью, не повысилась, а наоборот резко снизилась (Lampe 2006, Lohse 2006). Качество антиретровирусной терапии продолжает повышаться, а также возрастает уровень знаний врачей. Если в 1996 году только у 58 % пациентов достигалась вирусная нагрузка менее 500 копий/мл, то в 2003 году данный показатель составил уже 83 % (May 2006). Большинство пациентов сегодня имеют стойкую вирусную нагрузку менее 50 копий/мл. Во многих медицинских центрах на современном этапе как минимум 90 % пациентов, получающих АРТ, имеют вирусную нагрузку ниже порога количественного определения. Примером может послужить когорта Bonner. В 2007 году определяемый уровень виремии на фоне АРТ наблюдался только у 57 из 560 пациентов (10 %). У 32 из них основной причиной являлась низкая приверженность лечению, и лишь у 9 пациентов было выявлено носительство мультирезистентных штаммов вирусов (Klein 2009).
Эти данные и опыт однозначно свидетельствуют о том, что у многих пациентов вирусная нагрузка может оставаться неопределяемой в течение нескольких десятков лет – это верно для всех случаев, когда терапия не прерывалась. Развитие резистентности не является неизбежным.
Скачок вирусной нагрузки – признак вирусологической неудачи?
Под скачками вирусной нагрузки понимают временный подъем вирусной нагрузки, практически всегда в низких диапазонах, если до и после этого подъема вирусная нагрузка оставалась на уровне ниже порога количественного определения (50 копий/мл). Чтобы идентифицировать скачок вирусной нагрузки, необходимо как минимум три измерения данного показателя. Скачки вирусной нагрузки являются частым феноменом на фоне АРТ: они наблюдаются в 20-40 % случаев (Sungkanuparph 2005). Часто скачки вирусной нагрузки настораживают как ВИЧ-инфицированного пациента, так и лечащего врача. Возникает вопрос: свидетельствует ли это о неудаче в лечении?
6.4. Цели лечения 169
Хотя результаты исследований свидетельствуют о том, что скачки вирусной нагрузки проходят без среднесрочных последствий (Havlir 2001, Mira 2002, Sungkanuparph 2005), о причинах данного явления известно мало. Остается неясным, имеет ли оно связь с нарушением комплаентности. В некоторых исследованиях зависимости между комплаентностью и частотой скачков вирусной нагрузки выявлено не было (Di Mascio 2003, Miller 2004), в других исследованиях, напротив, – она была выраженной (Podsadecki 2007). Возможно, в развитии скачка вирусной нагрузки играют роль иммунологические механизмы. Чем раньше пациент обратился за лечением по поводу ВИЧ-инфекции, тем выше будет уровень клеток CD4 на момент начала лечения, и тем реже будут возникать скачки вирусной нагрузки (Di Mascio 2003+2004, Sungkanuparph 2005). Связь с применением определенных комбинаций антиретровирусных препаратов, по-видимому, отсутствует: в одном из крупных когортных исследований (Sungkanuparph 2005) частота скачков вирусной нагрузки на фоне приема ННИОТ составила 34 %, на фоне приема ИП – 33 %, амплитуда скачков при этом была сравнимой (медиана 140 и 144 копий/мл соответственно). В обоих группах риск вирусологической неудачи после 2 лет лечения составил около 8 %. Важным открытием стало то, что наличие скачков на фоне приема ННИОТ не сопровождалось повышением риска, хотя теоретически это могло бы быть опасным ввиду быстрого развития резистентности. Между тем, полученные результаты были подтверждены (Martinez 2005).
Но что же собственно означают скачки вирусной нагрузки? В начале 2005 года попытку точно выяснить данный вопрос предприняла рабочая группа Bob Siliciano. Это было дорогостоящее исследование, в котором приняли участие 10 добросовестных пациентов, сохраняющих вирусную нагрузку ниже 50 копий/мл на протяжении как минимум 6 месяцев. На протяжении 3-4 месяцев каждые 2-3 дня (чем больше искать, тем скорее найдешь!) у пациентов проводился забор крови (Nettles 2005). У 9 из 10 пациентов за период наблюдения был зарегистрирован как минимум один случай временного повышения вирусной нагрузки более 50 копий/мл. Тем не менее, скачки вирусной нагрузки характеризовались средней интенсивностью, которая варьировала в пределах от 51 до 201 копий/мл, медиана составила 79 копий/мл. Подобные скачки не сопровождались ни изменениями клинической картины, ни снижением плазменной концентрации препаратов или развитием резистентности. Это позволило авторам сделать вывод о том, что скачки вирусной нагрузки (до низких, но определяемых значений) носят, прежде всего, биологический и статистический характер и не имеют никакой связи с неудачей в лечении. При равновесной амплитуде около 20 копий/мл полученные показатели соответствовали случайному распределению. Тем не менее, 96 % случайно распределенных значений были ниже 200 копий/мл, в связи с чем следовало бы беспокоиться только о более высоких скачках вирусной нагрузки. Также потенциальную роль могли сыграть погрешности при анализе проб, которые слишком долго оставались необработанными (пробы должны быстро центрифугироваться, иначе полученные значения будут повышенными) (Portman 2012).
Наконец, нужно обратить внимание и на другие факторы, которые могут обусловливать интермиттирующую виремию. К примеру, сопутствующие инфекции индуцируют иммунную активацию, которая повышает риск скачков вирусной нагрузки, обусловленных всего лишь высвобождением вирусов из резервуаров латентной инфекции (Jones 2007). В одном из крупных ретроспективных анализов было установлено, что интеркуррентная инфекция является причиной 26 % случаев транзиторной виремии (Easterbrook 2002). Так четкое повышение вирусной нагрузки и снижение количества CD4 может наблюдаться при сифилисе (Buchacz 2004). Кроме того, вирусная нагрузка может временно повышаться при вакцинации (Kolber 2002).
Вывод: По современным оценкам, не следует проводить коррекцию АРТ даже при повторных скачках вирусной нагрузки. Однако при высоких скачках (> 200-500 копий/мл) необходимо соблюдать осторожность. Скачки следует отличать от повторно определяемой плазменной виремии низкой степени, при которой повышается риск развития резистентности (Gunthard 1998, Nettles 2004, Taiwo 2011), поэтому любые скачки вирусной нагрузки должны
170 Антиретровирусная терапия (АРТ)
стать поводом для очередной беседы о комплаентности с пациентом. Никогда не будет ошибкой повторно обсудить существующий план лечения. Принимает ли пациент препараты регулярно, или в отдельных случаях схема терапии нарушается? В достаточной ли мере пациент обращает внимание на обстоятельства приема препаратов (натощак или во время еды)? Все это следует обдумать до коррекции терапии. Каждая новая схема терапии может привести к новым проблемам. Таким образом, каждое предполагаемое повышение вирусной нагрузки должно подвергаться краткосрочному контролю до коррекции терапии.
Иммунологический успех и иммунологическая неудача в лечении
Под иммунологическим успехом в лечении понимают увеличение количества клеток CD4, тем не менее, более четкого критерия не существует. В зависимости от типа исследования, как иммунологический успех расценивался подъем уровня CD4 на 50, 100 или 200 клеток/мкл или выше 200 или 500 клеток/мкл. Неудачей считается отсутствие подъема или снижение уровня клеток CD4. Индивидуально прогнозировать иммунологический успех на фоне АРТ достаточно сложно. Он может в значительной мере варьировать. Как и снижение вирусной нагрузки, повышение уровня клеток CD4 является двухфазным. После первичного, часто быстрого подъема в первые 3-4 месяца его скорость заметно замедляется. В одном из проспективных исследований, в котором приняли участие почти 1000 пациентов, наблюдалось повышение уровня клеток CD4 в течение первых 3 месяцев, медиана ежемесячного подъема составила 21,2 клеток CD4/мкл, в последующие месяцы она составила только 5,5 клеток CD4/мкл (Le Moing 2002). В течение первого года исследования EuroSIDA подъем составил 100 клеток CD4/мкл, в последующем – лишь около 50/мкл/год
(Mocroft 2007).
Вопрос о том, происходит ли при длительном подавлении репликации вируса непрерывное восстановление иммунной системы, или через 3-7 лет достигается фаза плато, является спорным и активно обсуждается (Smith 2004, Mocroft 2007, Lok 2010). Согласно нашему опыту, может наблюдаться и то, и другое: есть пациенты, у которых количество клеток CD4 и через 5-6 лет продолжает медленно возрастать, есть пациенты, у которых количество клеток CD4 останавливается на определенном уровне уже после относительно короткого времени. На индивидуальном уровне иммунологический успех непредсказуем, но чем ниже количество клеток CD4, тем менее вероятна нормализация (Kaufmann 2005, Robbins 2009). Часто полного восстановления иммунной системы не наблюдается: в швейцарской когорте, состоящей из 2235 пациентов, начавших АРТ в 1996-97 году, только у 39 % пациентов наблюдался подъем уровня CD4 выше 500 клеток/мкл (Kaufmann 2003). Повышение, наблюдаемое в течение первых месяцев, потенциально свидетельствует о том, насколько хорошим будет дальнейшее восстановление иммунной системы (Kaufmann 2005). Отрицательное влияние позднего начала АРТ часто остается заметным в течение длительного времени. Так приблизительно 25 % пациентов, начавших АРТ на низких значениях CD4, через 7-10 лет не достигают нормализации уровня клеток CD4 (500 клеток/мкл), даже несмотря на выраженное подавление репликации вируса (Kelley 2009, Lok 2010). Иммунологический успех не имеет непосредственной привязки к максимальному подавлению репликации вируса. Даже при ее частичном подавлении возможно восстановление уровня клеток CD4 (Kaufmann 1998, Ledergerber 2004). Также не важен уровень вирусной нагрузки: по-видимому, решающее значение имеет то, что она должна быть ниже, чем до терапии (Deeks 2002, Ledergerber 2004). Учитывая большое количество факторов, которые могут оказывать влияние на способность иммунной системы к восстановлению (см. ниже), чаще всего бывает нецелесообразным считать уровень клеток CD4 решающим критерием успеха в лечении. Для этого лучше подходит вирусологический успех. Если нормализация уровня клеток CD4 произошла однократно, то его последующее значительное падение наблюдается редко (до тех пор, пока сохраняется неопределяемая вирусная нагрузка) (Phillips 2002). Согласно результатам нового исследования, вероятность сохранения количества CD4 выше релевантной границы (200/мкл) у пациентов, однократно
6.4. Цели лечения 171
достигших уровня 300/мкл и имеющих вирусную нагрузку ниже 200 копий/мл, составляет более 99% в течение 4 лет (Gale 2013). При хорошем иммунном статусе необходимость в постоянном контроле иммунологического успеха в лечении отсутствует.
Дискордантный ответ на лечение
Дискордантный ответ на лечение – это ситуация, при которой не была достигнута одна из целей лечения: или иммунологический, или вирусологический ответ (Таблица 4.1). Так, к примеру, терапия может быть успешной в вирусологическом отношении при отсутствии признаков иммунологического успеха: несмотря на отсутствие определяемой вирусной нагрузки устойчивого повышения количества клеток CD4 не наблюдается (Piketty 1998, Grabar 2000, Moore 2005, Tan 2007). И наоборот – АРТ может приводить к выраженному подъему количества клеток CD4, несмотря на сохранение определяемой вирусной нагрузки. Даже с учетом постоянного совершенствования терапии, дискордантный вирусологический ответ сегодня наблюдается приблизительно у одной четверти всех наивных пациентов. Проблема неясности дальнейшей тактики лечения возникает, прежде всего, в группе пациентов, достигших вирусологического успеха при иммунологической неудаче.
По-видимому, для этих пациентов характерно повышение смертности, что, однако, не обусловлено СПИД-ассоциированными заболеваниями (Gilson 2010). Если повышение риска развития СПИДа вообще возникает, то только в течение первых 6 месяцев (Zoufaly 2011). Иллюстрация, представленная на следующей странице, отражает различные виды динамики уровня клеток CD4 с течением времени.
Различные факторы риска недостаточного иммунологического ответа чаще всего не оказывают четкого влияния, поскольку являются гетерогенными (обзор: Aiuti 2006). Низкий уровень клеток CD4 и низкая вирусная нагрузка до начала лечения – это лишь два фактора
(Florence 2003, Kaufmann 2005, Moore 2005, Kelley 2009).
Таблица 4.1: Терапевтический успех в когортных исследованиях
Успех АРТ |
Grabar |
Moore |
Tan |
|
2000 |
2005 |
2008 |
|
n = 2236 |
n = 1527 |
n = 404 |
|
|||
Вирусологический и иммунологический успех |
48 % |
56 % |
71 % |
|
|
|
|
|
|
|
|
Дискордантный ответ: только иммунологический успех |
19 % |
12 % |
16 % |
Дискордантный ответ: только вирусологический успех |
17 % |
15 % |
9 % |
Отсутствие успеха в лечении |
16 % |
|
|
17 % |
5 % |
||
|
|
|
|
Определение иммунологического успеха: повышение уровня клеток CD4 > 50/мкл через 6 месяцев (Grabar 2000) или как минимум однократно в течение периода наблюдения (Moore 2005, Tan 2007).
Определение вирусологического успеха: вирусная нагрузка < 1000 (Grabar 2000) или < 500 (Moore 2005) или < 50 копий/мл (Tan 2008)
Также играет роль возраст пациента: у пожилых пациентов частота иммунологического успеха часто является средней. С возрастом снижается способность иммунной системы к восстановлению, что, вероятно, обусловлено дегенерацией тимуса (Lederman 2000, Grabar 2004). В тимусе тимоциты (пре-T-лимфоциты) превращаются в T-лимфоциты. Таким образом, тимус является органом первичного развития Т-лимфоцитов, который с возрастом подвергается инволюции. Результаты нескольких исследований свидетельствуют о том, что отсутствие иммунологического успеха наблюдается тем чаще, чем старше пациент и чем меньше размеры тимуса на КТ (Goetz 2001, Piketty 2001, Teixeira 2001). По-видимому, Т-лимфоциты-супрессоры также играют роль (Saison 2014).
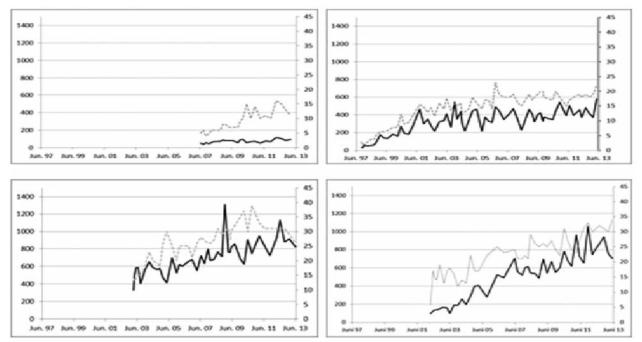
172 Антиретровирусная терапия (АРТ)
Рисунок 1: Динамика уровня клеток CD4 у 4 пациентов. Темная линия соответствует абсолютному уровню клеток CD4/мкл (первичная система осей координат слева), серая линия соответствует относительному количеству клеток CD4 в % (вторичная система осей координат справа). Слева вверху – плохое восстановление иммунитета при изначальном нарушении иммунного статуса. Справа вверху – умеренное восстановление иммунитета с образованием плато при изначально резко выраженном нарушении иммунного статуса. Внизу – два пациента, у которых наблюдалось резко выраженное восстановление иммунитета, справа – несмотря на резкое снижение уровня клеток CD4 на начальном этапе.
Другими причинами могут быть сопутствующая иммунотерапия или миелосупрессивная химиотерапия. Мы видели пациентов, у которых на протяжении нескольких лет сохранялся уровень CD4 ниже 50 клеток/мкл, несмотря на подавление вирусной нагрузки. Значительное восстановление иммунитета наблюдалось только тогда, когда у врача хватало мужества прекратить профилактический прием ганцикловира или ко-тримоксазола. Отрицательное влияние на иммунологический успех могут также оказать аутоиммунные заболевания (болезнь Крона, системная красная волчанка) или цирроз печени. Кроме того, существуют данные о неблагоприятном влиянии определенных антиретровирусных препаратов. Так у пациентов, переключенных на TDF+DDI (плюс невирапин), наблюдалось значительное снижение уровня клеток CD4 (Negredo 2004), что, вероятно, обусловлено неблагоприятными взаимодействиями между DDI и тенофовиром. В двух других исследованиях наблюдалось значительное повышение уровня клеток CD4 на фоне приема ABC+3TC или TDF+FTC, по сравнению с AZT+3TC, несмотря на сравнимую частоту вирусологического успеха (De Jesus 2004, Pozniak 2006). В швейцарской когорте у пациентов, получающих AZT-содержащую терапию, после 2 лет лечения подъем уровня CD4 был приблизительно на 60 клеток/мкл больше, чем у пациентов, не получающих AZT (Huttner 2007). Вопрос о переключении пациентов с плохим иммунологическим успехом на схему терапии, не содержащую AZT, является спорным. Между ННИОТ и ИП каких-либо различий в отношении восстановления иммунитета выявлено не было: замена препарата не вызывала эффекта (Torti 2011).
А как насчет новых классов лекарственных средств? Получение результатов метаанализа, свидетельствующих о том, что повышение уровня CD4 на фоне приема маравирока, в целом, более выражено, чем на фоне приема других лекарственных средств (Wilkin 2008), стало поводом к проведению различных исследований по изучению дополнительного приема маравирока у пациентов с плохим восстановлением иммунитета. Результаты были неутешительными (Lanzafame 2009, Stepanyuk 2009, Wilkin 2010, Vitiello 2012, Hunt 2013):
