
- •Контроль качества ионообменников для водоподготовки
- •Введение
- •1. Подготовка ионитов к работе
- •1.1. Отбор проб и фракционирование ионитов
- •Гранулометрический состав ионита
- •1.2. Кондиционирование, очистка и получение различных ионных форм ионитов
- •2. Химическая устойчивость ионообменников
- •2.1. Определение химической устойчивости ионитов
- •Порядок выполнения работы
- •2.2. Определение содержания стирола при кондиционировании ионитов
- •Порядок выполнения работы
- •2.3. Определение содержания формальдегида в промывных водах
- •Порядок выполнения работы
- •2.4. Определение содержания этилендиамина (эда) в промывных водах
- •Порядок выполнения работы
- •Определение физико-химических свойств ионитов
- •3.1. Определение влагоемкости ионитов
- •3.2. Определение обменной емкости сильно- и слабокислотных катионитов
- •3.3. Определение обменной емкости сильно- и слабоосновных анионитов
- •Определение полной обменной емкости в динамических условиях
- •Порядок выполнения работы
- •3.5. Определение констант ионизации ионитов
- •3.7. Изучение набухания ионитов микроскопическим методом
- •3.8. Определение набухаемости ионообменников
- •Порядок выполнения работы
- •3.9. Определение прочности гранул сорбентов
- •Порядок выполнения работы
- •Практическая работа № 16
- •3.10. Изучение влияния гидроксида натрия на изменение характера функциональных групп анионообменников
- •3.11. Определение рабочей обменной емкости анионита
- •4. Условия хранения ионитов
- •Контроль качества ионообменников для водоподготовки
Порядок выполнения работы
Набухший ионит в виде водной суспензии помещают в мерный цилиндр на 10 мл и уплотняют слой постукиванием дна цилиндра о твердую поверхность до прекращения усадки. Доведя объем загрузки до метки, ионит переносят в ионообменную колонку, не допуская образования воздушных пузырей. Если все же они появились, необходимо вытеснить их противоточной подачей дистиллированной воды.
Отобрать ионит для определения обменной емкости в динамических условиях можно и другим методом. Необходимо на аналитических весах взять навеску воздушно-сухого образца (3-5 г), залить водой, затем перенести набухшие гранулы в колонку. Несколько навесок по 0,2-0,3 г следует взять в предварительно доведенные до постоянной массы бюксы и поместить их в сушильный шкаф для высушивания до абсолютно сухого состояния.
Через слой ионита в колонке пропускают раствор хлорида натрия с удельной нагрузкой 5 л/л.ч - количество объемов жидкости, попускаемой через единицу объема ионита за 1 ч. Первые 5 мл фильтрата сбрасывают, так как это вода, находившаяся между гранулами ионита в колонке. Затем вытекающий раствор собирают в колбу объемом 500 мл. После того, как раствор достигнет метки на колбе, содержимое перемешивают и отбирают аликвоты объемом 10-20 мл в колбы объемом 50-100 мл.
При определении полной динамической обменной емкости катионита в колонке происходит обмен ионов по реакции: R-H + NaCI R-Na + HCI, поэтому отобранная для анализа проба содержит кислоту. Ее содержание определяют титрованием раствором 0,1 моль/л раствором NaOH с индикатором метилоранжем до перехода розовой окраски раствора в желтую.
В случае определения полной динамической обменной емкости анионита в колонке происходит обмен по реакции:
R-OH + NaCI R-CI + NaOH
с образованием щелочи. С целью нахождения количества сорбированных хлорид-ионов анионитом определяют содержание в фильтрате выделившейся при этом щелочи. Для чего титруют аликвоту щелочного фильтрата раствором 0,1 моль/л НС1 в присутствии метилоранжа до перехода соломенно-желтой окраски раствора в розовую.
Полную обменную емкость ионитов рассчитывают по уравнению:
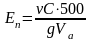
где - объем титранта, пошедший на титрование; С- его концентрация; Va - объем аликвоты; g - абсолютно сухая масса ионита, г.
Практическая работа № 11
3.5. Определение констант ионизации ионитов
Цель работы – определение кислотно-основной функции ионитов.
Оборудование и реактивы:
1. рН-метр со стеклянным и хлорсеребрянным электродами.
2. Катионит КУ-2-8 в Н-форме.
3. Конические колбы по 100 мл (20 штук).
4. Бюретки.
5. Раствор 0,1 моль/л NaCl.
6. Раствор 0,1 моль/л NaOН.
Порядок выполнения работы
В сухие колбы вносят навески сухого ионита по 0,5 0,0002 г и к ним из бюреток приливают растворы 0,1 моль/л гидроксида и хлорида натрия в различных пропорциях (Vобщ = 50 мл). Плотно закрытые колбы встряхивают до установления равновесия (24 ч для сильнокислотного катионита и не менее 5 суток для слабокислотного). Растворы осторожно отделяют от ионита и измеряют рН. В растворах с рН менее 2 или более 12 единиц концентрация Н+- или ОН-- ионов определяется кислотно-основным титрованием. Затем строятся графики зависимости рН равновесного раствора от количества добавленной щелочи и рН от величины использованной емкости, т.е. рН=f(VNaOH) и pH =f() или pH=f[lg 1/(1-)].
Практическая работа 12
3.6. Перевод катионита из Са2+ - формы в Н+- форму
Цель работы - регенерация катионообменника раствором кислоты.
Оборудование и реактивы:
1. Ионообменная колонка.
2. Катионит КУ-2-8 в Са2+ - форме.
3. Раствор 1 моль/л НС1.
4. Колбы объемом 200 мл.
5. Раствор 0,05 моль/л ЭДТА.
Порядок проведения работы
В данной работе для регенерации используется катионит КУ-2-8, переведенный в Са2+- форму. Навеску катионита помешают в ионообменную колонку. Через слой ионита пропускают 1 моль/л раствор НС1 со скоростью 1 мл/мин до полного вытеснения Са2+-ионов из фазы ионита в раствор. Контроль за содержанием Са2+ в регенеранте и промывных водах ведут с помощью комплексоно-метрического титрования аликвоты раствора трилоном Б (в аммиачном буферном растворе) в присутствии индикатора хромогена черного. При наличии ионов кальция раствор винно-красного цвета, в его отсутствие - синего.
Практическая работа № 13
