
- •Методические указания
- •Содержание
- •Классификация неорганических соединении
- •Общие сведения
- •Основания
- •Кислоты
- •Амфотерные гидроксиды
- •Задания задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Задание 6
- •Задание 7
- •3. Каковы общие способы получения солей?
- •Задание 8
- •Задание 9
- •Задание 10
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
- •Задание 15
- •Задание 16
- •Задание 17
- •Задание 18
- •Задание 19
- •Задание 20
- •Библиографический список
- •394026 Воронеж, Московский просп.,14
- •Методические указания
Амфотерные гидроксиды
Амфотерными называют такие гидроксиды, которые в зависимости от условий проявляют и основные, и кислотные свойства. При диссоциации амфотерные гидроксиды образуют как катионы водорода Н+, так и гидроксид-ионы ОН-. Примером могут служить Zn(OH)2, A1(OH)3, Сr(ОН)3, Ве(ОН)2, Ge(OH)2, Sn(OH)2, Pb(OH)2 и др.
В зависимости от кислотности или щелочности раствора, действующего на амфотерный гидроксид возможен разрыв связи в молекуле гидроксида либо между металлом и кислородом (а), либо между водородом и кислородом(б):

В случае (а) амфотерный гидроксид проявляет свойства основания, в случае (б) - свойства кислоты. Амфотерные гидроксиды взаимодействуют как с кислотами, так и со щелочами, что вытекает из приведенного выше характера диссоциации молекулы:
Zn(OH)2 + НС1 = ZnCl2 + 2Н2О,
H2ZnO2 + 2NaOH = Na2[Zn(OH)4].
СОЛИ
Соли представляют собой продукт замещения ионов водорода в кислоте катионами металла (сюда же относятся и катионы аммония NH4+) или продукт замещения гидроксильных групп основания анионами кислотных остатков. При полном замещении получаются средние (нормальные) соли. При неполном замещении водорода кислоты на металл получается кислая соль. При неполном замещении гидроксогруппы основания на кислотный остаток получается основная соль. Ясно, что кислая соль может быть образована только кислотой, основность которой равна двум или больше, а основная соль - металлом, валентность которого равна двум или больше. Любую соль можно представить как продукт взаимодействия основания и кислоты:
H2SO4 + 2NaOH = Na2SO4 + 2Н2О.
Na2SO4 - сульфат натрия - средняя соль - продукт полного замещения ионов водорода в кислоте ионами натрия.
H2SO4 + NaOH = NaHSO4 + Н2О.
NaHSO4 - гидросульфат натрия - кислая соль - продукт неполного замещения водорода в кислоте на металл.
Сu(ОН)2 + 2НС1 = СuС12 + 2Н2О.
СuС12 - хлорид меди(II) - средняя соль - продукт полного замещения гидроксильных групп кислотными остатками.
(CuOH)Cl - хлорид гидроксомеди - основная соль - продукт неполного замещения ОН-групп на кислотные остатки.
С точки зрения теории электролитической диссоциации соли - вещества, при диссоциации которых образуются катионы металла (или NH4+) и анионы кислотных остатков:
Na2SO4 = 2Na+ + SO42-,
NaHSO4 = Na+ + HSO4-,
CuCl2 = Cu2+ + 2Cl-,
(CuOH)Cl = (CuOH)+ + Cl-.
Соли, образованные двумя металлами и одной кислотой, называются двойными солями. Например, KA1(SO4)2, KCr(SO4)2. Двойные соля диссоциируют на те ионы, из которых они состоят:
KAI(SO4)2 = К+ + А13++ 2SO42-.
Соли, образованные одним металлом и двумя кислотами, называются смешанными солями. Смешанной солью является СаС1ОС1(или CaOCl2) - кальциевая соль соляной (НС1) и хлорноватистой (НС1) кислот.
Пример диссоциации смешанной соли:
CaClOCl = Са2+ + СlO- + Сl-.
В состав комплексных солей входят сложные (комплексные) ионы. При написании формул такой соли комплексный ион заключается в квадратные скобки. Примеры диссоциации комплексных солей:
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-,
[Ag(NH3)2]Cl = [Ag(NH3)2]++ Сl-.
Номенклатура солей
В соответствии с международной номенклатурой название соли отражает название металла и латинское название кислотного остатка. Название соли состоит из двух слов: названия аниона в именительном падеже и катиона в родительном. Число анионов и катионов, как правило, в названии соли не указывается. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой после названия соли.
Латинское название кислоты и кислотного остатка происходит обычно от латинского названия элемента, образующего кислоту. При этом название соли бескислородной кислоты имеет окончание "ид", кислородосодержащей кислоты - "ат" в случае максимальной валентности кислотообразующего элемента и "ит" в случае более низкой его валентности. Так, соли соляной кислоты НС1 называются хлоридами, сероводородной H2S - сульфидами, серной H2SO4 - сульфатами, сернистой H2SO3 - сульфитами.
Названия кислых солей имеют приставку "гидро", указывающую на наличие незамещенных атомов водорода; если таких незамещенных атомов два или больше, то их число обозначается греческими числительными (ди-, три- и т.д.). Так, Na2HPO4 - гидрофосфат натрия, NaH2PO4 - дигидрофосфат натрия. Аналогично основная соль характеризуется приставкой "гидроксо" указывающей на наличие незамещенных гидроксильных групп. Например, FeOHCl2 – хлорид гидроксожелеза, Fe(OH)2Cl - хлорид дигидроксожелеза. В некоторых случаях образование основной соли сопровождается отщеплением воды, например:
Bi(OH)2Cl = BiOCl + H2O.
Образующиеся при этом соли (оксосоли) не содержат гидроксогруппы, но сохраняют свойства основных солей, в частности, способность взаимодействовать с кислотами с образованием средних солей:
BiOCl+2HCl=BiCl3 + H2O.
Названия важнейших кислот и их солей
Кислота
|
Название |
|
кислоты |
соли |
|
1 |
2 |
3 |
НА1О2 |
Метаалюм иниевая |
Метаалюминат |
HAsO3 |
Метамышьяковая |
Метаарсенат |
H3AsO4 |
Ортомышьяковая |
Ортоарсенат |
НВО2 |
Метаборная |
Метаборат |
Н3ВО3 |
Ортоборная |
Ортоборат |
Н2В4О7 |
Тетраборная |
Тетраборат |
НВr |
Бромводород |
Бромид |
СНзСООН |
Уксусная |
Ацетат |
HCN |
Циановодород |
Цианид |
Н2СО3 |
Угольная |
Карбонат |
НС1О |
Хлорноватистая |
Гипохлорит |
Продолжение таблицы |
||
НС1О2 |
Хлористая |
Хлорит |
НС1О3 |
Хлорноватая |
Хлорат |
НС1О4 |
Хлорная |
Перхлорат |
Н2СrO4 |
Хромовая |
Хромат |
Н2Сr2O7 |
Двухромовая |
Дихромат(бихромат) |
HI |
Иододводородная |
Иодид |
НМnО4 |
Марганцовая |
Перманганат |
Н2МnО4 |
Марганцовистая |
Манганат |
HNO2 |
Азотистая |
Нитрит |
HNO3 |
Азотная |
Нитрат |
НРОз |
Метафосфорная |
Метафосфат |
Н3РО4 |
Ортофосфорная |
Ортофосфат (фосфат) |
Н2Р2О7 |
Двуфосфоная(пирофосфорная) |
Дифоcфат(пирофосфат) |
H2S |
Сероводородная |
Сульфид |
H2SiO3 |
Кремниевая |
Силикат |
HVO3 |
Ванадиевая |
Ванадат |
H2WO4 |
Вольфрамовая |
Вольфрамат |
Названия кислородосодержащих катионов, входящих в состав оксосолей (BiO+, SbO+, UO2+ и т.д), образуются от корня латинского названия элемента с добавлением окончания «ил»: ВIO+- висмутил, SbO+-стибил (антимонил), UO2+- уранил. В соответствие с этим BiOCl называют "хлорид висмутила", UO2(NO3)2 - «нитрат уранила» и т.д. Русские названия средних солей кислородных кислот составляются из названия кислоты с окончанием "кислый" и названия металла. Например, Na2SO4 - сернокислый натрий, К3РО4 - фосфорнокислый калий. Если металл имеет переменную валентность, то для солей металла с высшей валентностью прибавляется слово "окисная", а для солей металлов с низшей валентностью - слово "закисная". Например, Fe2(SO4)3 -сернокислое железо окисное, FeSO4 - сернокислое железо закисное.
Названия средних солей бескислородных кислот составляются из названия неметалла, образующего кислоту, с окончанием «истый» и названия металла. Так, KI - йодистый калий, MgCl2 - хлористый магний, CaS -сернистый кальций. Соли металлов с переменной валентностью различают по окончанию прилагательного. Например, FeCl3 - хлорное железо, FeCl2 -хлористое железо.
Кислые и основные соли называются, как и средние, с добавлением слова "кислый" о случае кислой соли и слова "основной" в случае основной соли. Так, KHSO3 - кислый сернокислый калий, A1OHSO4 - основной сернокислый алюминий. Кислотный остаток Н2РО4" называется однозамещенный кислый фосфорнокислый; НРО42" - двузамещенный кислый фосфорнокислый; Na2HPO4 - двузамещенный кислый фосфорнокислый натрий, NaH2PO4 - однозамещенный кислый фосфорнокислый натрий.
Графические формулы солей
Для графического изображения формул солей исходят из соответствующих формул кислот, заменяя в них атомы водорода на атомы металла с соблюдением правила валентности: один атом водорода заменяется одновалентным металлом, два - двухвалентным и т.д. Например, графическое изображение молекулы Са3(РО4)2 можно представить:
Н
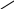

 — О
О
— О
О
 Са
Са
Н — О Р = О О Р = О
Н — О О
фосфорная кислота Са
О
О Р = О
Са
О
Кислые соли фосфорной кислоты NaH2PO4 и Na2HPO4:
N a — О Na — О
Н — О Р = О Na — О Р = О
Н — О Н — О
Основная соль будет иметь вид FeOHCO3:
 O
— H
O
— H


 Fe
O
Fe
O
 C
= O
C
= O
O
Получение солей
Соли образуются при взаимодействии простых веществ и представителей всех классов неорганических соединений. Для получения каждой соли выбирают тот способ, который экономически более выгоден, учитывая наиболее дешевые источники сырья. Ниже приводятся примеры получения солей различными способами, хотя следует иметь в виду, что не любую соль можно получить с их помощью. Наиболее общие способы получения солей:
1. При взаимодействии металлов с неметаллами:
2Fe + 3С12 = 2FeCl3.
2. При взаимодействии металлов с кислотами:
Zn + H2SO4 = ZnSO4 + Н2.
3. При взаимодействии металлов с растворами солей:
Fe + CuSO4 = FeSO4 + Сu.
(Необходимо пользоваться рядом напряжений металлов для правильного выбора реагентов).
4. При взаимодействии основных и кислотных оксидов:
3СаО + Р2О5 = Са3(РО4)2
5. При взаимодействии основных оксидов с щелочами:
CuO + H2SO4 = CuSO4 + Н2О.
6. При взаимодействии кислотных оксидов с основаниями:
SO3 + Са(ОН)2 = CaSO4 + Н2О.
7. При взаимодействии оснований с кислотами:
Ва(ОН)2 + 2НС1 = ВаС12 + 2Н2О.
8. При взаимодействии щелочей с солями:
3КОН + FeCl3 = Fe(OH)3↓ + 3КС1.
9. При взаимодействии кислот с солями:
H2SO4 + BaCl2 = BaSO4↓ +2HC1.
10. При взаимодействии солей с солями:
Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2NaNO3.
11. При взаимодействии аммиака с кислотами:
NH3 + HC1=NH4C1,
2NH3 + H2SO4 = (NH4)2SO4,
3NH3 + H3PO4 = (NH4)3PO4.
Существуют и другие способы получения солей.
Свойства солей
Соли являются твердыми кристаллическими веществами.
По растворимости в воде их можно разделить на растворимые, малорастворимые и практически нерастворимые.
Все соли азотной и уксусной кислот хорошо растворимы в воде.
Растворимы в воде соли соляной кислоты, кроме AgCl, Hg2Cl2, РЬС12 (последняя соль малорастворима).
Химические свойства солей обусловлены их отношением к металлам, щелочам, кислотам и солям:
1. В электрохимическом ряду напряжений каждый, предыдущий металл вытесняет последующие из растворов их солей, например:
Zn + CuSO4 = ZnSO4 + Сu,
2. Соли взаимодействуют со щелочами с образованием нерастворимых в воде оснований:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl,
3. Соли взаимодействуют с кислотами:
CuSO4 + H2S = CuS↓+ H2SO4,
4. Многие соли взаимодействуют между собой:
СаС12 + Na2CO3 = СаСО3↓ + 2NaCl.
Реакции протекают до конца лишь в том случае, если один из образующихся продуктов уходит из сферы реакции, т.е. выпадает в виде осадка, выделяется в виде газа или представляет собой малодислоцированное соединение.
Если же продукты реакции, так же как и исходные вещества, хорошо растворимы в воде, то такие реакции обратимы.
5.Термическое разложение солей:
а) карбонаты при нагревании разлагаются на оксид металла и углекислый газ:
СаСОз = СаО + СО2,
б) сульфаты разлагаются при высокой температуре на оксид металла и триоксид серы:
Fe2(SO4)3 = Fe2O3 + 3SO3,
в) соли азотной кислоты при нагревании разлагаются, причем продукты разложения могут быть разными, в зависимости от положения металла, образующего соль, в электрохимическом ряду напряжений. Если металл стоит в ряду напряжений левее магния, то нитрат этого металла разлагается на нитрит и кислород. Например:
2NaNO3 = 2NaNO2 + О2,
Нитраты металлов от магния по медь включительно при нагревании разлагаются на оксид металла, диоксид азота и кислород:
2Cu(NO3)2 = 2CuO + 4NO2 + О2.
Если металл в ряде напряжений стоит правее меди, то его нитрат разлагается на свободный металл, диоксид азота и кислород. Например:
Hg(NO3)2 = Hg + 2NO2 + О2.
