
- •Введение
- •I. Учение о составе
- •1.1. Основные понятия и законы химии.
- •Некоторые определения, понятия и законы химии
- •1.2. Задачи с решениями.
- •1. Вычислите объем, занимаемый аммиаком массой 34 г при 27 0с и 104 кПа. Каково число молекул в данной массе газа?
- •2. При 0оС смешаны 5 л метана (сн4), 10 л водорода и 25 л кислорода. Общее давление смеси равно 760 мм рт. Ст. Вычислить парциальные давления компонентов газовой смеси.
- •3. Вычислить массу 1 л газа при ОоС и давлении 101,3кПа, если плотность этого газа относительно воздуха равна 1,034.
- •1.3. Контрольные задания.
- •2. Учение о химических процессах
- •2.1. Основы химической термодинамики
- •2.2. Задачи с решениями по теме «Основы химической термодинамики»
- •1. Рассчитайте тепловой эффект (Ho298) химической реакции
- •2.3.Контрольные задания по теме «Основы химической термодинамики»
- •Контрольные задания
- •2.4. Термодинамические характеристики некоторых веществ
- •2.5. Основы химической кинетики
- •Основные понятия и законы химической кинетики
- •Прямая реакция
- •2.6. Задачи с решениями по теме «Основы химической кинетики»
- •Как изменится скорость прямой реакции
- •Температурный коэффициент скорости химической реакции равен 2,1. Во сколько раз возрастет скорость этой реакции при увеличении температуры с 15 до 38 оС?
- •В системе
- •В какую сторону сместится равновесие в системе:
- •2.7. Контрольные задания по теме «Основы химической кинетики»
- •Контрольные задания (задача 1)
- •Список рекомендуемой литературы
- •ЗАдания для самостоятельной работы по курсу ксе
- •400131, Г. Волгоград, пр. Им. В. И. Ленина, 28. Корп. 1
2.6. Задачи с решениями по теме «Основы химической кинетики»
Как изменится скорость прямой реакции
2 СО(г) + О2(г)↔ 2СО2(г),
если а) уменьшить реакционный объем в 3 раза;
б) уменьшить давление в 2 раза.
Решение. По закону действующих масс скорость прямой реакции выражается уравнением:
v = k CCO2 CO2
При уменьшении реакционного объема или увеличении давления концентрация реагирующих веществ увеличивается.
При увеличении реакционного объема или уменьшении давления концентрация реагирующих веществ уменьшается.
а) при уменьшении реакционного объема в 3 раза концентрация реагирующих веществ увеличивается в 3 раза. Выражение для скорости прямой реакции:
v2 = k (3CCO )2∙ 3 CO2 = 27 k CCO2 CO2

б) при уменьшении давления в 2 раза концентрация реагирующих веществ уменьшается в 2 раза. Выражение для скорости прямой реакции:
![]() ;
;

Ответ: а) скорость реакции увеличилась в 27 раз;
б) скорость реакции уменьшилась в 8 раз.
Температурный коэффициент скорости химической реакции равен 2,1. Во сколько раз возрастет скорость этой реакции при увеличении температуры с 15 до 38 оС?
Решение. В соответствии с правилом Вант-Гоффа

Ответ: скорость реакции увеличится в 5,5 раза.
В системе
2NО(Г) + О2 ↔ 2NО2
равновесные концентрации веществ: СNO=0,2моль/л; CO2=0,3 моль/л; CNO2=0,4 моль/л. Вычислить константу равновесия и оцените положение равновесия.
Решение: По закону действующих масс выражение константы равновесия реакции:

Ответ: Кр = 13,3, Кр>1, следовательно, в системе преобладают продукты реакции (равновесие смещено вправо).
В какую сторону сместится равновесие в системе:
2 СО(Г) + О2 (Г) ↔ 2 СО2 (Г); ∆Нор-ции=-569 кДж/моль
а) при увеличении давления,
б) при увеличении объема системы,
в) при снижении температуры
Решение:
а) В соответствии с принципом Ле-Шателье при повышении давления равновесие смещается в сторону уменьшения числа молей газообразных веществ, т.е. в приведенной системе в сторону прямой реакции (исходные вещества: 2 моля СО + 1 моль О2= 3 моля; продукты: 2 моля СО2).
б) При увеличении объема системы происходит снижение давление, следовательно, в соответствии с принципом Ле-Шателье равновесие сместится в сторону реакции идущей с увеличением числа молей газов. В данном случае – в сторону обратной реакции.
в) Поскольку H<0, теплота выделяется в ходе прямой реакции, которая является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты (эндотермической), т.е. равновесие сместится в сторону исходных веществ.
2.7. Контрольные задания по теме «Основы химической кинетики»
1. Как изменится скорость приведенной реакции при изменении условий:
Таблица 8
Контрольные задания (задача 1)
№ варианта |
Реакция |
Изменяющиеся условия |
1 |
4NH3(г) + 5O2(г) ↔4NO(г) + 6H2O(г) |
Увеличение давления в 2 раза |
2 |
4NH3(г) + 5O2(г) ↔4NO(г) + 6H2O(г) |
Увеличение концентрации NH3 в 3 раза |
3 |
4NH3(г) + 5O2(г) ↔4NO(г) + 6H2O(г) |
Уменьшение давления в 3 раза |
4 |
4NH3(г) + 5O2(г) ↔4NO(г) + 6H2O(г) |
Увеличение концентрации О2 в 5 раз |
5 |
2H2S (г)+ 3O 2(г)↔2 SO2 (г)+2Н2О(ж) |
Увеличение давления в 3 раза |
6 |
2H2S (г)+ 3O 2(г)↔2 SO2 (г)+2Н2О(ж) |
Увеличение концентрации H2S в 6 раз |
7 |
2H2S (г)+ 3O 2(г)↔2 SO2 (г)+2Н2О(ж) |
Уменьшение давления в 2 раза |
8 |
2H2S (г)+ 3O 2(г)↔2 SO2 (г)+2Н2О(ж) |
Увеличение концентрации О2 в 4 раза |
9 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
Увеличение давления в 3 раза |
10 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
Увеличение концентрации HF в 6 раз |
11 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
Уменьшение давления в 2 раза |
12 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
Увеличение концентрации О3 в 2 раза |
13 |
3РН3(г) + 4О2(г)↔ 3Н2O (ж) +Р 2O5(к) |
Увеличение давления в 3 раза |
№ вар. |
Реакция |
Изменяющиеся условия |
14 |
3РН3(г) + 4О2(г)↔ 3Н2O (ж) +Р 2O5(к) |
Увеличение концентрации РН3 в 3 раза |
15 |
3РН3(г) + 4О2(г)↔ 3Н2O (ж) +Р 2O5(к) |
Уменьшение давления в 2 раза |
16 |
3РН3(г) + 4О2(г)↔ 3Н2O (ж) +Р 2O5(к) |
Увеличение концентрации О2 в 2 раза |
17 |
2СО(г) + 4Н2(г) = С2Н5ОН(г) + Н2О(г) |
Увеличение давления в 2 раза |
18 |
2СО(г) + 4Н2(г) = С2Н5ОН(г) + Н2О(г) |
Увеличение концентрации CО в 5 раз |
19 |
2СО(г) + 4Н2(г) = С2Н5ОН(г) + Н2О(г) |
Уменьшение давления в 3 раза |
20 |
2СО(г) + 4Н2(г) = С2Н5ОН(г) + Н2О(г) |
Увеличение концентрации CО в 6 раз |
21 |
C2H2(г) + 2H2(г) ↔ C2H6(г) |
Увеличение давления в 3 раза |
22 |
C2H2(г) + 2H2(г) ↔ C2H6(г) |
Увеличение концентрации C2H2 в 2 раза |
23 |
C2H2(г) + 2H2(г) ↔ C2H6(г) |
Уменьшение давления в 3 раза |
24 |
C2H2(г) + 2H2(г) ↔ C2H6(г) |
Увеличение концентрации H2 в 5 раз |
25 |
4HCl (г)+ О2 (г)↔ 2Сl2 (г) + 2Н2O(г) |
Увеличение давления в 3 раза |
26 |
4HCl (г)+ О2 (г)↔ 2Сl2 (г) + 2Н2O(г) |
Увеличение концентрации HCl в 2 раза |
27 |
4HCl (г)+ О2 (г)↔ 2Сl2 (г) + 2Н2O(г) |
Уменьшение давления в 3 раза |
28 |
4HCl (г)+ О2 (г)↔ 2Сl2 (г) + 2Н2O(г) |
Увеличение концентрации О2 в 2 раза |
29 |
2N2O(г) + O2(г) = 2NO(г) |
Увеличение давления в 2 раза |
30 |
2N2O(г) + O2(г) = 2NO(г) |
Увеличение концентрации N2O в 3 раза |
31 |
2N2O(г) + O2(г) = 2NO(г) |
Уменьшение давления в 4 раза |
32 |
2N2O(г) + O2(г) = 2NO(г) |
Увеличение концентрации О2 в 3 раза |
33 |
СО(г) + 2Н2(г) = СН3ОН(г) |
Увеличение давления в 2 раза |
34 |
СО(г) + 2Н2(г) = СН3ОН(г) |
Увеличение концентрации СO в 3 раза |
35 |
СО(г) + 2Н2(г) = СН3ОН(г) |
Уменьшение давления в 5 раз |
36 |
СО(г) + 2Н2(г) = СН3ОН(г) |
Увеличение концентрации Н2 в 3 раза |
37 |
2СН4 + 3О2 + 2NH3↔ 2HCN + 6H2O |
Увеличение давления в 2 раза |
38 |
2СН4 + 3О2 + 2NH3↔ 2HCN + 6H2O |
Увеличение концентрации СН4 в 3 раза |
39 |
2СН4 + 3О2 + 2NH3↔ 2HCN + 6H2O |
Уменьшение давления в 4 раза |
40 |
2СН4 + 3О2 + 2NH3↔ 2HCN + 6H2O |
Увеличение концентрации О2 в 3 раза |
41 |
2СН4 + 3О2 + 2NH3↔ 2HCN + 6H2O |
Увеличение концентрации NH3 в 3 раза |
42 |
N2O(г) + NO(г) = NO2(г) + N2(г) |
Увеличение давления в 2 раза |
43 |
N2O(г) + NO(г) = NO2(г) + N2(г) |
Увеличение концентрации N2O в 3 раза |
44 |
N2O(г) + NO(г) = NO2(г) + N2(г) |
Уменьшение давления в 5 раз |
45 |
N2O(г) + NO(г) = NO2(г) + N2(г) |
Увеличение концентрации NO в 3 раза |
46 |
2 Н2(г) + SO2(г) = S (т) + 2H2O |
Увеличение давления в 2 раза |
47 |
2 Н2(г) + SO2(г) = S (т) + 2H2O |
Увеличение концентрации Н2 в 3 раза |
48 |
2 Н2(г) + SO2(г) = S (т) + 2H2O |
Уменьшение давления в 3 раза |
49 |
2 Н2(г) + SO2(г) = S (т) + 2H2O |
Увеличение концентрации SO2 в 3 раза |
50 |
H2S(г) + Cl2(г) = 2HCl(г) + S(т) |
Увеличение давления в 3 раза |
51 |
H2S(г) + Cl2(г) = 2HCl(г) + S(т) |
Увеличение концентрации H2S в 2 раза |
52 |
H2S(г) + Cl2(г) = 2HCl(г) + S(т) |
Уменьшение давления в 4 раза |
53 |
H2S(г) + Cl2(г) = 2HCl(г) + S(т) |
Увеличение концентрации Cl2 в 3 раза |
54 |
2N2O(г) + O2(г) = 2NO(г) |
Увеличение давления в 2 раза |
55 |
2N2O(г) + O2(г) = 2NO(г) |
Увеличение концентрации N2O в 3 раза |
56 |
2N2O(г) + O2(г) = 2NO(г) |
Уменьшение давления в 2 раза |
57 |
2N2O(г) + O2(г) = 2NO(г) |
Увеличение концентрации О2 в 3 раза |
58 |
N2O4(г) ↔2NO2(г) |
Увеличение давления в 5 раз |
59 |
N2O4(г) ↔2NO2(г) |
Увеличение концентрации N2O4 в 2 раза |
60 |
N2O4(г) ↔2NO2(г) |
Уменьшение давления в 3 раза |
61 |
N2O4(г) ↔2NO2(г) |
Уменьшение концентрации N2O4 в 2 раза |
№ вар. |
Реакция |
Изменяющиеся условия |
62 |
SO2 + CO2 ↔SO3 + CO |
Увеличение давления в 3 раза |
63 |
SO2 + CO2 ↔SO3 + CO |
Увеличение концентрации SO2 в 2 раза |
64 |
SO2 + CO2 ↔SO3 + CO |
Уменьшение давления в 3 раза |
65 |
SO2 + CO2 ↔SO3 + CO |
Увеличение концентрации CO2 в 2 раза |
66 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
Увеличение давления в 2 раза |
67 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
Увеличение концентрации HF в 2 раза |
68 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
Уменьшение давления в 4 раза |
69 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
Увеличение концентрации O3 в 2 раза |
70 |
NOCl2(г)+NO(г) |
Увеличение давления в 2 раза |
71 |
NOCl2(г)+NO(г) 2NOCl(г) |
Увеличение концентрации NOCl2 в 2 раза |
72 |
NOCl2(г)+NO(г) 2NOCl(г) |
Уменьшение давления в 3 раза |
73 |
NOCl2(г)+NO(г) 2NOCl(г) |
Увеличение концентрации NO в 2 раза |
74 |
2СО(г) + 4Н2(г) ↔ С2Н5ОН(г) + Н2О(ж) |
Увеличение давления в 3 раза |
75 |
2СО(г) + 4Н2(г) ↔ С2Н5ОН(г) + Н2О(ж) |
Увеличение концентрации СО в 3 раза |
76 |
2СО(г) + 4Н2(г) ↔ С2Н5ОН(г) + Н2О(ж) |
Уменьшение давления в 2 раза |
77 |
2СО(г) + 4Н2(г) ↔ С2Н5ОН(г) + Н2О(ж) |
Увеличение концентрации Н2 в 3 раза |
78 |
SO2(г) + NO2(г) ↔ SO3(г) + NO(г) |
Увеличение давления в 4 раза |
79 |
SO2(г) + NO2(г) ↔ SO3(г) + NO(г) |
Увеличение концентрации NO2 в 3 раза |
80 |
SO2(г) + NO2(г) ↔ SO3(г) + NO(г) |
Уменьшение давления в 2 раза |
2. Как изменится скорость химической реакции при указанном изменении температуры.
Таблица 9
Контрольные задания (задача 2)
-
№ варианта
Т1
Т2
γ
№ варианта
Т1
Т2
γ
1
20
45
2,5
31
60
90
2,1
2
34
64
3
32
80
50
3,5
3
60
90
2,1
33
70
45
2
4
80
50
3
34
55
75
2,5
5
70
45
2
35
30
80
2,4
6
55
75
2,5
36
35
85
3,5
7
40
80
4
37
25
55
3
8
35
85
3,5
38
33
68
2
9
25
55
3
39
36
76
4
10
33
68
2
40
55
35
2
11
36
76
4
41
67
47
2,5
12
55
35
2
42
20
45
2,5
13
67
47
2,5
43
90
40
2,5
14
90
45
2
44
80
55
3
15
80
55
3
45
75
35
2,5
16
75
35
2,5
46
40
65
3
17
40
65
3
47
68
43
3
18
68
43
3
48
35
85
2,4
19
35
80
2
49
33
63
3,2
20
33
63
3,2
50
35
85
3,5
21
35
85
3,5
51
25
55
3,3
22
25
55
3,3
52
33
68
2
-
№ варианта
Т1
Т2
γ
№ варианта
Т1
Т2
γ
23
33
68
2
53
35
70
4
24
36
76
4
54
55
35
2,4
25
55
35
2,4
55
67
47
2,5
26
67
47
2,5
56
90
45
2
27
90
45
2
57
35
85
3,5
28
35
85
3,5
58
20
45
2,5
29
20
45
2,5
59
34
64
3,3
30
34
64
3,3
60
90
45
2
61
80
55
3
71
34
64
3,3
62
75
35
2,5
72
60
90
2,1
63
25
55
3,3
73
80
50
3,5
64
33
63
2,5
74
70
45
2
65
36
76
4
75
55
75
2,5
66
55
35
2,4
76
30
80
2,4
67
67
47
2,5
77
35
85
3,5
68
90
45
2
78
25
55
3
69
35
85
3,5
79
33
68
2
70
20
45
2,5
80
36
76
4
3. Рассчитать константу равновесия обратимой реакции при указанных равновесных концентрациях веществ.
Таблица 10
Контрольные задания ( задача 3)
-
4NH3(г) + 5O2(г) ↔ 4NO(г) + 6H2O(г)
№ вар.



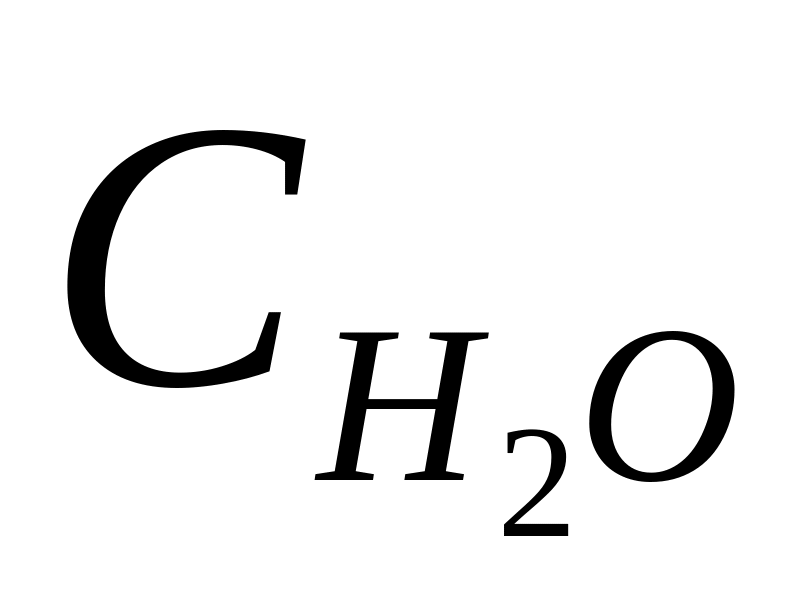
1
0,37
1,74
3,78
3,1
2
2,44
0,59
8,22
6,1
3
1,63
2,15
7,44
5,34
4
0,86
0,43
4,02
4,0
5
0,99
0,56
5,9
3,55
6
3,78
4,1
0,37
1,74
7
8,28
7,1
2,44
0,59
8
7,55
5,34
1,63
2,15
9
4,02
4,0
0,86
0,43
10
3,78
4,1
0,99
0,56
4NO + 6H2O ↔4NH3 + 5O2
№ вар.
11
2,44
1,58
0,65
0,21
12
3,86
2,47
1,35
1,66
13
4,25
2,18
3,55
3,01
14
0,98
0,34
0,85
0,55
15
1,52
0,84
2,96
1,6
16
2,07
1,46
1,15
0.98
17
0,65
0,21
2,44
1,58
18
1,35
1,66
3,86
2,47
19
3,55
3,01
4,25
2,18
20
0,85
0,55
0,98
0,34
2NF3 + 3H2↔ 6HF + N2
№ вар.



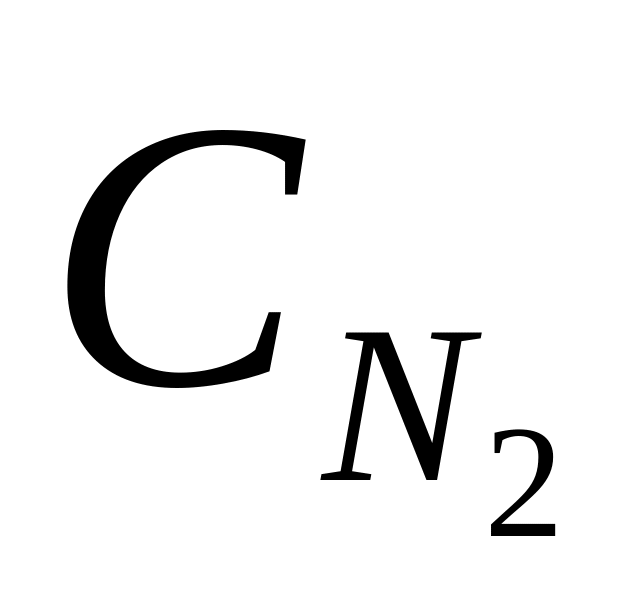
21
0,86
0,43
1,24
1,1
22
1,15
0,72
0,96
1,12
23
0,73
1,06
1,36
1,2
24
1,25
0,94
0,82
0,9
25
0,69
0,88
1,23
1,6
26
1,38
1,02
0,78
0,68
27
1,24
1,2
0,8
0,43
28
0,96
1,4
1,15
0,72
29
1,36
1,25
0,73
1,06
30
0,82
0,98
1,25
0,94
2СО(г) + 4Н2(г) ↔ С2Н5ОН(г) + Н2О(г)
№ вар.


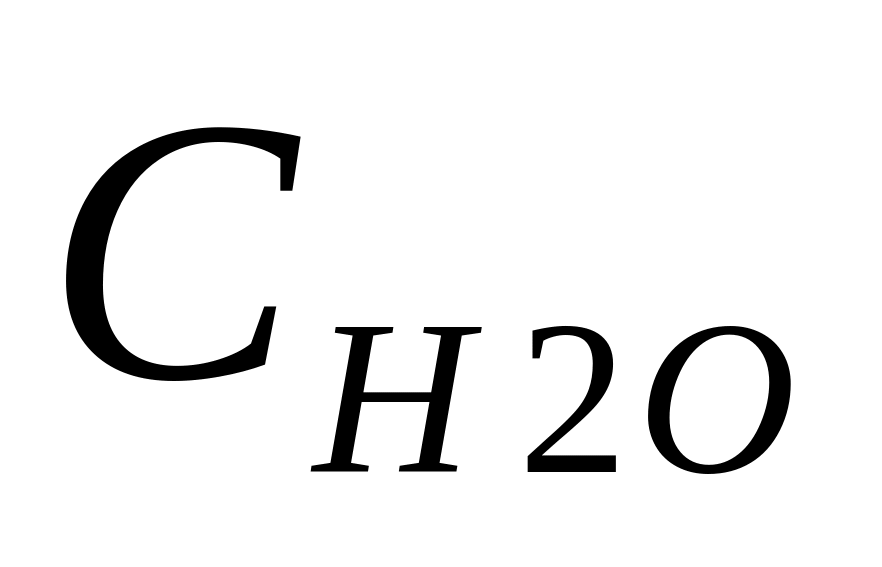
31
0,05
0,21
0,94
0,77
32
0,07
0,32
1,05
0,59
33
0,03
0,15
0,84
0,66
34
0,08
0,41
0,79
0,72
35
0,06
0,28
0,94
0,83
36
0,09
0,37
0,89
0,52
37
0,94
0,77
0,05
0,21
38
1,05
0,59
0,07
0,32
39
0,84
0,66
0,03
0,15
40
0,79
0,72
0,08
0,41
СО2 (г) + 4Н2(г) ↔ СН4(г) + 2Н2O
№ вар.


41
3,78
4,1
0,37
1,74
42
8,28
7,1
2,44
0,59
43
7,55
5,34
1,63
2,15
44
4,02
4,0
0,86
0,43
45
3,78
4,1
0,99
0,56
46
3,78
4,1
0,37
1,74
47
0,37
1,74
3,78
3,1
48
2,44
0,59
8,22
6,1
49
1,63
2,15
7,44
5,34
50
0,86
0,43
4,02
4,0
2H2S (г)+ 3O 2(г)↔2 SO2 (г)+2Н2О(г)
№ вар.

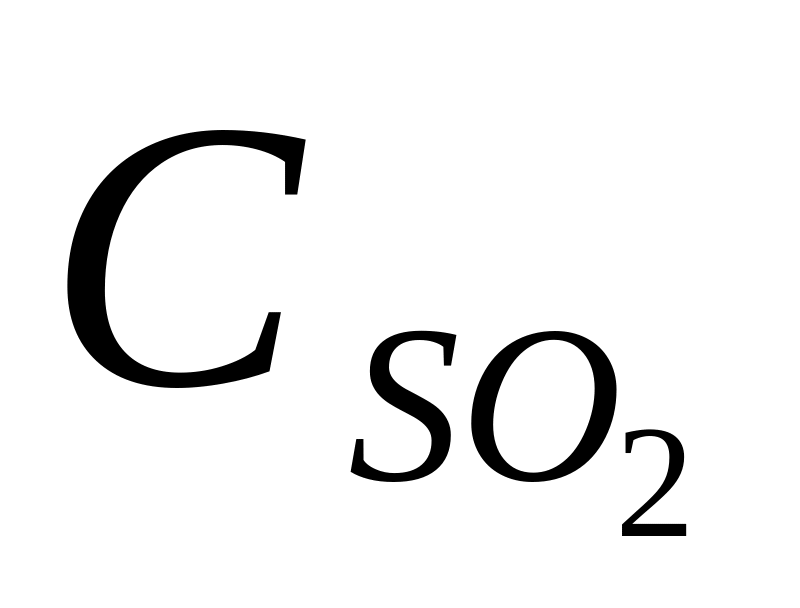
51
0,09
0,37
0,89
0,52
52
0,94
0,77
0,05
0,21
53
1,05
0,59
0,07
0,32
54
0,84
0,66
0,03
0,15
55
1,38
1,02
0,78
0,68
56
1,24
1,2
0,8
0,43
57
0,96
1,4
1,15
0,72
58
1,36
1,25
0,73
1,06
59
0,82
0,98
1,25
0,94
60
1,63
2,15
7,44
5,34
4NH3 + 3O2 ↔ 6H2O + 2N2
№ вар.

61
1,38
1,02
0,78
0,68
62
1,24
1,2
0,8
0,43
63
0,96
1,4
1,15
0,72
64
1,36
1,25
0,73
1,06
65
0,82
0,98
1,25
0,94
66
2,07
1,46
1,15
0.98
67
0,65
0,21
2,44
1,58
68
1,35
1,66
3,86
2,47
69
3,55
3,01
4,25
2,18
70
0,85
0,55
0,98
0,34
2NO + 2H2↔ N2 + 2H2O
№ вар.
71
1,05
0,59
0,07
0,32
72
0,84
0,66
0,03
0,15
73
1,38
1,02
0,78
0,68
74
1,24
1,2
0,8
0,43
75
0,96
1,4
1,15
0,72
76
0,09
0,37
0,89
0,52
77
0,94
0,77
0,05
0,21
78
1,05
0,59
0,07
0,32
79
0,84
0,66
0,03
0,15
80
0,79
0,72
0,08
0,41
4. В какую сторону сместится равновесие в системе в соответствии с принципом Ле-Шателье при изменении условий:
Таблица 11
Контрольные задания (задача 4)
№ вар. |
Реакция |
Тепловой эффект |
Изменяющиеся условия |
1 |
4NH3(г) + 5O2(г) ↔ 4NO(г) + 6H2O(г) |
H<0 |
А) увеличение концентрации O2 Б) понижение давления |
2 |
4NH3(г) + 5O2(г) ↔ 4NO(г) + 6H2O(г) |
H<0 |
А) увеличение концентрации NH3 Б) повышение давления |
3 |
4NH3(г) + 5O2(г) ↔ 4NO(г) + 6H2O(г) |
H<0 |
А) увеличение температуры Б) уменьшение концентрации O2 |
4 |
4NH3(г) + 5O2(г) ↔ 4NO(г) + 6H2O(г) |
H<0 |
А) понижение температуры Б) увеличение концентрации NO |
5 |
2H2S (г)+ 3O 2(г)↔2 SO2 (г)+2Н2О(г) |
H<0 |
А) увеличение концентрации O2 Б) понижение давления |
6 |
2H2S (г)+ 3O 2(г)↔2 SO2 (г)+2Н2О(г) |
H<0 |
А) увеличение концентрации H2S Б) повышение давления |
7 |
2H2S (г)+ 3O 2(г)↔2 SO2 (г)+2Н2О(г) |
H<0 |
А) увеличение температуры Б) уменьшение концентрации O2 |
8 |
2H2S (г)+ 3O 2(г)↔2 SO2 (г)+2Н2О(г) |
H<0 |
А) понижение температуры Б) увеличение концентрации SO2 |
№ вар. |
Реакция |
Тепловой эффект |
Изменяющиеся условия |
|
9 |
4HCl (г)+ О2 (г)↔ 2Сl2 (г) + 2Н2O(г) |
H<0 |
А) увеличение концентрации O2Б) понижение давления |
|
10 |
4HCl (г)+ О2 (г)↔ 2Сl2 (г) + 2Н2O(г) |
H<0 |
А) увеличение концентрации Cl2 Б) повышение давления |
|
11 |
4HCl (г)+ О2 (г)↔ 2Сl2 (г) + 2Н2O(г) |
H<0 |
А) увеличение температуры Б) уменьшение концентрации O2 |
|
12 |
4HCl (г)+ О2 (г)↔ 2Сl2 (г) + 2Н2O(г) |
H<0 |
А) понижение температуры Б) увеличение концентрации СО2 |
|
13 |
3РН3(г) + 4О2(г)↔ 3Н2O (ж) +Р 2O5(к) |
H<0 |
А) увеличение концентрации O2 Б) понижение давления |
|
14 |
3РН3(г) + 4О2(г)↔ 3Н2O (ж) +Р 2O5(к) |
H<0 |
А) увеличение концентрации РН3 Б) повышение давления |
|
15 |
3РН3(г) + 4О2(г)↔ 3Н2O (ж) +Р 2O5(к) |
H<0 |
А) увеличение температуры Б) уменьшение концентрации O2 |
|
16 |
3РН3(г) + 4О2(г)↔ 3Н2O (ж) +Р 2O5(к) |
H<0 |
А) понижение температуры Б) увеличение концентрации Н2O |
|
17 |
2SO2 (г)+ O 2(г)↔2 SO3 (г) |
H>0 |
А) увеличение концентрации O2 Б) понижение давления |
|
18 |
2SO2 (г)+ O 2(г)↔2 SO3 (г) |
H>0 |
А)увеличение концентрации SO2 Б) повышение давления |
|
19 |
2SO2 (г)+ O 2(г)↔2 SO3 (г) |
H>0 |
А) увеличение температуры Б) уменьшение концентрации O2 |
|
20 |
2SO2 (г)+ O 2(г)↔2 SO3 (г) |
H>0 |
А) понижение температуры Б) уменьшение концентрации SO2 |
|
21 |
C2H2(г) + 2H2(г) ↔ C2H6(г) |
H<0 |
а) увеличение концентрации H2б) понижение давления |
|
22 |
C2H2(г) + 2H2(г) ↔ C2H6(г) |
H<0 |
а) увеличение концентрации C2H2 б) повышение давления |
|
23 |
C2H2(г) + 2H2(г) ↔ C2H6(г) |
H<0 |
а) увеличение температуры б) уменьшение концентрации C2H2 |
|
24 |
C2H2(г) + 2H2(г) ↔ C2H6(г) |
H<0 |
а) понижение температуры б) увеличение концентрации H2 |
|
25 |
N2O4(г) ↔2NO2(г) |
H>0 |
а) увеличение концентрации NО2 б) понижение давления |
|
26 |
N2O4(г) ↔2NO2(г) |
H>0 |
а) увеличение концентрации N2O4 б) повышение давления |
|
27 |
N2O4(г) ↔2NO2(г) |
H>0 |
а) увеличение температуры б)уменьшение концентрации NО2 |
|
28 |
N2O4(г) ↔2NO2(г) |
H>0 |
а) понижение температуры б)уменьшение концентрации N2O4 |
|
29 |
2N2O(г) + O2(г) ↔ 2NO(г) |
H<0 |
а) увеличение концентрации О2 б) понижение давления |
|
30 |
2N2O(г) + O2(г) ↔ 2NO(г) |
H<0 |
а) увеличение концентрации N2O б) повышение давления |
|
31 |
2N2O(г) + O2(г) ↔ 2NO(г) |
H<0 |
а) увеличение температуры б) уменьшение концентрации О2 |
|
№ вар. |
Реакция |
Тепловой эффект |
Изменяющиеся условия |
32 |
2N2O(г) + O2(г) ↔ 2NO(г) |
H<0 |
а) понижение температуры б) увеличение концентрации NO |
33 |
СО(г) + 2Н2(г) ↔ СН3ОН(г) |
H<0 |
а) увеличение концентрации СО б) понижение давления |
34 |
СО(г) + 2Н2(г) ↔ СН3ОН(г) |
H<0 |
а) увеличение концентрации Н2б) повышение давления |
35 |
СО(г) + 2Н2(г) ↔ СН3ОН(г) |
H<0 |
а) увеличение температуры б) уменьшение концентрации СН3ОН |
36 |
СО(г) + 2Н2(г) ↔ СН3ОН(г) |
H<0 |
а) понижение температуры б) увеличение концентрации СН3ОН |
37 |
2СН4 + 3О2 + 2NH3↔ 2HCN + 6H2O |
H<0 |
а) увеличение концентрации O2 б) понижение давления |
38 |
2СН4 + 3О2 + 2NH3↔ 2HCN + 6H2O |
H<0 |
а) увеличение концентрации NH3 б) повышение давления |
39 |
2СН4 + 3О2 + 2NH3↔ 2HCN + 6H2O |
H<0 |
а) увеличение температуры б) уменьшение концентрации О2 |
40 |
2СН4 + 3О2 + 2NH3↔ 2HCN + 6H2O |
H<0 |
а) понижение температуры б) увеличение концентрации HCN |
41 |
2СН4 + 3О2 + 2NH3↔ 2HCN + 6H2O |
H<0 |
а) увеличение концентрации СН4 б) понижение давления |
42 |
N2O(г) + NO(г) ↔ NO2(г) + N2(г) |
H<0 |
а) увеличение концентрации N2O б) повышение давления |
43 |
N2O(г) + NO(г) ↔ NO2(г) + N2(г) |
H<0 |
а) увеличение температуры б) уменьшение концентрации N2O |
44 |
N2O(г) + NO(г) ↔ NO2(г) + N2(г) |
H<0 |
а) понижение температуры б) увеличение концентрации NO |
45 |
N2O(г) + NO(г) ↔ NO2(г) + N2(г) |
H<0 |
а) увеличение концентрации азота б) понижение давления |
46 |
2 Н2(г) + SO2(г) ↔S (т) + 2H2O |
H<0 |
а) увеличение концентрации Н2 б) повышение давления |
47 |
2 Н2(г) + SO2(г) ↔ S (т) + 2H2O |
H<0 |
а) увеличение температуры б) уменьшение концентрации Н2 |
48 |
2 Н2(г) + SO2(г) ↔ S (т) + 2H2O |
H<0 |
а) понижение температуры б) увеличение концентрации H2O |
49 |
2 Н2(г) + SO2(г) ↔ S (т) + 2H2O |
H<0 |
а) увеличение концентрации SO2 б) понижение давления |
50 |
H2S(г) + Cl2(г) ↔ 2HCl(г) + S(т) |
H<0 |
а) увеличение концентрации H2S б) повышение давления |
51 |
H2S(г) + Cl2(г) ↔ 2HCl(г) + S(т) |
H<0 |
а) увеличение температуры б) уменьшение концентрации H2S |
52 |
H2S(г) + Cl2(г) ↔ 2HCl(г) + S(т) |
H<0 |
а) понижение температуры б) увеличение концентрации HCl |
53 |
H2S(г) + Cl2(г) ↔ 2HCl(г) + S(т) |
H<0 |
а) увеличение концентрации Cl2 б) понижение давления |
№ вар. |
Реакция |
Тепловой эффект |
Изменяющиеся условия |
54 |
Cl2 (г)+ H 2О (ж)↔ HCl(Раств) + НСlO(раст) |
H>0 |
а) увеличение концентрации Cl2 б) повышение давления |
55 |
Cl2 (г)+ H 2О (ж)↔ HCl(Раств) + НСlO(раст) |
H>0 |
а) увеличение температуры б) уменьшение концентрации Cl2 |
56 |
Cl2 (г)+ H 2О (ж)↔ HCl(Раств) + НСlO(раст) |
H>0 |
а) понижение температуры б) увеличение концентрации Cl2 |
57 |
Cl2 (г)+ H 2О (ж)↔ HCl(Раств) + НСlO(раст) |
H>0 |
а) увеличение концентрации Сl2 б) понижение давления |
58 |
NO + NO2↔N2O3 |
H<0 |
а) увеличение концентрации NO б) повышение давления |
59 |
NO + NO2↔N2O3 |
H<0 |
а) увеличение температуры б)уменьшение концентрации NО2 |
60 |
NO + NO2↔N2O3 |
H<0 |
а) понижение температуры б)увеличение концентрации N2O3 |
61 |
NO + NO2↔N2O3 |
H<0 |
а) увеличение концентрации NО2 б) понижение давления |
62 |
SO2 + CO2 ↔SO3 + CO |
∆Н>0 |
а) увеличение концентрации SO2 б) повышение давления |
63 |
SO2 + CO2 ↔SO3 + CO |
∆Н>0 |
а) увеличение температуры б) уменьшение концентрации SO2 |
64 |
SO2 + CO2 ↔SO3 + CO |
∆Н>0 |
а) понижение температуры б) увеличение концентрации NO |
65 |
SO2 + CO2 ↔SO3 + CO |
∆Н>0 |
а) увеличение концентрации CO2 б) понижение давления |
66 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
∆Н>0 |
а) увеличение концентрации HF б) повышение давления |
67 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
∆Н>0 |
а) увеличение температуры б) уменьшение концентрации O3 |
68 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
∆Н>0 |
а) понижение температуры б) увеличение концентрации F2 |
69 |
2HF(г) + O3(г) ↔ F2(г) + O2(г) |
∆Н>0 |
а) понижение давления б) увеличение концентрации O2 |
70 |
NOCl2(г)+NO(г) 2NOCl(г) |
H<0 |
а) увеличение концентрации NO б) понижение давления |
71 |
NOCl2(г)+NO(г) 2NOCl(г) |
H<0 |
а) увеличение концентрации NOCl б) повышение давления |
72 |
NOCl2(г)+NO(г) 2NOCl(г) |
H<0 |
а) увеличение температуры б) уменьшение концентрации NOCl2 |
73 |
NOCl2(г)+NO(г) 2NOCl(г) |
|
а) понижение температуры б) уменьшение концентрации NO |
74 |
2СО(г) + 4Н2(г) ↔С2Н5ОН(г) + Н2О(г) |
H<0 |
а) увеличение концентрации СО б) понижение давления |
75 |
2СО(г) + 4Н2(г) ↔ С2Н5ОН(г) + Н2О(г) |
H<0 |
а) увеличение концентрации Н2 б) повышение давления |
№ вар. |
Реакция |
Тепловой эффект |
Изменяющиеся условия |
76 |
2СО(г) + 4Н2(г) ↔ С2Н5ОН(г) + Н2О(г) |
H<0 |
а) увеличение температуры б) уменьшение концентрации С2Н5ОН |
77 |
2СО(г) + 4Н2(г) ↔ С2Н5ОН(г) + Н2О(г) |
H<0 |
а) понижение температуры б) увеличение концентрации Н2О |
78 |
SO2(г) + NO2(г) ↔ SO3(г) + NO(г) |
H<0 |
а) увеличение концентрации SO2 б) понижение давления |
79 |
SO2(г) + NO2(г) ↔ SO3(г) + NO(г) |
H<0 |
а) увеличение концентрации NO2 б) повышение давления |
80 |
SO2(г) + NO2(г) ↔SO3(г) + NO(г) |
H<0 |
а) увеличение температуры б) уменьшение концентрации SO3 |
