
- •Общая характеристика метода осадительного титрования
- •Аргентометрическое титрование
- •Тиоцианометрическое титрование
- •Меркурометрическое титрование
- •Кривые окислительно-восстановительного титрования
- •Индикаторы окислительно-восстановительного титрования
- •Перманганатометрия
- •Йодометрия
- •Дихроматометрия
Меркурометрическое титрование
Меркурометрический метод осадительного титрования (меркурометрия) основан на титровании растворов хлоридов и йодидов раствором нитрата ртути (I):
![]()
В качестве титранта в методе применяют 0,1 н раствор Hg2(NO3)2 · 2H2O, который готовят из нитрата ртути (I), растворяя его в 0,2 н HNO3. В нитрате ртути (I) может находиться примесь ртути (II). Для удаления Hg2+ добавляют немного металлической ртути и, взболтав, оставляют на сутки. При этом идет реакция
Hg2+ + Hg = Hg2+2
Титр приготовленного раствора Hg2(NO3)2 устанавливают по стандартному раствору хлорида натрия.
>В качестве индикаторов в меркурометрии применяют раствор роданида железа или раствор дифенилкарбазона. Роданид железа (III) получают непосредственно в титруемом растворе галогенида, добавляя к нему 1 мл 0,05 н NH4SCN и 2 мл концентрированного раствора Fe(NO3)3. Появляется красное окрашивание вследствие образования комплексного иона [Fe(SCN)]2 +. Красная окраска раствора не исчезает во время титрования, пока в нем находится избыток галогенидов. При полном их связывании в точке эквивалентности в растворе появляется избыток титранта Hg2(NO3)3. Раствор обесцвечивается вследствие осаждения SCN - -ионов ионами Hg2+2 в виде менее растворимого соединения:
Hg2+2
+ 2 [Fe(SCN)]2+
![]()
![]()
Кривая титрования слабой кислоты сильным основанием/strong>
При расчете кривой титрования слабой кислоты щелочью следует учитывать тот факт, что до точки эквивалентности в растворе присут-ствует буферная смесь, состоящая из неоттитрованной слабой кислоты и ее соли, образованной за счет взаимодействия слабой кислоты со щелочью. В точке эквивалентности в растворе присутствует соль, образованная слабой кислотой и сильным основанием, она подвергается гидролизу и среда становится щелочной, в отличие от точки эквивалентности в случае титрования сильной кислоты щелочью.
За точкой эквивалентности в растворе, как и в случае титрования сильной кислоты, будет находиться в избытке щелочь, и ее содержание в растворе будет определять рН.
Пример. Построить кривую титрования 10,0 мл 0,1 М CH3COOH раствором 0,1 М NaOH. Расчетные данные приведены в табл.13.1.1.
Решение. В первоначальный момент (без добавления NaOH) в растворе присутствует слабая кислота, расчет рН ведется по формуле
![]()
Во всех последующих точках на кривой титрования до точки эквивалентности (в том числе в начале скачка на кривой титрования) расчет рН ведут для буферной системы (смесь CH3COOH и ее соли CH3COONa) по формуле
![]()
Концентрация оставшейся уксусной кислоты в растворе вычисляется по формуле
![]()
а концентрация ацетата натрия – по формуле

Например, при добавлении 9,0 мл 0,1 М NaOH
![]()
![]()
![]()
Значение рН в начале скачка на кривой титрования (добавлено 9,99 мл 0,1 М NaOH) рассчитывается по формуле
![]()
Таблица 13.1.1
Расчет кривой титрования 10,0 мл 0,1 М СH3COOH раствором 0,1 М NaOH
|
№ |
V(NaOH),мл |
|
|
|
[OH-],моль/л |
pH |
|
1. |
0,00 |
0,10 |
- |
- |
- |
2,88 |
|
2. |
2,50 |
0,06 |
0,020 |
3,000 |
- |
4,28 |
|
3. |
5,00 |
0,03 |
0,030 |
1,000 |
- |
4,76 |
|
4. |
9,00 |
5 · 10 -3 |
0,047 |
0,100 |
- |
5,76 |
|
5. |
9,90 |
5 · 10 -4 |
0,050 |
0,010 |
- |
6,76 |
|
6. |
9,99 |
5 · 10 -5 |
0,050 |
0,001 |
- |
7,76 |
|
7. |
10,00 |
- |
0,050 |
- |
- |
8,76 |
|
8. |
10,01 |
- |
0,050 |
- |
5 ·10 - 5 |
9,7 |
|
9. |
10,10 |
- |
0,050 |
- |
5 ·10 - 4 |
10,7 |
|
10. |
11,00 |
- |
0,047 |
- |
5 ·10 - 3 |
11,7 |
|
11. |
15,00 |
- |
0,040 |
- |
0,02 |
12,3 |
В общем случае рН в начале скачка на кривой титрования слабой одноосновной кислоты можно вычислить по формуле
pH = pK + 3
Эта
формула получается с учетом того факта,
что логарифм отношения количества
неоттитрованной кислоты (0,1 %) к количеству
полученной соли (99,9 %) в данном случае
![]()
В точке эквивалентности (добавлено 10,0 мл 0,1 М NaOH) рН рассчитывается для гидролизующейся соли CH3COONa по формуле
![]()
За точкой эквивалентности расчет рН ведется аналогичным образом, как и в случае титрования сильной кислоты щелочью. Внешний вид кривой титрования приведен на рис.13.1.1.
Анализ кривой титрования
Характерной особенностью кривых титрования слабых одноосновных кислот является несовпадение точки эквивалентности с точкой нейтральности и расположение точки эквивалентности в щелочной области. Величина скачка на кривой титрования значительно меньше, чем в случае титрования сильной кислоты щелочью. Так, в данном случае рН = рН конца скачка - рН начала скачка = 9,7 - 7,76 = 1,94 вместо 5,4 единиц при титровании 0,1 М HCl раствором 0,1 М NaOH. В данном случае в качестве индикатора можно использовать только фенолфталеин, метиловый оранжевый применять нельзя.
Величина скачка уменьшается с уменьшением концентрации кислоты, с возрастанием температуры, с уменьшением константы диссоциации слабой кислоты. При Kкисл < 10 - 6 скачок исчезает вообще.

Рис.13.1.1. Кривая титрования 10 мл 0,1 М CH3COOH раствором 0,1 М NaOH
Кривая титрования слабого основания сильной кислотой/strong>
При построении кривой титрования слабого основания сильной кислотой исходят из тех же соображений, что и в случае титрования слабой кислоты щелочью. В первоначальный момент рН раствора определяется диссоциацией слабого основания. До точки эквивалентности в растворе будет присутствовать буферная смесь, состоящая из неоттитрованного слабого основания и его соли. В точке эквивалентности находится только соль слабого основания и сильной кислоты, которая подвергается гидролизу и создает кислую среду. За точкой эквивалентности рН определяется избыточным содержанием в растворе сильной кислоты.
Пример. Построить кривую титрования 10,0 мл 0,1 М NH4OH раствором 0,1 М HCl.
Решение. Расчетные данные приведены в табл. 13.2.1.
В первоначальный момент (кислота не добавлена) рН раствора определяется по формуле
![]()
Таблица 13.2.1
Расчет кривой титрования 10,0 мл 0,1 М NH4OH раствором 0,1 М HCl
|
№ |
V(HCl),мл |
|
|
|
[H+],моль/л |
pH |
|
1. |
2,50 |
0,06 |
0,020 |
3,000 |
- |
11,12 |
|
2. |
0,00 |
0,10 |
- |
- |
- |
9,72 |
|
3. |
5,00 |
0,03 |
0,030 |
1,000 |
- |
9,24 |
|
4. |
0,00 |
5 · 10 - 3 |
0,047 |
0,100 |
- |
8,24 |
|
5. |
9,90 |
5 · 10 - 4 |
0,050 |
0,010 |
- |
7,24 |
|
6. |
9,99 |
5 · 10 - 5 |
0,050 |
0,001 |
- |
6,24 |
|
7. |
10,00 |
- |
0,050 |
- |
- |
5,27 |
|
8. |
10,01 |
- |
0,050 |
- |
5 · 10- 5 |
4,30 |
|
8. |
10,01 |
- |
0,050 |
- |
5 · 10- 5 |
4,30 |
|
9. |
10,10 |
- |
0,050 |
- |
5 · 10- 4 |
3,30 |
|
10. |
11,00 |
- |
0,047 |
- |
5 · 10- 3 |
2,30 |
|
11. |
15,00 |
- |
0,040 |
- |
0,02 |
1,70 |
При добавлении 9,0 мл 0,1 М HCl концентрация неоттитрованного слабого основания и его соли рассчитывается следующим образом:
![]()
![]()
Расчет рН буферной смеси ведут по формуле
![]()
Аналогично рассчитывается рН в начале скачка на кривой титрования.
Значение рН в начале скачка на кривой титрования (добавлено 9,99 мл 0,1 М HCl) можно рассчитать с учетом следующих соображений: в растворе останется 0,1 % неоттитрованного одноосновного слабого основания и образуется 99,9 % соли:
![]()
В точке эквивалентности (добавлено 10,0 мл 0,1 М HCl)
![]()
За точкой эквивалентности в растворе находится избыток сильной кислоты, следовательно, концентрация [H+]-ионов определяется по формуле
![]()
Например, в конце скачка титрования (VHCl = 10,01 мл)
![]()
Внешний вид кривой титрования изображен на рис.13.2.1.

Рис.13.2.1. Кривая титрования 10 мл 0,1 М NH4OH раствором 0,1 М HCl
Анализ кривой титрования
При титровании слабого основания сильной кислотой скачок на кривой титрования и точка эквивалентности лежат в кислой среде. В данном случае скачок лежит в интервале от 6,24 до 4,3. рН составляет ~1,9 единиц, т. е. значительно меньше скачка на кривой титрования сильного основания сильной кислотой. В качестве индикатора можно использовать метиловый оранжевый. Применять фенолфталеин нельзя.
Титрование многоосновных кислот
Многоосновные кислоты (H3PO4, H2CO3) диссоциируют ступенчато. Например:
H3PO4![]() H2PO-4
+ H+,
K1
= 7,6 · 10-3
H2PO-4
+ H+,
K1
= 7,6 · 10-3
H2PO-4
![]() HPO2-4
+ H+,
K2
= 6,2 · 10-8
HPO2-4
+ H+,
K2
= 6,2 · 10-8
HPO2-4![]() PO3-4
+ H+,
K3
= 4,4 · 10-13
PO3-4
+ H+,
K3
= 4,4 · 10-13
Соответственно ступенчатой диссоциации многоосновных кислот нейтрализация их также протекает по ступеням. Сначала титруются ионы [H+], образовавшиеся по первой ступени диссоциации, в точке эквивалентности наблюдается скачок рН. Если продолжить титрование, то далее будут нейтрализоваться ионы [H+] , получившиеся по второй ступени диссоциации, и на кривой титрования появится второй скачок рН (см. рис.13.3.1).
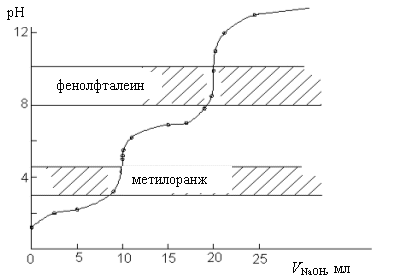
Рис.13.3.1. Кривая титрования 10 мл 0,1 М H3PO4 раствором 0,1 М NaOH
Казалось бы, что в момент нейтрализации около третьей точки эквивалентности должен произойти третий скачок рН. Однако он не наблюдается из-за малой величины константы диссоциации Н3PO4 по третьей ступени, поэтому непосредственно оттитровывать Н3PO4 как кислоту трехосновную ни с одним индикатором нельзя.
При построении кривой титрования Н3PO4 раствором NaOH учитывают следующие моменты. В первоначальный момент титрования (V(NaOH)=0) рН рассчитывается по формуле для слабых кислот
![]()
Положение первой точки эквивалентности вычисляется по формуле для кислой соли NaН2PO4:
![]()
![]()
Таким образом, первая точка эквивалентности лежит вблизи интервала перехода метилового оранжевого (см. рис.13.3.1).
Величину рН во второй точке эквивалентности можно вычислить по формуле для кислой соли Na2НPO4:
![]()
![]()
Вторая точка эквивалентности лежит в интервале перехода окраски фенолфталеина.
Величину рН в третьей точке эквивалентности можно вычислить по формуле для рН солей слабых многоосновных кислот и сильных оснований (для ссоли = 0,1 моль/л)
![]()
Титрование H3PO4 как трехосновной кислоты можно осуществить только косвенным путем (методом "замещения"), проводя реакцию взаимодействия H3PO4 с CaCl2 и оттитровывая затем выделившуюся HCl раствором NaOH:
![]()
![]()
Таким образом, кривые титрования многоосновных кислот имеют несколько перегибов, отвечающих разным ступеням диссоциации. Достаточно резкие скачки на кривых титрования появляются только при условии, если отношение величин констант диссоциации по соответст-вующим ступеням достаточно велико (не меньше 10 4).
Примеры расчета рН раствора различных смесей кислот и оснований)
Пример 1. Вычислить значение рН раствора, полученного при сливании 50 мл 0,1 н HCl:
-
с 20 мл 0,2 н NaOH;
-
51 мл 0,1 н NaOH;
-
50мл 0,1 н NaOH.
Решение. Первоначально рассчитывают количество миллиэквивалентов кислоты и основания (nк, nо, мэкв) до реакции. Затем рассчитывают количество кислоты и основания в растворе после проведения реакции и вычисляют рН с учетом продуктов реакции.
Случай а. Рассчитываем количество кислоты и основания до реакции:
nк = сн · V = 50 0,1 = 5 мэкв; nо = 20 0,2 = 4 мэкв.
Рассчитываем количество кислоты и основания после проведения реакции:
nк = 5 - 4 = 1 мэкв; n о = 0.
Таким образом, после проведения реакции в растворе останется сильная кислота, которая будет определять рН раствора. Расчет ведут по формуле
рН = - lg [H+]ост = - lg ((сн · V)к - (сн· V)о))/(Vк +Vo);
рН= - lg (50 0,1 -20 0,2)/70 = -lg 0,014 =1,85.
Случай b. Количество кислоты и основания до реакции:
nк = сн V = 50 - 0,1 = 5 мэкв; nо = 51 - 0,1 = 5,1 мэкв.
После реакции:
nк = 0; nо = (5,1 - 5,0 ) = 0,1 мэкв.
Таким образом, после проведения реакции в растворе останется сильное основание, которое будет определять рН раствора. Расчет ведут по формуле
рН =14 + lg [ОH-]ост = 14 + lg ((сн· V)о - (сн · V)к))/(Vк +Vo);
рН =14 + lg(51 0,1 - 50 0,1)/101 = 11.
Случай c. Количество кислоты и основания до реакции:
nк = сн · V = 50 0,1 = 5 мэкв; nо = 50 0,1 = 5 мэкв.
После реакции:
nк = 0 ; nо = 0.
Кислота и основание взяты в эквивалентных количествах. В растворе будет соль NaCl , которая не подвергается гидролизу, рН =7.
Пример 2. Вычислить значение рН раствора, полученного при сливании 50 мл 0,1н HСООН:
-
с 20мл 0,2 н NaOH;
-
51мл 0,1 н NaOH;
-
50 мл 0,1 н NaOH; рK(НСООН) =3,75.
Решение.
Случай а. Рассчитываем количество кислоты и основания до реакции:
nк = сн· V = 50 0,1 = 5 мэкв; nо= 20 0,2 = 4 мэкв.
Рассчитываем количество кислоты и основания после проведения реакции:
nк = 5 - 4 = 1 мэкв; nо= 0.
Таким образом, после проведения реакции в растворе останется слабая кислота HСООН.
Кроме того, в растворе есть соль слабой кислоты НСООNa, которая вместе с остатком слабой кислоты образует буферную смесь. Количество эквивалентов соли в данном случае в растворе после проведения реакции равно количеству эквивалентов основания, взятого для проведения реакции: nс = nо. В расчетную формулу правомерно можно подставить вместо отношений концентраций кислоты к соли Cк /Сс отношение nк / nс :
рН = рKк - lg cк /cс = 3,75 - lg 1/4 = 4,35.
Случай b. Рассчитываем количество кислоты и основания до реакции:
nк=сн · V = 50 0,1 = 5 мэкв; nо = 51 0,1 = 5,1 мэкв.
После реакции:
nк = 0 ; n о = (5,1 - 5,0 ) = 0,1 мэкв.
Таким образом, после проведения реакции в растворе останется сильное основание, которое будет определять рН раствора. Расчет ведут по формуле
рН =14 + lg(51 0,1 -50 0,1) / 101 = 11.
Случай c. Количество кислоты и основания до реакции:
nк = сн · V = 50 0,1 = 5 мэкв; nо= 50 0,1 = 5 мэкв.
После реакции: nк = 0 ; nо = 0.
Кислота и основание взяты в эквивалентных количествах. В растворе будет соль НСООNa , которая подвергается гидролизу, рН раствора рассчитывается по формуле
рН = 7 + 1/2 рKк + 1/2 lg сс.
Концентрацию соли рассчитывают по формуле
cс = (cн · V)о / (Vк +Vo) = (cн· V)к / (Vк + Vo);
рН = 7 + 1/2 3,75 + 1/2 lg 5/100 =8,225.
Пример 3. Расcчитайте скачок на кривой титрования 20мл 0,1н HNO3 раствором КОН, сн(КОН) =0,2 н; погрешность определения 0,1 %.
Решение. Расчет рН в начале скачка на кривой титрования (рНн.с)
Рассчитывают объем добавленной щелочи в начале скачка(Vн.с.), исходя из того, что в растворе останется 0,1 % неоттитрованной кислоты, т. е. добавлено 99,9 % щелочи. С учетом концентрации щелочи
Vн.с. =(сн· V)к 0,999/сo = 0,1 20 0,999 / 0,2 =9,99 мл.
Расчет рН ведут с использованием формулы
рН = - lg [H+]ост = - lg ((сн· V)к - (н · V)о)) / (Vк +Vo);
рНн.с. = - lg (20 0,1 - 9,99 0,2)/29,99 = 4,2.
Расчет рН в конце скачка на кривой титрования (рНк.с.)
Рассчитывают объем добавленной щелочи в конце скачка (Vк.с.), исходя из того, что раствор кислоты будет перетитрован на 0,1 %, т. е. будет добавлено 100,1 % щелочи. С учетом концентрации щелочи
Vк.с. = (сн· V)к 1,001 / сo = 0,1 20 1,001 / 0,2 =10,01 мл.
Расчет рН ведут с использованием формулы
рН = 14 + lg [ОH-] ост = 14 + lg ((сн· V)о - (сн· V)к)) / (Vк +Vo) ;
рНк.с. = 14 + lg (10,01 0,2 - 20 0,1) / 30,01 = 10,72 .
Пример 4. Расcчитайте скачок на кривой титрования 10 мл 0,1 н НСООН раствором КОН, сн (КОН) = 0,1 н; погрешность определения - 0,2 %.
Решение. Расчет рН в начале скачка на кривой титрования (рНн.с.)
Рассчитывают объем добавленной щелочи в начале скачка(Vн.с.), исходя из того, что в растворе останется 0,2 % неоттитрованной кислоты, т. е. добавлено 99,8 % щелочи. С учетом концентрации щелочи
Vн.с. = (сн· V)к 0,998 / Сo = 0,1 10 0,998 / 0,1 =9,98 мл.
Таким образом, после проведения реакции в растворе останется слабая кислота HСООН в количестве, равном
>nк = 0,1 10 - 0,1 9,98 = 0,002 экв.
Кроме того, в растворе есть соль слабой кислоты НСООNa, которая вместе с остатком слабой кислоты образует буферную смесь. Количество эквивалентов соли в растворе в данном случае (после проведения реакции) равно количеству эквивалентов основания, взятого для проведения реакции: nс = nо. В расчетную формулу правомерно можно подставить вместо отношений концентраций кислоты к соли ск / сс отношение nк / n<с/sub> :
рН = рKк - lg cк / cс = 3,75 - lg (0,1 10 -0,1 9,98) / 0,1 9,98 = 6,45.
Расчет рН в конце скачка на кривой титрования (рНк.c.)
Рассчитывают объем добавленной щелочи в конце скачка(V<к.с./sub>), исходя из того, что раствор кислоты будет перетитрован на 0,2 %, т. е. будет добавлено 100,2 % щелочи. С учетом концентрации щелочи
Vк.с. = (сн· V)к 1,002 / сo = 0,1 10 1,002 / 0,1 = 10,02 мл. ·Расчет рН ведут с использованием формулы
рН =14 + lg [ОH-]ост = 14 + lg ((сн · V)о - (сн · V)к)) / (Vк +V o);
рНк.с.=14 + lg (10,02 0,1 - 10 0,1) / 20,02 = 10.
Общая характеристика метода окислительно-восстановительного титрования
Окислительно-восстановительное титрование (редоксиметрия или оксидиметрия) основано на использовании реакций окисления-восстановления. Окислители титруют восстановителями, а восстановители – окислителями.
При применении окислительно-восстановительных реакций в титриметрическом анализе следует помнить об особенностях их протекания, осложняющих проведение окислительно-восстановительного титрования.
Одной из таких особенностей является обратимость окислительно-восстановительных реакций. Поэтому в некоторых случаях необходимо создавать условия, при которых обратимость реакции будет минимальной. Это удается регулированием рН раствора, как, например, в случае определения мышьяка (3+) иодометрическим методом:
AsO-2
+ I2
+ 2H2O
![]() HAsO2-4
+ 2I-
+ 3H+
HAsO2-4
+ 2I-
+ 3H+
Данная реакция обратима. Чтобы сдвинуть равновесие реакции вправо, титрование арсенитов проводят при рН 8 в присутствии NaHCO3.
В редоксиметрии следует учитывать скорость протекания окислительно-восстановительных реакций. Как известно, медленно протекающие реакции непригодны для титрования, т. к. оно в этом случае затянулось бы и не могло бы быть выполнено достаточно точно.
Скорость реакций окисления-восстановления часто невелика. Поэтому для окислительно-восстановительных процессов важное значение имеет ускорение реакций. Оно может быть достигнуто повышением температуры, изменением концентрации реагирующих веществ, применением катализаторов.
Например, реакция окисления сурьмы (3+) броматом калия в кислой среде при комнатной температуре протекает очень медленно:
BrO-3 + 3[SbCl5]2 + 6H+ + 3Cl-=Br- = 3[SbCl6]- = 3H2O
Поэтому броматометрическое титрование сурьмы (3+) проводят при 70-80 º. В этих условиях скорость реакции значительно увеличивается.
В методе йодометрического титрования медленно протекающая реакция
6I- +Cr2O27 + 14H+ = 3I2 + 2Cr3+ + 7H2O
может быть ускорена повышением концентраций H+- и I --ионов в растворе.
Скорость окислительно-восстановительной реакции может значительно увеличиваться в присутствии катализаторов. Например, для реакции
2Mn2+ + 5S2O2-8 + 8H2O = 2MnO-4 = 10HSO-4 + 6H+
катализатором служат Ag>+-ионы.
Особый вид каталитических явлений состоит в образовании катализатора во время самой реакции окисления-восстановления. Такие процессы называются автокаталитическими.
Так, например, реакция окисления щавелевой кислоты перманганатом протекает очень медленно. При приливании стандартного раствора перманганата титруемый раствор щавелевой кислоты в сернокислой среде долгое время не обесцвечивается, несмотря на большую разность потенциалов:
![]()
Однако по мере накопления Mn2+-ионов окраска раствора, вызываемая MnO-4 -ионами, быстро исчезает вследствие их восстановления оксалат-ионами. Таким образом, Mn2+ -ионы играют роль автокатализатора в данной реакции.
Окислительно-восстановительные процессы могут осложняться протеканием индуцированных (сопряженных) реакций, т. е. таких реакций, которые в измеримой степени протекают в системе под действием другого взаимодействия.
Например, в перманганатометрическом определении железа (2+) в среде соляной кислоты основная реакция
MnO-4 + 5Fe2+ + 8H+ = 5Fe3+ + Mn2+ + 4H2O
индуцирует (вызывает) не протекающую в разбавленных растворах побочную реакцию
2MnO-4 + 10Cl- + 16H+ = 2Mn2+ + 5Cl2 + 8H2O
К индуцированным реакциям можно отнести окисление сульфитов кислородом воздуха в присутствии йода; окисление в кислой среде арсенитов перманганатом в присутствии Mn2+; окисление йодидов нитратами в кислой среде в присутствии цинка; окисление арсенитов броматом калия в присутствии сернистой кислоты и т. д.
Индуцированные реакции могут привести к получению неверных результатов анализа. Поэтому такие реакции стараются подавить или создать условия, препятствующие их протеканию. Так, при определении железа (2+) методом перманганатометрии реакцию титрования проводят в сернокислой среде или добавляют защитную смесь (например, смесь Циммермана-Рейнгардта, состоящую из MnSO4, H2SO4 и H3PO4).
Протекание индуцированных реакций обусловлено тем, что основные реакции обладают сложным механизмом, связанным с образованием промежуточных продуктов, некоторые из которых могут участвовать в побочных реакциях с другими присутствующими веществами.
Во многих случаях механизм индуцированных реакций окончательно не установлен. В настоящее время разработано свыше 50 методов окислительно-восстановительного титрования. Их называют по типу применяемого титранта. Наиболее широкое распространение получили следующие виды редоксиметрии: перманганатометрия – титрант – раствор KMnO4; дихроматометрия – титрант – раствор K2Cr2O7; йодометрия – титрант &nadsh;I2 и Na2S2O3; броматометрия – титрант – раствор KBrO3; цериметрия – титрант – Ce(SO4)2; титанометрия – титрант – TiCl3 и др.
