
- •Дисциплина: Аналитическая химия и фхма
- •1. Основы качественного анализа. Аналитические реакции, их чувствительность и специфичность. Аналитическая классификация катионов и анионов. Дробный и систематический анализ.
- •2. Электролитическая диссоциация. Слабые и сильные электролиты. Константа диссоциации. Состояние сильных электролитов в растворе. Активность, коэффициент активности. Ионная сила раствора.
- •3. Ионное произведение воды, водородный показатель (рН). Расчет рН и рОн в растворах сильных и слабых кислот и оснований.
- •4.Равновесие в гетерогенной системе “осадок - раствор”. Произведение растворимости. Факторы, влияющие на растворимость осадков.
- •5.Равновесие в буферных растворах. Сущность буферного действия. Расчет рН буферных растворов. Буферная емкость.
- •6. Сущность и методы гравиметрического анализа. Свойства осадков механизм их образования и условия осаждения аморфных и кристаллических осадков.
- •7.Соосаждение, его виды. Факторы, влияющие на соосаждение. Очистка осадков от примесей. Осаждаемая и весовая форма, требования к ним.
- •1. Взаимодействующие вещества должны реагировать строго в стехиометрических соотношениях без каких-либо побочных реакций.
- •3. Реакция должна протекать быстро, чтобы в любой момент титрования равновесие устанавливалось практически мгновенно. Иногда для ускорения реакции растворы нагревают или вводят в них катализаторы.
- •I) по характеру реакции протекающие при титрования или по названию титранта
- •II) По способу выполнения различают прямое, обратное титрование и титрование заместителя (метод замещения, косвенное титрование).
- •10. Комплексонометрия: сущность метода, общая характеристика, область применения. Металл – индикаторы, механизм их действия.
- •12. Перманганатометрия: сущность метода, общая характеристика, область применения.
- •13.Йодометрия: сущность метода, общая характеристика, область применения. Условия проведения йодометрических определений.
- •14. Хроматометрия: сущность метода, общая характеристика, достоинства и недостатки. Применения хроматометрии для определения железа в рудах и сплавах.
Дисциплина: Аналитическая химия и фхма
Основы качественного анализа. Аналитические реакции, их чувствительность и специфичность. Аналитическая классификация катионов и анионов. Дробный и систематический анализ.
Электролитическая диссоциация. Сильные и слабые электролиты. Константа диссоциации. Состояние сильных электролитов в растворе. Активность, коэффициент активности. Ионная сила раствора.
Ионное произведение воды, водородный показатель (рН). Расчет рН и рОН в растворах сильных и слабых кислот и оснований.
Равновесие в гетерогенной системе “осадок - раствор”. Произведение растворимости. Факторы, влияющие на растворимость осадков.
Равновесие в буферных растворах. Сущность буферного действия. Расчет рН буферных растворов. Буферная емкость.
Сущность и методы гравиметрического анализа. Свойства осадков механизм их образования и условия осаждения аморфных и кристаллических осадков.
Соосаждение, его виды. Факторы, влияющие на соосаждение. Очистка осадков от примесей. Осаждаемая и гравиметрическая форма, требования к ним.
Титриметрический анализ. Классификация методов титриметрического анализа по характеру протекающих реакций и по способу титрования. Способы приготовления стандартных растворов.
Метод кислотно-основного титрования. Сущность общая характеристика и область применения. Титранты метода. Индикаторы, методы нейтрализации, требования к ним. Интервал перехода индикаторов. Кривые титрования в методе нейтрализации; их построение. Выбор индикаторов.
Комплексонометрия: сущность метода, общая характеристика, область применения. Металл – индикаторы, механизм их действия.
Окислительно-восстановительное титрование: сущность и методы. Окислительно-восстановительный потенциал и направление окислительно-восстановительных реакций. Фиксирование точки конца титрования в методах окислительно-восстановительное титрование. Редокс – индикаторы и требования к ним.
Перманганатометрия: сущность метода, общая характеристика, область применения. Приготовление раствора перманганата калия и его стандартизация.
Йодометрия: сущность метода, общая характеристика, область применения. Титранты методы. Условия проведения йодометрических определений.
Хроматометрия: сущность метода, общая характеристика, достоинства и недостатки. Применения хроматометрии для определения железа в рудах и сплавах.
Теоретические основы фотометрического метода анализа. Аппаратура. Характеристика метода.
Теоретические основы кондуктометрического метода анализа. Аппаратура. Характеристика метода.
Теоретические основы потенциометрического метода анализа. Аппаратура. Характеристика метода.
Теоретические основы полярографисекого метода анализа. Аппаратура. Характеристика метода.
Теоретические основы хроматографического метода анализа. Аппаратура. Характеристика метода.
Теоретические основы гравиметрического метода анализа. Аппаратура. Характеристика метода.
1. Основы качественного анализа. Аналитические реакции, их чувствительность и специфичность. Аналитическая классификация катионов и анионов. Дробный и систематический анализ.
Основы качественного анализа. Аналитические реакции, их чувствительность и специфичность.
Обычно исследуемое вещество переводят в раствор и подвергают систематическому, химическому анализу с помощью аналитических реакций.
Аналитические реакции должны обладать внешним эффектом, изменение окраски раствора, выделение осадка определенного цвета и структуры или выделение газа.
Так как большинство неорганических веществ в растворах дисоцируются на ионы, то анализ сводится к обнаружению этих ионов.
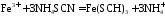 -
аналитическая реакция
-
аналитическая реакция
Fe3+ - открытый ион; Fe(SCN)3 – красный раствор; NH4SCN – реагент.
Не все реакции, сопровождающиеся внешним эффектом, могут использоваться в анализах. Аналитическая реакция должна удовлетворять требованиям специфичности и чувствительности.
Специфичными называются реакции и реагенты с помощью которых можно обнаруживать данный ион в присутствии любых других ионов.

 -
красный раствор
-
красный раствор
Специфичных реакций и реагентов сравнительно немного, чаще используются селективные или групповые реагенты, которые дают сходные внешние эффекты с небольшим числом ионов.

Аналитическая реакция должна давать возможность обнаружить в растворе очень небольшое количество вещества. Если реакция происходит даже в присутствии ничтожно малой концентрации определенного иона, она называется чувствительной.
Количественно-чувствительная реакция – выражается 3 взаимосвязанными параметрами:
1) открываемый минимум – наименьшее количество вещества, которое может быть обнаружено с помощью данной реакции при определенных условиях:
К+ K2[PtCl6] m=5 мкг
2) открываемая минимальная концентрация – показывает, при какой наименьшей концентрации раствора данная реакция позволяет обнаружить ион из небольшой порции раствора. Минимальная концентрация выражается отношением массы определяемого вещества, к массе или объему раствора [Сmin , г/см3 (г/г)]
K2[PtCl6] Сmin=1:10000
3) предельное разбавление (Wпред) – это величина обратная минимальной концентрации и выражается числом миллилитров раствора, содержащего 1 грамм определяемого иона, который можно обнаруживать с помощью данной реакции.

 -
это минимальный объем раствора необходимый
для обнаружения ионов
-
это минимальный объем раствора необходимый
для обнаружения ионов
(1 капля = 0,02-0,05 мл)
При выполнении аналитических реакций следует соблюдать определенные условия, важнейшими из которых являются концентрация раствора, температура и рН.
Еще одно условие выполнения аналитических реакций является качество применяемых реактивов. На производстве и в лаборатории используют реактивы следующей классификации: технически чистые (ч), чистые для анализа (ч.д.а.), химически чистые (х.ч.), особо чистые, оптически чистые, спектроскопически чистые. Для химического анализа используют х.ч. и ч.д.а.
Аналитическая классификация ионов. Для удобства обнаружения ионов их делят на аналитические группы. Ионы одной группы обладают сходными аналитическими свойствами и можно перевести в осадок и отделить от ионов других групп, действием группового реагента.
Аналитическая классификация катионов. В соответствии с классическим сероводородным методом катионы делят на 5 аналитических групп в зависимости от свойств их сульфидов, гидроксидов и карбонатов.
|
№ группы |
Катионы |
Групповой реагент |
Осадок |
|
1 |
Li+,Na+,K+,Rb+,Cs+,Fr+,NH4+,Mg2+ |
- |
- |
|
2 |
Ca2+, Sr2+, Ba2+, Ra2+. |
(NH4)2CO3 в присутствии NH4Cl |
карбонаты MeCO3,белые кристаллические осадки. |
|
3 |
Be2+, Al3+, Zn2+, Cr3+, Fe2+ ,Fe3+, Mn2+, Co2+, Ni2+ и др. |
(NH4)2S |
гидроксиды Be, Al, Cr, сульфиды – остальные. |
|
4 |
Hg2+, Cu2+, Cd2+, Ge4+, As3+, As5+,Sb3+,Sb5+, Bi3+, Sn2+, Sn4+, Pb2+. |
H2S кислая среда |
сульфиды |
|
5 |
Hg22+,Cu+, Ag+, Au+ |
HCl |
хлориды |
Аналитическая классификация анионов. Чаще всего анионы делят на 3 аналитические группы в зависимости от отношения к солям бария Ва2+ и серебра Ag+.
|
№ |
Анионы |
|
|
1 |
SO42-, SO32-, S2O32-, CO32-, SiO32-, PO43- и др. |
Соли Ва не растворяются в воде. Групповой реагент BaCl2 в нейтральной или слабощелочной среде |
|
2 |
Сl-, Br-, J-, F-,S2-, CN-, SCN- |
Соли Ag не растворимые в воде. Групповой реагент AgNO3 в присутствии HNO3 |
|
3 |
NO3-, NO2-, CH3COO-, MnO4- |
Соли бария и серебра растворяются в воде; группового реагента нет |
Дробный и систематический анализ. Дробным анализом называется обнаружение ионов в отдельных небольших порциях раствора с помощью специфических реакций, при этом последовательность обнаружения может быть произвольной:

При химическом анализе, часто одни ионы мешают обнаружению других.
Систематический анализ это определенная последовательность выполнения аналитических реакций при которой каждый ион обнаруживается после того как обнаружены и удалены из раствора все мешающие ионы.
Пример: раствор с ионами Ca2+, Sr2+, Ва2+.
1) в отдельной небольшой порции раствора обнаруживают ион Ва2+ действием K2CrO4 в уксуснокислой среде:
Ва2+ + CrO42- = BaCrO4 ↓(желт. кристалл. осадок)
2) при обнаружении ионов Ва2+ его осаждают из всей порции раствора по той же реакции;
3) обнаруживают ион Sr2+ действием (NH4)2SO4:
Sr2+ + SO42- = SrSO4↓ (белый, кристалл. осадок)
4) при обнаружении иона Sr2+ его осаждают из всей порции раствора по той же реакции;
5) обнаруживают ионы Са2+ действием H2C2O4:
Са2++ С2О42- = СаС2О4↓ (оксалат кальция; кристалл. осадок).
