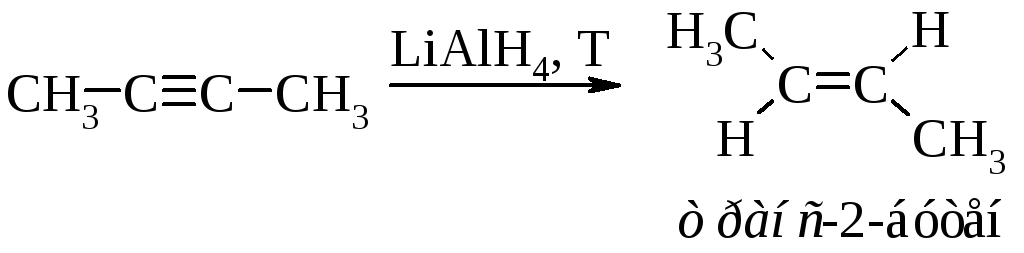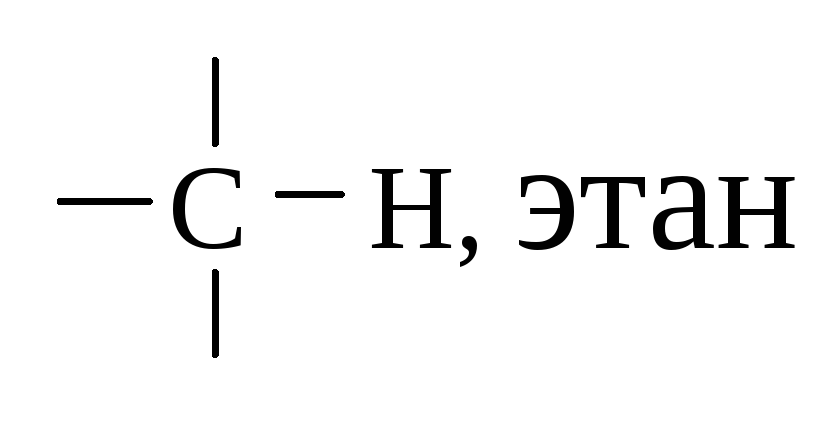- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
Характеристики химических связей в молекуле алкинов
|
Соединение |
Связи между атомами С |
Связи С–Н | ||||||||
|
СС |
С–С |
Н–С |
Сsp3–Н | |||||||
|
l102, нм |
Е, кДж/моль |
l102, нм |
Е, кДж/моль |
l102, нм |
Е, кДж/моль |
, Д |
l102, нм |
Е, кДж/моль |
, Д | |
|
НСС–СН3 |
12,0 |
828 |
14,6 |
347 |
10,6 |
464 |
1,1 |
11,0 |
355 |
0,3 |
Особый интерес представляет связь С-Н. Эта связь короче и прочнее аналогичных связей углерод-водород в алкенах и алканах (табл. 5.2).
Таблица 5.2
Характеристики связей с-н в алканах, алкенах и алкинах
|
Углеводород |
Длина, l102, нм |
Энергия Е, кДж/моль |
Доля s-орбитали атома углерода, % |
Дипольный момент , Д |
|
|
11,0 |
405 |
25,0 |
0,3 |
|
|
10,9 |
435 |
33,3 |
0,6 |
|
|
10,6 |
464 |
50,0 |
1,08 |
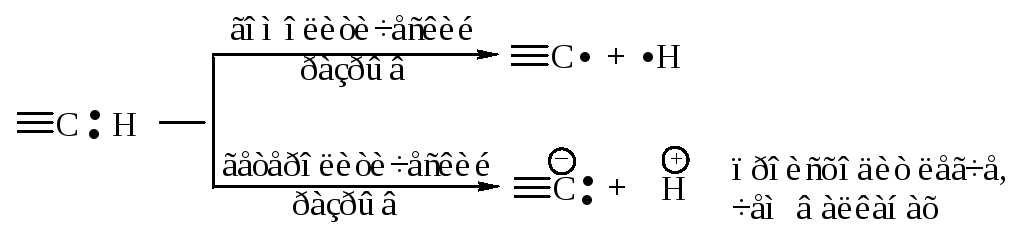
Связь С–Н имеет заметную полярность, связанную с большей долей s-состояния гибридной орбитали и, вследствие этого, с большей близостью электронной пары связи С–Н к углероду.

В результате смещения электронного облака -связи от атома водорода к атому углерода атом водорода становится отчасти положительно заряженным - кислотным.
Энергия диссоциации связи углерод-водород в ацетилене С–Н больше, чем в этилене; sp-гибридизация затрудняет гомолитический разрыв связи С–Н с образованием радикалов, но облегчает гетеролитический разрыв этой связи с образованием ионов.
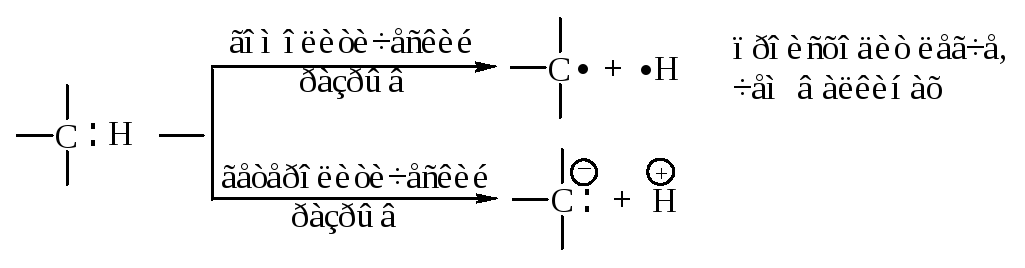
5.2. Физические свойства
Алкины малополярные соединения, их физические свойства сходны со свойствами алканов и алкенов: они также нерастворимы в воде, но растворимы в таких органических растворителях, как эфир, четырёххлористый углерод, бензол; плотность их меньше плотности воды. Низшие алкины - газы; температуры кипения алкинов повышаются с увеличением числа атомов углерода; разветвление цепи в молекуле изомера понижает температуру кипения.
Отличительным свойством ацетилена и его гомологов с одной алкильной группой является поглощение в области 3300 см-1 , соответствующее валентным колебаниям (С–Н). Увеличение частоты в ряду (Сsp3 –H), (Сsp2 –H), (Сsp –H) объясняется увеличением доли s-состояния гибридных орбиталей атомов углерода, образующих связи С–Н, при этом связь С–Н становится более короткой, прочной и более жёсткой.
Благодаря наличию частичных положительных зарядов на атомах водорода групп С–Н между атомом водорода ацетилена и атомами кислорода и азота других органических соединений (кетонов, эфиров, аминов) возникает сильное диполь-дипольное взаимодействие.

Поэтому ацетилен достаточно хорошо растворим в полярных органических растворителях.
5.3. Химические свойства
Химические свойства алкинов обусловлены их способностью реагировать двумя путями:
1). Посредством раскрытия кратной связи - реакции присоединения;
2). Посредством замещения атома водорода при углероде с тройной связью.
5.3.1. Реакции присоединеня
5.3.1.1. Каталитическое гидрирование и восстановление
Гидрирование алкинов и алкенов протекает примерно в одних и тех же условиях. Каталитическое гидрирование алкинов в присутствии таких катализаторов, как никель, платина, палладий, происходит с образованием алкана.
![]()
Можно подобрать условия, в которых каталитическое присоединение водорода к алкинам может происходить в одну стадию с образованием алкена.
![]()
При этом используют специальные “отравленные” катализаторы – катализаторы с пониженной активностью. Примером такого катализатора является палладий, нанесенный на карбонат кальция и дезактивированный ацетатом свинца. Это катализатор Линдлара, который позволяет восстанавливать алкины до алкенов, предотвращая дальнейшее восстановление до алкана. Гидрирование на этом катализаторе протекает стереоселективно с образованием до 96 % цис-алкенов и 5-10 % транс-алкена.
-
Реакция, предпочтительно приводящая к одному из нескольких возможных пространственных изомеров, называется стереоселективной
Восстановление алкинов в жидком аммиаке ведёт преимущественно к образованию транс-алкена.
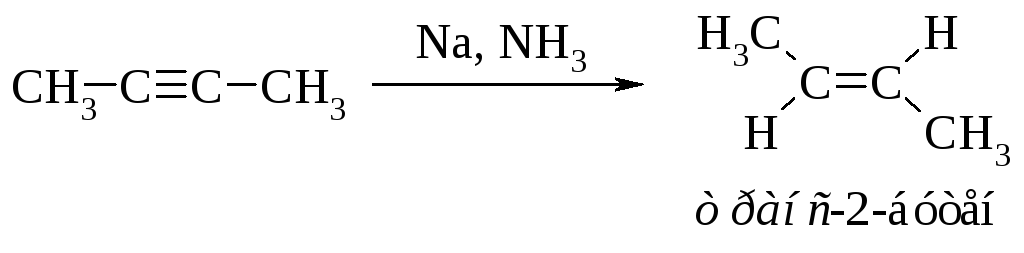
Это объясняется тем, что реакция протекает через образование более устойчивого (пространственно незатруднённого) радикала.
Сначала натрий отдает электрон углероду тройной связи и образуется анион-радикал.
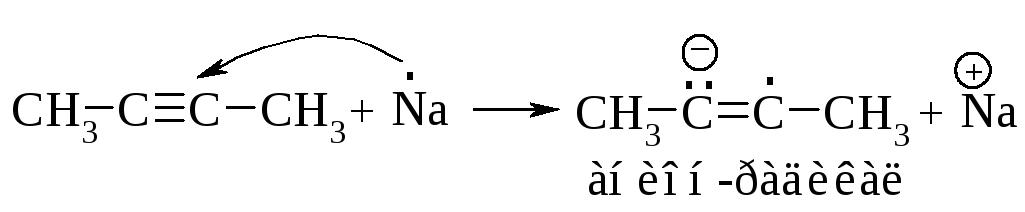
Затем анион-радикал взаимодействует с аммиаком и образуется радикал.
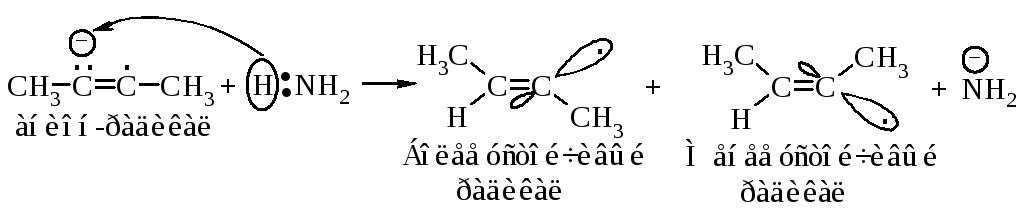
Реакция завершается переносом электрона от натрия и взаимодействием образовавшегося аниона с аммиаком.
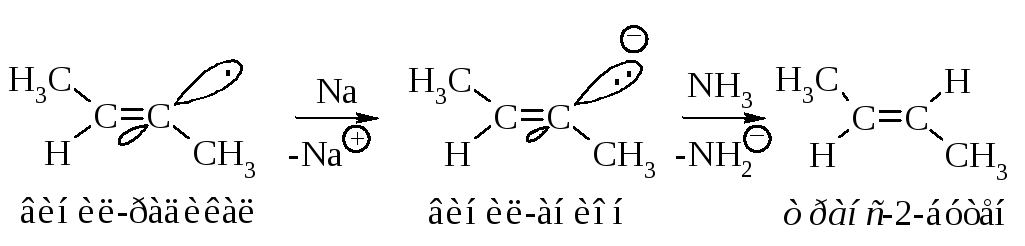
Таким же образом алкины восстанавливаются литийалюминийгидридом.