
- •I семестр Тема № 1.
- •1. Предмет патофизиологии: определение, задачи.
- •2. Методы патофизиологии характеристика, возможности и ограничения.
- •Структура патофизиологии как науки и учебной дисциплины.
- •Определение понятий: болезнь, норма.
- •6. Стадии и исходы заболеваний.
- •7. Классификации болезней.
- •8. Общая этиология: значение болезнетворных факторов и условий в возникновении болезней.
- •Общий патогенез: соотношение местного и общего, специфические и неспецифические механизмы патогенеза, порочный круг.
- •Основные этапы развития патофизиологии. Роль отечественных и зарубежных ученых в развитии патофизиологии.
- •1. Болезнетворное действие звука и шума.
- •4. Болезнетворное действие лучей солнечного спектра.
- •5. Болезнетворное действие лазерного излучения.
- •6. Повреждающее действие механических воздействий.
- •7. Повреждающее действие электрического тока.
- •Тема № 2. Патогенное действие на организм
- •1. Общая характеристика повреждающего действия ионизирующих излучений.
- •2. Механизм действия ионизирующей радиации на организм.
- •3. Действие ионизирующей радиации на клетки.
- •Действие ионизирующей радиации на организм.
- •Острая лучевая болезнь: патогенез, проявление, стадии течения, исходы.
- •6. Хроническая лучевая болезнь: патогенез, проявления, исходы.
- •7. Реактивность, виды реактивности. Резистентность.
- •1. Наследственные болезни: определение, механизмы стабильности и изменчивости генотипа.
- •3. Классификации наследственных форм патологии.
- •Пути реализации действий аномального гена: патогенез, клинические примеры.
- •Хромосомные заболевания: этиология, патогенез, характеристика кариотипа, фенотипические проявления.
- •Методы изучения наследственных болезней: характеристика, примеры клинической интерпретации. Принципы лечения и профилактики наследственных болезней.
- •7. Роль конституции в патологии, конституционные типы. 8. Диатез, определение, классификация, виды, роль в патологии.
7. Повреждающее действие электрического тока.
Факторы, определяющие степень тяжести электротравмы. Механизм повреждающего воздействия, местные и общие реакции.
Причины смерти.
Электричество: природное (молния) и техническое. Патогенное воздействие электрического тока - электротравма.
Зависит от факторов, определяющих степень тяжести электротравмы.
Факторы, определяющие степень тяжести электротравмы. Вид тока: переменный, постоянный.
Сила тока: при одной и той же силе переменный ток более опасен, чем постоянный. Ток силой 100 мА является смертельно опасным.
Напряжение постоянного тока: до 40 В не вызывает летальных повреждений; 1000 В - летальность 50%; 30 000 В - летальность 100%.
Напряжение переменного тока: до 450-500 В переменный ток более опасен, чем постоянный, при 42,5 В опасность эквивалентна постоянному при 120 В.
Сопротивление тканей (импеданс): активное (омическое) и реактивное (емкостное). Наибольшее сопротивление - эпидермальный слой кожи, затем - сухожилия, кости, нервы, мышцы, кровь.
Наименьшее - спинномозговая жидкость.
Влажность кожи уменьшает сопротивление.
Направление прохождения тока через тело: восходящее и нисходящее.
Восходящее: анод ниже, чем катод. Синусовый узел - под возбуждающим действием катода, а верхушка - под подавляющим действием анода. Импульс из синусового узла сталкивается на пути с торможением проводимости, что приводит к фибрилляции при замкнутой цепи.
Нисходящее: синусовый узел подавлен анодом. Волна возбуждения из него усиливается катодом и фибрилляция возникает только в момент размыкания цепи.
Фактор времени: зависимость прямо пропорциональная.
Частота переменного тока: постоянный патологический эффект наблюдается при частоте переменного тока до 40-60 ГЦ.
1 000 000 Гц - переменный ток с такой частотой не является патогенным. Напротив, при высоком напряжении оказывает тепловой воздействие (дарсонвализация, диаметрические токи).
Состояние реактивности организма: устойчивость к электротравме снижается при утомлении, ослаблении внимания, алкогольном опьянении, гипоксии, тиреотоксикозе, заболеваниях сердца и сосудов. Степень травмы утяжеляется в состоянии ожидания действия тока, наркоза, опьянения.
Механизм повреждающего воздействия, местные и общие реакции: местные и общие изменения.
Местные реакции. Знаки тока и ожоги.
Знаки тока - небольшие образования сероватого цвета, твердые, окаймленные волнообразным возвышением. По окружности - ветвистый рисунок красного цвета, обусловленный параличом кровеносных сосудов. Образуются в местах входа и выхода тока в результате превращения электрической энергии в тепловую.
Ожоги - контактные и термические. Общие реакции:
возбуждение рецепторов;
возбуждение скелетной и гладкой мускулатуры; 3) возбуждение железистой ткани.
Отсюда тонические судороги, возможны переломы и вывихи конечностей, спазм голосовых связок, остановка дыхания, повышение АД, непроизвольное мочеиспускание и дефекация. Сопровождается выбросом катехоламинов (адреналин и норадреналин). Оказывает электрохимическое действие.
Электрохимическое действие: на участке тканей у анода скапливаются положительные ионы и формируется кислая реакция. Отрицательные ионы скапливаются у катода и возникает щелочная реакция.
Под анодом - коагуляция белка и коагуляционный некроз.
Под катодом - набухание коллоидов и колликвационный некроз. Причины смерти: остановка дыхания и сердца.
Остановка дыхания: = поражение ДЦ;
= спазм позвоночных артерий;
= спазм дыхательной мускулатуры;
= ларингоспазм, нарушение проводимости дыхательных путей. Остановка сердца: = фибрилляция желудочков;
= спазм коронарных сосудов;
= поражение сосудодвигательного центра; = повышение тонуса блуждающего нерва.
Учебник:
Электрическим током называют упорядоченное движение заряженных частиц.
Человек подвергается действию природного (молния) или технического электричества. Разряды молнии действуют как кратковременное (доли секунды, секунды) прохождение через тело человека тока огромного напряжения (до миллионов вольт). Смерть наступает от паралича сердца и (или) дыхания. В результате теплового действия молнии на теле остаются ожоги, кровоизлияния в виде особых ветвистых «фигур», почернение и некроз тканей; возможно и механическое действие - отрыв тканей и даже частей тела.
Патогенное действие технического электричества (электротравма - повреждение, вызванное воздействием электрического тока или электрической дуги). В зависимости от вида тока (постоянный или переменный), его силы, напряжения, направления и длительности действия, а также от сопротивления тканей и состояния реактивности организма в целом электротравма может проявляться в диапазоне от незначительных болевых ощущений до обугливания тканей и смерти.
Сила тока. При одной и той же силе переменный ток (периодически изменяющий свое направление в цепи) более опасен, чем постоянный (табл. 2-3). Ток силой 100 мА является смертельно опасным. Переменный ток 50-60 Гц силой 12-25 мА вызывает судороги («неотпускающий»); основная опасность его заключается в «приковывании» пораженного к захваченному им токоведущему предмету. Напряжение - это величина, численно равная работе, совершаемой при перемещении единичного положительного заряда на участке электрической цепи.
Напряжение действующего на организм источника тока до 40 В смертельных поражений не вызывает, при напряжении 1000 В летальность достигает 50%, при напряжении 30 000 В - 100%. Опасность поражения переменным током при напряжении 42,5 В равна опасности поражения постоянным током при напряжении 120 В. Однако постоянный ток менее опасен, чем переменный, только до напряжения 450-500 В. При более высоком напряжении постоянный ток становится более опасным, чем переменный (см. табл. 2-3).

Сопротивление тканей (величина, характеризующая противодействие участка тела человека электрическому току) обусловлено преобразованием электрической энергии в другие виды энергии. Суммарное (полное) сопротивление тела человека к переменному электрическому току называется импедансом и складывается из активного (омического) и реактивного (емкостного) сопротивления тканей. Наибольшим сопротивлением электрическому току обладает наружный эпидермальный слой кожи (до 2 000 000 Ом), далее по убывающей следуют сухожилия, кости, нервы, мышцы, кровь. Наименьшим сопротивлением обладает спинно-мозговая жидкость. Общее сопротивление тела человека составляет в среднем 100 000 Ом (от 1000 до миллионов Ом). Сопротивление кожи снижается при ее увлажнении, а также при повышении силы и напряжения тока. Ток напряжением 10-40 В вызывает пробой эпидермиса; при увеличении напряжения до 220 В сопротивление резко снижается, приближаясь к сопротивлению кожи, лишенной наружного эпидермального слоя.
Направление прохождения электрического тока через тело. Восходящий постоянный ток опаснее нисходящего, поскольку возбуждение, поступающее из синусового узла, сталкивается с встречной волной электрического тока, что вызывает остановку сердца или фибрилляцию желудочков. При нисходящем токе волна возбуждения, исходящая из синусового узла, усиливается электрическим током, при этом в момент размыкания цепи возможно возникновение фибрилляции сердца. Асинхронное возбуждение мышечных волокон объясняется тем, что после отключения источника электричества исчезающее электромагнитное поле, рассеиваясь в пространстве, будет индуцировать токи различной силы в кардиомиоцитах. В участках сердца, находящихся в центре магнитных линий, будет индуцироваться более сильный ток, а его направление будет таким же, каким оно было в момент размыкания цепи.
Фактор времени. С увеличением времени прохождения через тело патогенный эффект действия электрического тока возрастает. Так, если действие тока напряжением 1000 В в течение 0,02 с не сопровождается развитием выраженных нарушений, то при экспозиции в 1 с оно неизбежно приводит к смертельному исходу.
Частота переменного тока. Считается, что патогенным эффектом (возникновение фибрилляции желудочков) обладает переменный ток частотой 40-60 Гц. Переменные токи частотой 1 000 000 Гц и выше не опасны, но при высоком напряжении (токи Тесла, д'Арсонваля, диатермические токи) они оказывают тепловое действие и применяются с лечебной целью.
Состояние реактивности организма. Утомление, ослабление внимания, легкое и умеренное алкогольное опьянение, гипоксия, перегревание, тиреотоксикоз, сердечно-сосудистая недостаточность снижают резистентность организма к электротравме. Тяжесть поражения электротравмой в значительной степени снижается при эмоциональном напряжении, вызванном ожиданием действия тока, в состоянии наркоза и глубокого (близкого к наркозу) опьянения.
Механизмы повреждающего действия электрического тока. Электротравма может вызвать местные (знаки тока, ожоги) и общие изменения в организме. Местные реакции на электротравму. Знаки тока, ожоги возникают главным образом на местах входа и выхода тока в результате превращения электрической энергии в тепловую (тепло ДжоуляЛенца). Знаки тока появляются на коже, если температура в точке прохождения тока не превышает 120 °С, и представляют собой небольшие образования серовато-белого цвета («пергаментная» кожа), твердой консистенции, окаймленные волнообразным возвышением. В ряде случаев по окружности поврежденной ткани проступает ветвистый рисунок красного цвета, обусловленный параличом кровеносных сосудов.
При температуре в точке прохождения тока свыше 120 °С возникают ожоги: контактные - от выделения тепла при прохождении тока через ткани, оказывающие сопротивление, и термические - при воздействии пламени вольтовой дуги. Последние являются наиболее опасными.
Общие реакции организма на электротравму. При прохождении через тело электрический ток вызывает возбуждение нервных рецепторов и проводников, скелетной и гладкой мускулатуры, железистых тканей. Это приводит к возникновению тонических судорог скелетных и гладких мышц, что может сопровождаться отрывным переломом и вывихом конечностей, спазмом голосовых связок, остановкой дыхания, повышением кровяного давления, непроизвольным мочеиспусканием и дефекацией. Возбуждение нервной системы и органов внутренней секреции приводит к «выбросу» катехоламинов (адреналин, норадреналин), изменяет многие соматические и висцеральные функции организма.
Большое значение в механизмах поражающего эффекта электрического тока имеет его электрохимическое действие (электролиз). Преодолев сопротивление кожного покрова, электрический ток вызывает нарушение равновесия в клетках различных тканей, изменяет их биологический потенциал, приводит к поляризации клеточных мембран: на одних участках тканей - у анода - скапливаются отрицательно заряженные ионы (возникает щелочная реакция), у катода скапливаются положительно заряженные ионы (возникает кислая реакция). В результате значительным образом изменяется функциональное состояние клеток. Вследствие передвижения белковых молекул в участках кислой реакции под катодом возникает коагуляция белков (коагуляционный некроз), в участках щелочной реакции под анодом - набухание коллоидов (колликвационный некроз). Процессы электролиза в кардиомиоцитах вызывают укорочение рефрактерной фазы сердечного цикла, что приводит к нарастающей тахикардии. При несмертельной электротравме возникает судорожное сокращение мышц с временной потерей сознания, нарушением сердечной деятельности и (или) дыхания; может наступить клиническая смерть. При своевременном оказании помощи пострадавшие ощущают головокружение, головную боль, тошноту, светобоязнь; могут сохраняться нарушения функций скелетной мускулатуры.
Непосредственными причинами смерти при электротравме являются остановка дыхания и остановка сердца. Поражение дыхательного и сосудодвигательного центров обусловлено деполяризацией клеточных мембран и коагуляцией белков цитоплазмы.
Остановка дыхания может быть обусловлена: 1) поражением дыхательного центра; 2) спазмом позвоночных артерий, снабжающих кровью дыхательный центр; 3) спазмом дыхательной мускулатуры; 4) нарушением проходимости дыхательных путей вследствие ларингоспазма.
Остановка сердца может возникнуть вследствие: 1) фибрилляции желудочков; 2) спазма коронарных сосудов; 3) поражения сосудодвигательного центра; 4) повышения тонуса блуждающего нерва. 8. Повреждающее действие перегрузок и факторов космического полета.
Перегрузки - это результат влияния на организм ускорения. Наблюдаются на активных участках полета космического корабля (взлет, посадка). Направлены в сторону, противоположную движению.
Классификация:
= по длительности - длительные (более 1 сек) и ударные (менее 1 сек)
= по скорости и характеру нарастания - равномерные, пикообразные и т.д.
= по отношению к оси тела человека - а) продольные и поперечные; б) положительные и отрицательные.
Последствия:
= перемещение и перераспределение массы крови;
= нарушение оттока лимфы;
= смещение органов и мягких тканей.
Наиболее страдающие системы - ССС, дыхательная и нервная.
Поперечные перегрузки приводят к нарушению кровообращения в сосудах легких, механическому сжатию отдельных участков легких, нарушению кровообращения в малом круге, снижен6ию оксигенации крови.
Продольные перегрузки положительные - от головы к ногам, движение вверх. Масса крови стремится в нижние отделы туловища. Затрудняется венозный приток к правому сердцу, уменьшается кровенаполнение полостей, УО и МОК. Уменьшается кровенаполнение краниальных сосудов, возможно нарушение зрения в виде пелены. Сниженное АД раздражает синокаротидные зоны, появляется тахикардия, даже аритмия. Возможны нарушения дыхания и боли в эпигастрии.
Продольные перегрузки отрицательные - от ног к голове, движение вниз. Масса крови стремится вверх. Происходит переполнение кровью сосудов головы. АД в области синокаротидных зон повышается и рефлекторно замедляется ЧСС, возможны аритмии. Сильные болевые ощущения в голове и глазах, кровоизлияния в склеру и веки.
Тема № 3.
ПОВРЕЖДЕНИЕ КЛЕТКИ
1. Виды и причины повреждений клетки по их природе и происхождению
Повреждение клетки - типический патологический процесс, основу которого составляют нарушения внутриклеточного гомеостаза, приводящие к нарушению структурной целостности клетки и ее функциональных способностей после удаления повреждающего агента. Так, например, на первом этапе нарушение функционирования клетки, вызванное действием неблагоприятных факторов, например недостатком кислорода или действием токсических соединений, может и не привести к повреждению клетки: как только восстановятся нормальные окружающие условия, клетка вновь вернется в состояние, близкое к исходному. Например, если в каком-нибудь участке миокарда кровоснабжение прекращается на короткий промежуток времени (не более 10-15 мин), а затем восстанавливается, то кардиомиоциты сохраняют способность к регенерации и нормальному функционированию. Если кровоснабжение не восстанавливается, то повреждение миокарда становится необратимым и кардиомиоциты на этом участке погибают.
Различают непосредственное (первичное) и опосредованное (вторичное) повреждения. Последнее возникает как следствие первичных нарушений постоянства внутренней среды организма.
В зависимости от скорости развития и выраженности основных проявлений повреждение клетки может быть острым и хроническим.
Острое повреждение развивается быстро, как правило, в результате однократного, но интенсивного повреждающего воздействия, в то время как хроническое повреждение протекает медленно и является следствием многократных, но менее интенсивных патогенных влияний.
В зависимости от периода жизненного цикла, на который приходится действие повреждающего агента, повреждение клетки может быть митотическим и интерфазным.
В зависимости от степени нарушения внутриклеточного гомеостаза повреждение бывает обратимым и необратимым (см. выше).
Выделяют два патогенетических варианта повреждения клеток:
Насильственный. Развивается в случае действия на исходно здоровую клетку физических, химических и биологических факторов, интенсивность которых превышает обычные возмущающие воздействия, к которым клетка адаптирована. Наиболее чувствительны к данному варианту повреждения функционально малоактивные клетки, обладающие малой мощностью собственных гомеостатических механизмов.
Цитопатический. Возникает в результате первичного нарушения защитно-компенсаторных гомеостатических механизмов клетки. В этом случае фактором, запускающим патогенетические механизмы повреждения, являются естественные для данной клетки возмущающие стимулы, которые в этих условиях становятся повреждающими. К цитопатическому варианту относятся все виды повреждения клетки, возникающего вследствие отсутствия какихлибо необходимых ей компонентов (гипоксическое, нервнотрофическое, при голодании, гиповитаминозах, недостаточности антиоксидантной системы, генетических дефектах и др.). К цитопатическому повреждению наиболее чувствительны те клетки, реактивность, а следовательно, и функциональная активность которых в естественных условиях очень высоки (нейроны, кардиомиоциты).
Причинами повреждения клеток могут быть следующие факторы: гипоксия. Чрезвычайно важная и распространенная причина повреждения клеток. Уменьшение кровообращения (ишемия), возникающее при атеросклерозе, тромбозе, сдавлении артерий, является основной причиной гипоксии. Другой причиной может быть недостаточная оксигенация крови при сердечно-сосудистой или легочной патологии. Третьей причиной может являться нарушение транспорта кислорода, например при анемии, отравлении окисью углерода или действии метгемоглобинобразователей (нитраты и нитриты, хлорноватые и хлорноватистые соли, феррицианиды, лекарственные вещества - фенацетин, амидопирин, сульфаниламиды и др.) (подробнее см. раздел 16.2);
физические агенты - механическая травма, температурные воздействия, колебания барометрического давления, ионизирующая и ультрафиолетовая радиация, электрический ток;
химические агенты и лекарства. Повреждение клеток может быть вызвано как жизненно необходимыми химическими соединениями, такими, как, например, глюкоза или поваренная соль в гипертонических концентрациях, кислород в высоких концентрациях. Вещества, известные как яды (в частности, мышьяк, цианиды, соли ртути), могут вызывать гибель клеток в считанные минуты или часы. Гибель клеток может наступать при действии факторов внешней среды, «социальных» факторов - алкоголя, курения, наркотиков и др.;
иммунологические реакции. Хотя иммунные реакции защищают организм от воздействия биологических агентов, в ряде случаев (аллергия, аутоиммунные реакции) они могут обусловливать повреждение клеток;
генетические повреждения (например, наследственные мембранопатии, энзимопатии и др.);
дисбаланс питания.
2. Нарушение энергетического обеспечения процессов, протекающих в клетке: этиология, патогенез, последствия.
Энергетическое обеспечение клеток осуществляется за счет АТФ, образующейся преимущественно в процессе окислительного фосфорилирования в митохондриях и в меньшей мере — в реакциях гликолиза в цитозоле.
Энергоснабжение клетки может расстраиваться на любом из этапов: ресинтеза, транспорта и утилизации энергии АТФ
Нарушения ресинтеза АТФ. Ресинтез АТФ может расстраиваться в результате дефицита кислорода и/или субстратов метаболизма, снижения активности ферментов тканевого дыхания и гликолиза, повреждения и разрушения митохондрий, в которых осуществляются реакции цикла Кребса и перенос электронов к молекулярному кислороду, сопряженный с фосфорилированием АДФ.
Расстройства транспорта энергии. Заключенная в макроэргических связях энергия АТФ в норме доставляется от мест ресинтеза — митохондрий и цитозоля к эффекторным структурам (миофибриллам, мембранным ионным насосам и др.) с помощью АДФ-АТФ-транслоказы (адениннуклеотидилтрансферазы) и КФК. Адениннуклеотидилтрансфераза обеспечивает транспорт энергии макроэргической фосфатной связи АТФ из матрикса митохондрий через их внутреннюю мембрану, а КФК переносит ее далее на креатин с образованием креатинфосфата, который поступает в цитозоль (рис. 5-3). КФК эффекторных клеточных структур транспортирует фосфатную группу креатинфосфата на АДФ с образованием АТФ, который и используется в процессах жизнедеятельности клетки.
Системы транспорта энергии могут быть повреждены различными патогенными агентами, в связи с чем (даже на фоне высокого общего содержания АТФ в клетке) может развиваться дефицит АТФ в энергорасходующих структурах.
Расстройство утилизации энергии. Нарушения энергообеспечения клеток и расстройства их жизнедеятельности могут развиваться в результате повреждения механизмов утилизации энергии, главным образом, за счет уменьшения активности АТФаз [АТФаза миозина, Na+,K+-АТФаза плазмолеммы, протонная и калиевая АТФаза, Са2+-АТФаза (Са2+-насос) и др.]. Следовательно, расстройство жизнедеятельности клеток может развиваться даже в условиях нормального или повышенного содержания в клетке АТФ.
Нарушение энергообеспечения, в свою очередь, может стать одним из факторов расстройств функции мембранного аппарата клеток, их ферментных систем, процессов транспорта ионов и воды, а также механизмов регуляции клетки.
Повреждение мембран и ферментов клетки
Повреждение клеточных мембран и ферментов играет существенную роль в расстройстве жизнедеятельности клетки, а также, что особенно важно, в переходе обратимых изменений в ней в необратимые.
Основные механизмы повреждения клеточных мембран приведены на рисунке 5-4. Все указанные механизмы прямо или опосредованно ведут к повреждению, изменению конформации и/или кинетических свойств ферментов, многие из которых связаны с мембранами.
Свободнорадикальные реакции
Свободнорадикальные процессы и реакции СПОЛ — необходимое звено таких жизненно важных процессов, как транспорт электронов в цепи дыхательных ферментов, синтез ПГ и лейкотриенов, пролиферация и дифференцировка клеток, фагоцитоз, метаболизм катехоламинов и др.
В реакции СПОЛ могут вовлекаться белки, нуклеиновые кислоты, липиды, в особенности фосфолипиды. СПОЛ важна для регуляции липидного состава биомембран и активности ферментов. Последнее является результатом как прямого действия продуктов липопероксидных реакций на ферменты, так и опосредованного — через изменение состояния мембран, с которыми ассоциированы молекулы многих ферментов.
Интенсивность СПОЛ регулируется соотношением факторов, активирующих (прооксидантов) и подавляющих (антиоксидантов) этот процесс (рис. 5-5). К числу наиболее активных прооксидантов относят легко окисляющиеся соединения, индуцирующие появление свободных радикалов, в частности нафтохиноны, витамины A и D, восстановители — НАДФН2, НАДН2, липоевая кислота, продукты метаболизма ПГ и катехоламинов.
Этапы СПОЛ. Процесс липопероксидации можно условно разделить на 3 этапа (см. рис. 5-6 и рис. 5-7):
![]() —
образование активных форм кислорода);
—
образование активных форм кислорода);
![]()
(свободнорадикальный этап);
![]() (перекисный этап).
(перекисный этап).
Активные формы кислорода. Начальным звеном СПОЛ при повреждении клетки является, как правило, образование т.н. активных форм кислорода:
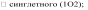
![]() –);
–);

![]() адикала
(OH–).
адикала
(OH–).
Супероксидный радикал O2– генерируют лейкоциты (особенно интенсивно при фагоцитозе), митохондрии в процессе окислительных реакций, разные ткани при метаболической трансформации катехоламинов, синтезе ПГ и других соединений.
Пероксид водорода H2О2 образуется при взаимодействии (дисмутации) радикалов O2– в цитозоле клеток и матриксе митохондрий. Этот процесс катализирует супероксиддисмутаза (СОД):
O2– + O2–

Радикал O2– и H2O2 оказывают прямое повреждающее действие. Наряду с этим, под влиянием ионов железа, присутствующих как в цитозоле, так и в биологических жидкостях, радикал O2– и H2O2 могут трансформироваться (с участием каталазы) в весьма агрессивный и обладающий высоким патогенным эффектом гидроксильный радикал OH–.
![]() H2O2
+ Fe2 + Fe3 + + OH + OH–;
H2O2
+ Fe2 + Fe3 + + OH + OH–;
O2–
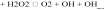
Гидроксильные радикалы OH– активно вступают в реакции с органическими соединениями, главным образом липидами, а также нуклеиновыми кислотами и белками. В результате образуются другие активные радикалы и перекиси. При этом реакция может приобрести цепной лавинообразный характер (рис. 5-6). Однако это происходит не всегда. Чрезмерной активации свободнорадикальных и перекисных реакций препятствуют факторы АОЗ клеток.
Антиоксидантная защита клеток
В клетках протекают процессы и действуют факторы, которые ограничивают или даже прекращают свободнорадикальные и перекисные реакции, т.е. оказывают антиоксидантный эффект. Один из таких процессов — взаимодействие радикалов и гидроперекисей липидов между собой, что ведет к образованию «нерадикальных» соединений. Ведущую роль в системе АОЗ клеток играют механизмы ферментной, а также неферментной природы, главные из которых представлены в таблице 5-2 и на рисунке 5-7.
Таблица 5–2. Звенья антиоксидантной системы и ее некоторые факторы
Звенья Факторы Механизмы действия
Антикислородное Ретинол, каротиноиды, рибофлавин Уменьшение содержания O2 в клетке, например путем его повышенной утилизации, повышения сопряжения процессов окисления и фосфорилирования
Антирадикальное СОД, токоферолы, маннитол Перевод активных радикалов в
«нерадикальные» соединения; «гашение» свободных радикалов органическими соединениями
Антиперекисное Глутатионпероксидазы, каталаза, серотонин Инактивация гидроперекисей липидов, например, при их восстановлении
3. Повреждения мембранного аппарата и форменной системы клетки: этиология, патогенез, последствия.
Повреждающее действие патогенного фактора в большинстве случаев направлено на клеточную мембрану, где и локализуются первичные повреждения, в то время как повреждения клеточных органелл носят вторичный характер и опосредованы внутриклеточными расстройствами гомеостаза – последствиями повреждений цитоплазматической мембраны. Наравне с этим возможно прямое действие некоторых патогенных факторов на клеточные органеллы с развитием в них первичных патологических процессов.
Цитоплазматическая мембрана (плазмолемма) состоит из липидов и протеинов. Около 90% мембранных липидов являются фосфолипидами (в частности, лецитин), которые состоят из амфипатических молекул, содержащих гидрофильную и гидрофобную части. Фосфолипиды в составе цитоплазматической мембраны образуют бимолекулярный слой, причем гидрофобные части обоих слоев ориентированы внутрь бислоя, а гидрофильные – к периферии, то есть внутрь и наружу клетки соответственно. Таким образом, внутренняя часть мембраны образована только двумя гидрофобными группировками, что и определяет ее свойства, сходные со свойствами парафина: непроницаемость для воды, ионов и водорастворимых веществ (углеводов, аминокислот), но проницаема для кислорода, двуокиси углерода, спиртов, других жирорастворимых веществ. (Следует отметить, что вода свободно проходит сквозь мембранные каналы и поры.). Другим важным свойством цитоплазматической мембраны является диэлектрическое свойство – высокое электрическое сопротивление и неспособность проводить электрический ток. Диэлектрические свойства определяют и устойчивость клетки к патогенному влиянию электрического тока. Так, нормальная клетка противостоит прямому действию электрического потенциала до 200мВ (собственный электрический потенциал цитоплазматической мембраны возбудимых клеток в среднем равен 70мВ, а митохондриальной мембраны – 175мВ). Липидный бислой на границе двх сред (вода-липиды) обладает межфазовым поверхностным натяжением, которое уравновешивает внутриклеточное гидростатическое давление.
Взаимодействие этих сил – поверхностного натяжения и внутриклеточного давления определяет объем клетки. (Следует отметить, что форма клетки определяется цитоскелетом.). Изменение баланса сил ведет либо к уменьшению объема клетки («сморщивание» клетки), либо к его увеличению вплоть до разрыва клетки (цитолиз; в отношении эритроцитов - гемолиз). Кроме того, поверхностное натяжение мембраны способствует саморепарации дефектов липидного бислоя, постоянно возникающих в результате броуновского движения молекул, растворенных в гиалоплазме; это поддерживает целостность и барьерные свойства плазмолеммы. Следовательно, внутриклеточное пространство закрыто для свободного обмена большинства веществ с внеклеточным пространством, за исключением воды, кислорода, углекислого газа, жирорастворимых веществ.
Особенности строения цитоплазматической мембраны (липидный состав с преобладанием фосфолипидов с небольшим количеством триглицеридов и холестерола) определяют низкую точку плавления и сохранение полужидкого состояния при температуре тела, сравнительно небольшую вязкость, что обеспечивают как механическую резистентность мембран, так и текучесть мембраны, возможность флотации («плавучесть»), миграции и ротации молекул белков в пределах мембраны. Ввиду того, что эти свойства зависят от соотношения между триглицеридами, фосфолипидами и холестеролом в составе мембраны, дефицит фосфолипидов, также как избыток триглицеридов и холестерола, ведут к увеличению вязкости мембраны, уменьшая ее текучесть и подвижность белковых структур – рецепторов, ферментов и др.
Вторым компонентом цитоплазматической мембраны являются белки. Молекулы белков погружены в липидный слой, занимая различные позиции. Интегральные белки полностью «прошивают» цитоплазматическую мембрану, один конец их молекулы находится в межклеточном пространстве, а другой – во внутриклеточном. Периферические белки, занимают только половину липидного бислоя, причем один конец молекулы погружен в цитоплазматическую мембрану, а другой выступает внутрь либо наружу клетки. Мембранные белки выполняют различные функции. Белкирецепторы воспринимают сигналы из внутренней среды организма и передают их клеткам через систему вторичных мессенджеров. Мембранные белки-антигены характеризуют видовую, индивидуальную и клеточную антигенную специфичность и служат в качестве рецепторов распознавания (self-маркеры) для иммунокомпетентных клеток; антигены также участвуют во взаимодействии клеток со специфическими иммуноглобулинами либо сенсибилизированными лимфоцитами. Белки-ионные каналы служат для прохождения ионов и водорастворимых веществ через липидный бислой в клетку и из клетки. Избирательность каналов зависит от конфигурации молекулы вещества и канала, а открытие канала может осуществляться двумя механизмами: потенциалзависимым и рецептором, распознающим вещество. Так, каналы для ионов Na+ и Ca2+ открываются при деполяризации возбудимых клеток под действием раздражителей. Белки - мембранные ферменты обеспечивают различные функции клетки, включая и некоторые защитные реакции. Кроме того, ферментами являются и ионные насосы, активно транспортирующие различные вещества против градиента концентрации с потреблением энергии – ионы Na и К (Na+, K+ – АТФаза), ионы Са (Са2+ – АТФ-аза).
Структура клеточной мембраны определяет и её функции: механического барьера, поддержания внутриклеточного гомеостаза путем селективной проницаемости в обоих направлениях для большинства веществ, образование, поддержание и восстановление градиента концентрации для некоторых веществ, поддержание формы и объема клетки, образование, поддержание и восстановление электрического мембранного потенциала, восприятие химических и антигенных сигналов, межклеточная коммуникация.
Углеводы клеточной мембраны почти всегда находятся в комплексе с протеинами либо липидами. Так, большинство интегральных белков – это гликопротеины, а десятая часть липидных молекул – гликолипиды. Углеводная часть этих молекул выступает вне клетки и не связана с мембраной. Другие углеводные производные, называемые протеогликанами, расположены вокруг белкового ядра и прикреплены к внешней поверхности цитоплазматической мембраны, покрывая ее рыхлым углеводным слоем – гликокаликсом. Углеводный состав гликокаликса определяет важные функции и характеристики клетки: отрицательный электрический заряд углеводных групп придает поверхности большинства клеток отрицательный заряд и обусловливает силу взаимного отталкивания, которая противостоит агрегации клеток и их взаимодействию с другими отрицательно заряженными частицами; соединение клеток между собой путем взаимодействия молекул гликокаликса; углеводные группы действуют как рецепторы, которые связывают гормоны и активируют таким образом интегральные белки, к которым они присоединены, запуская целый каскад внутриклеточных ферментных активаций; участвуют в иммунологических реакциях.
Этиология и патогенез повреждений мембраны
Разрушение цитоплазматической мембраны может быть обусловлено множеством причин:
механические, физические факторы (электрический ток, поля, излучения, повышенная либо пониженная температура), гипер- и гипоосмолярность, химические факторы, ферменты, антитела и сенсибилизированные лимфоциты, гипоксия и гипероксия, дисгомеостазы питательных веществ, голодание, ацидоз и алкалоз, дисгидрозы, дисминералозы, нарушения циркуляции крови и др.
Клеточные патологические процессы запускаются первичными повреждениями клеточной мембраны, вызванными действием патогенного фактора. Эти повреждения представляют собой первый патогенетический фактор, специфичный вызывающей причине. Вторичные повреждения, которые представляют собой последующие патогенетические факторы, во многом стереотипны и генетически определены структурой и функциями клетки. Это оправдывает трактовку клеточных патологических процессов как типические, не зависящие от вызывающей причины и от гистофизиологической специфичности клетки.
Первичные повреждения цитоплазматической мембраны носят печать специфичности этиологического фактора и могут быть классифицированы в зависимости от его природы.
А. Первичные механические повреждения цитоплазматической мембраны (растяжение, разрыв, образование дефектов, фрагментация) вызваны механическими силами, которые воздействуют непосредственно на клетку. Таким образом, первичным патогенетическим фактором является механическая дезинтеграция мембраны, открытие механического барьера клетка – интерстиций и образование прямых неконтролируемых сообщений между внутриклеточным и межклеточным пространствами. Это пориводит к свободному прохождению веществ в обоих направлениях: интерстиций – гиалоплазма и гиалоплазма–интерстиций. Конечный результат – уравновешивание составов этих пространств, проникновение в клетку внеклеточных веществ (напр., Na+) и выход из клетки веществ, содержащихся в ней (напр., К+). Дисгомеостаз внутриклеточного пространства делает невозможным нормальное функционирование клеточных органелл с их вовлечением в патогенетическую цепь патологического процесса.
Б. Электрические повреждения, вызванные электрическим током; зависят от характеристик тока (постоянный или переменный), а также от типа клетки. Так, действие тока на возбудимые клетки (нейроны, миоциты) фазное. Сначала имеет место открытие потенциалзависимых ионных каналов (Na+, K+, Ca2+) c исчезновением градиента концентрации и потенциала покоя, то есть возникает деполяризация клеточной мембраны, возбуждение клетки с соответствующими эффектами - генерация и проведение электрического импульса, сокращение миоцита. Более длительном действии постоянного электрического тока на клетку препятствует реполяризации мембраны и восстановлению потенциала покоя, следовательно, ведет к деполяризационному торможению. Далее происходит поляризация гиалоплазмы: накопление отрицательно заряженных ионов (анионов) на положительно заряженном электроде (аноде), а положительно заряженных (катионов) – на отрицательно заряженном электроде (катоде). Под действием тока происходит электролиз внутри- и внеклеточных веществ, то есть разложение веществ с ионной структурой до нейтральных атомов (напр., ионы Na+ восстанавливаются на катоде до нейтральных атомов натрия, а ионы Cl– окисляются на аноде до нейтральных атомов хлора.
Под действием тока возникает «пробой» цитоплазматической мембраны (electrical break-down). Это явление наблюдается тогда, когда электрический потенциал, подведенный к клетке, превышает силу поверхностного натяжения и вязкость цитоплазматической мембраны. Следовательно, дефекты, образованные в бислое броуновским движением молекул, не только не могут быть закрыты, но имеют тенденцию к увеличению вплоть до полного разрушения мембраны. Следует отметить, что при ослаблении механических и диэлектрических свойств возможен «автопробой» клеточных мембран под действием собственного электрического потенциала.
В. Оксидативный стресс, вызванный действием свободных радикалов кислорода. Свободным радикалом кислорода называется кислород либо его соединение, которое содержит на последнем электронном уровне один неспаренный электрон, обуславливающий огромную химическую активность этого вещества (поэтому такие радикалы называются еще активным кислородом).
Свободные радикалы – обычные продукты некоторых физиологических процессов (напр., цепь переноса электронов в митохондриях – дыхательная цепь, фагоцитоз), однако в физиологических условиях их потенциально патогенному действию противодействуют антиоксидантные системы организма, которые быстро нейтрализуют эти соединения. При патологических процессах также образуются свободные радикалы (воспаление, фагоцитарная реакция, гипероксия, гипоксия, действие ионизирующего излучения, отравление хлороформом, четыреххлористым углеродом и др.). В настоящее время выявляется все больше патологических процессов, в патогенезе которых играют роль свободные радикалы (напр., заболевания печени, язва желудка, инфаркт миокарда и др.).
Формы свободных радикалов: супероксид кислорода (О2–), пероксид водорода (Н2О2), гидроксильный радикал (ОН–). Из антиоксидантных систем следует отметить: супероксиддисмутазу (нейтрализует пероксид водорода), каталазу (разлагает пероксид водорода), пероксидазы (нейтрализует пероксиды), церуллоплазмин, трансферрин и ферритин (связывают ионы железа, предотвращая цепные реакции перекисного окисления эндогенных веществ, которые инициируются свободными радикалами), витамин Е, полифенолы и др.
Механизм патогенного действия свободных радикалов состоит в перекисном окислении эндогенных веществ: липидов, полиненасыщенных жирных кислот, нуклеиновых кислот, белков, аминокислот, тиоловых ферментов, которые содержат сульфгидрильную группу в составе своей молекулы и др. Самые неблагоприятные последствия действия свободных радикалов – генные мутации и перекисное окисление полиненасыщенных жирных кислот в составе цитоплазматических мембран. Механизм реакции состоит в следующем.
Гидроксильный радикал ОН– является самым агрессивным из свободных радикалов. Благодаря своим малым размерам, он легко проникает внутрь липидного бислоя, где подвергает перекисному окислению полиненасыщенные жирные кислоты из состава мембранных фосфолипидов. Под действием гидроксильного радикала происходит первая реакция – отрыв одного протона от липида (LH) (точнее, от полиненасыщенных жирных кислот) с образованием воды и липидного радикала, обозначенного L–:
ОН– + LH = Н2О + L–.
Липидный радикал, образовавшийся в ходе первой реакции, взаимодействует с молекулярным кислородом, растворенным во внутриклеточной либо в межклеточной среде, образуя липопероксидный радикал LOO–, согласно реакции 2:
L– + О2 = LOO–.
Липопероксидный радикал взаимодействует с новой молекулой липида LH, образуя два новых радикала: гидропероксидный радикал LOOH и липидный радикал L– (реакция 3):
LOO– + LH = LOOH + L–.
Итак, реакция становится автокаталитической, образуя длинную цепь и вовлекая все больше молекул липидов. В результате этой реакции один гидроксильный радикал образует три новых радикала: липидный, липопероксидный и гидропероксидный.
В некоторых условиях, например в присутствии двухвалентного железа, автокаталитическая цепь образования липидных пероксидов может ветвиться согласно реакции 4:
LOOH + Fe2+ = Fe3+ + ОН– + LO–; LO– + LH = LOH + L–.
Таким образом, вследствие последней реакции образуется липидный радикал L–, который может инициировать новую цепь и т.д. Окончательный результат – пероксидное окисление и денатурация большого числа молекул фосфолипидов, что ведет к множеству мембраноразрушающих эффектов:
а) деструкция мембраны и образование незакрываемых брешей с уменьшением её
механического сопротивления;
б) увеличение неизбирательной проницаемости и исчезновение клеточных ионных градиентов;
в) уменьшение электрического сопротивления мембраны и ее разрывы;
г) исчезновение электрического потенциала на мембранах возбудимых клеток и
деполяризационное торможение;
д) увеличение концентрации ионов кальция в гиалоплазме со всеми вытекающими
последствиями;
е) нарушение функций клеточных органелл;
ж) некробиоз, некроз и аутолиз клетки.
Наряду с липидами, мишенями оксидативного стресса могут быть и другие вещества в составе цитоплазматической мембраны. Так, под действием свободных радикалов происходит восстановление сульфгидрильных групп тиоловых ферментов (напр., Са2+ - АТФаза) до дисульфидных групп с потерей ферментативной активности и всеми вытекающими последствиями. Еще одно последствие оксидативного стресса – разрушение ДНК с потенциально мутагенными эффектами.
Г. Ферментативные клеточные повреждения, вызванные действием экзогенных и эндогенных ферментов. Источниками эндогенных ферментов могут быть фагоциты в очаге воспаления, лизосомальные ферменты из любых клеток организма, высвобождающиеся при дестабилизации мембраны лизосом, панкреатические пищеварительные ферменты, высвобождаемые в кровь в случае панкреатита либо панкреонекроза. К экзогенным ферментам относятся микробные (напр., стрептококковая лецитиназа, которая расщепляет мембранные фосфолипиды; ферменты, вырабатываемые Clostridium perfringens, которые индуцируют расщепление клеточных мембран).
Спектр цитопатогенных ферментов очень широк: протеазы, пептидазы, коллагеназа, элластаза, липаза, фосфолипаза, амилаза, гиалуронидаза и др. Патогенетическая цепь патогенных цитопатогенных эффектов запускается с момента расщепления субстратов, специфичных для этих ферментов: мембранные фосфолипиды, мембранные белки, гликопротеины и др. Окончательный результат патогенного действия ферментов – дезинтеграция мембраны с последующей «лавиной» цитодеструктивных патогенетических процессов.
Следует отметить, что в норме во внутренней среде организма имеется определенный уровень эндогенных энзимов. Им противодействуют натуральные антиэнзимы, главным из которых является альфа-антитрипсин, вырабатываемый печенью. Таким образом, цитопатогенное действие энзимов проявится лишь при дисбалансе энзимемии и антиэнзимных систем.
Д. Иммуноцитопатогенные повреждения опосредованы иммунными, аутоиммунными и аллергическими реакциями, которые разворачиваются на уровне цитоплазматической мембраны. К ним относятся аллергические цитолитические реакции II типа, аутоиммунные реакции. Иммуноцитопатогенные реакции различаются по механизму, но их общим окончательным результатом является смерть клетки. Так, взаимодействие антиген-антитело при аллергических реакциях II типа ведет к активации комплемента и к «перфорации» клеточной мембраны активированными комплексами комплемента С5 – С9 со всеми последующими эффектами потери целостности мембраны. В то же время опсонизация клеток иммуноглобулинами и связанным комплементом индуцирует фагоцитоз с последующим внутриклеточным перевариванием фагоцитированной клетки. При цитолитических реакциях IV типа, инициируемых сенсибилизированными лимфоцитами, наблюдается разрушение атакуемой клетки посредством специфических либо неспецифических клеточных цитолитических механизмов (катионные белки и др.).
Е. Термическая травма клеток происходит под действием высоких температур и имеет специфические патогенетические механизмы. Действие повышенных температур ведет к термической денатурации веществ из состава цитоплазматической мембраны (белки) с исчезновением специфических функций каналов, ионных насосов, ферментов, антигенов, Возможно также образование аутоантигенов споследующей аутоиммунной реакцией. Денатурация веществ из гиалоплазмы и клеточных органелл имеет соответствующие последствия для клетки.
Действие пониженных температур ведет к кристаллизации воды в момент замерзания и размораживания, а образующиеся внутриклеточно кристаллы механически разрушают цитоплазматическую мембрану, а также мембраны клеточных органелл с соответствующими последствиями.
Ж. Гипоксические повреждения. Энергия, необходимая для выполнения всех функций клетки почти целиком обеспечивается процессами окисления питательных веществ; сопряжение окисления с процессами фосфорилирования ведет к депонированию энергии в виде макроэргических соединений. Депонированная энергия используется для обеспечения жизнедеятельности клетки: анаболизма, репарации клеточных структур, деятельности ионных насосов и поддержания внутриклеточного гомеостаза, ионного градиента, мембранного потенциала и др. Причинами клеточной гипоксии могут быть все формы генерализованной гипоксии (гипоксическая, респираторная, циркуляторная, анемическая, гистотоксическая), нарушения местного крово- и лимфообращения (венозная гиперемия, ишемия, гемо- и лимфостаз), прямое поражение процессов окислительного фосфорилирования, нарушения системного кровообращения (кардиогенная, сосудистая либо гематогенная недостаточность кровообращения, коллапс, шок). Следует отметить, что дисциркуляторные нарушения, наряду с дефицитом энергии, вызванным клеточной гипоксией, обуславливают и другие цитодеструктивные патогенетические факторы: гипоперфузию, гипонутрицию, гиперкапнию, ацидоз, накопление в клетках и межклеточном пространстве метаболических шлаков.
Эффекты клеточной гипоксии инициируются снижением уровня энергии ниже порога, совместимого с жизненной активностью клетки. Патогенетические цепи многообразны по последовательности их развития:
клеточная гипоксия уменьшение окислительных процессов уменьшение количества АТФ уменьшение активности Na+, K+ – АТФ-азы исчезновение градиента Na+ и K+ внутриклеточная гиперосмолярность клеточное набухание цитолиз;
исчезновение мембранного потенциала покоя деполяризационное торможение;
уменьшение активности Са2+ – АТФ-азы исчезновение градиента концентрации Са2+ и
увеличение его концентрации в гиалоплазме рост активности фосфолипаз, протеаз, эндонуклеаз, АТФаз набухание митохондрий, эндоплазматической сети, дестабилизация лизосом;
активизация гликолитических процессов накопление молочной кислоты клеточный
ацидоз активация протеаз и фосфолипаз цитолиз.
З. Дисгомеостатические клеточные повреждения вызываются нарушениями гомеостаза внутренней среды. Внутренняя среда организма (среда обитания клеток) характеризуется строгим поддержанием физических, физико-химических и биохимических параметров. Крайние отклонения биохимических параметров интерстициального пространства являются прямым следствием изменения состава крови и могут стать патогенными факторами, вызывая клеточные патологические процессы. Тяжелые последствия вызывают дисминералозы (гипер- и гипонатриемия, гипер- и гипокалиемия, гипер- и гипокальцемия, гипер- и гипохлоремия, гипер- и гипомагниемия, гипер- и гипо-Н-иония), де- и гипергидратация, гипер- и гипоосмолярность.
И. Метаболические клеточные повреждения, вызванные как врожденными дефектами ферментов, так и внеклеточными дисметаболизмами. К внеклеточным дисметаболизмам, которые могут повредить клетки, относятся гипо- и гипергликемия, галактоземия, гипопротеинемия и диспротеинемии, гиперлипидемия и дислипидемия, гиперкетонемия.
К. Инфекционные повреждения. Первичные клеточные повреждения инфекционной природы вызваны биологическими факторами (вирусы, бактерии, протозоары, метазоары), а последующее воспаление пораженного органа ведет к вторичным клеточным повреждениям. Вторичные повреждения являются многофакторными, имеют сложный патогенез, определенный действием многих патогенных факторов из очага воспаления (ацидоз, дисциркуляторные нарушения, оксидативный стресс, иммунные поражения, дисметаболизмы, гипоксия).
Проявления повреждений клеточной мембраны
Как было отмечено выше, конечный результат прямого действия патогенных факторов и первый патогенетический фактор клеточных патологических процессов – это дезинтеграция цитоплазматической мембраны. Вне зависимости от этиологического фактора и от характера первичных повреждений, дезинтеграция мембраны запускает следующие вторичные патогенетические факторы, которые продолжают клеточный патологический процесс.
1. Нарушение проницаемости клеточной мембраны и трансмембранного транспорта веществ
Проникновение в клетки веществ, необходимых для жизнедеятельности, равно как и удаление из клеток продуктов катаболизма осуществляется путем трансмембранного транспорта различных типов и эффективности. Будучи расположенной на границе между клеткой и внеклеточной средой, клеточная мембрана контролирует и модулирует обмен веществ, обеспечивая выживание, функционирование и постоянную гомеостатическую адаптацию клетки к условиям среды.
Трансмембранный обмен осуществляется путем пассивного и активного транспорта. Пассивный транспорт осуществляется путем осмоса, простой диффузии, облегченной диффузии, равновесия Доннана, ко-диффузии (сопряженной диффузии), причем все механизмы реализуются по трансмембранным физико-химическим градиентам (электрическим, ионным и концентрационным) без потребления энергии. Формы транспорта зависят, прежде всего, от размеров транспортируемого объекта. Описаны системы микротранспорта (непрерывный транспорт молекул) и макротранспорт, обеспечивающий прерывистое проникновение макрочастиц.
Пассивный микромолекулярный транспорт обеспечивается тремя видами мембранных структур и играет роль в транспорте водорастворимых молекул: ионные каналы, транспортеры и ионофоры.
Трансмембранное перемещение молекул воды осуществляетсяпутем осмоса. В случае, когда два раствора разделены полупроницаемой мембраной, каковой и является цитоплазматическая мембрана, молекулы растворителя перемещаются из отдела с малой концентрацией в отдел с большей концентрацией растворенного вещества.
Простая диффузия осуществляется благодаря физическому либо электрическому градиенту концентрации. Неравенство концентраций между двумя отделами создает концентрационную энергию. Эта энергия движет молекулы растворенного вещества из отдела с большей концентрацией в отдел с меньшей концентрацией.
Облегченная диффузия является формой пассивного транспорта, при которой существует специфический мембранный переносчик, способный во много раз увеличить скорость диффузии вещества. Когда концентрация транспортируемого вещества сильно возрастает, происходит насыщение переносчика и скорость диффузии падает.
Равновесие Доннана – вид простой диффузии, который осуществляется в тех случаях, когда по одну сторону мембраны находится ион, для которого эта мембрана непроницаема. Такая ситуация возникает для клетки, мембрана которой непроницаема для органических анионов, обладающих большими размерами (внутриклеточные белки), но в то же время проницаема для других анионов и катионов. В этом случае состояние равновесия реализуется в условиях избытка ионов K+ на внутренней поверхности и избытка ионов Cl– – на наружной. Таким образом, диффузионные силы уравновешиваются взаимно противоположными электродвижущими силами.
Вследствие повреждения цитоплазматической мембраны, в том числе и гликокаликса, имеет место нарушение структурной целостности мембраны с потерей барьерной функции. Как следствие становится возможным неизбирательное (неконтролируемое) проникновение тех веществ, которые нормальным образом переносятся только при помощи избирательных механизмов транспорта (Na+, K+, Cl–, Ca2+, Mg2+), а затем и внутриклеточное поступление избытка воды путем осмоса, что ведет к гидропической дистрофии и вакуолизации, деформации, набуханию клетки, механической деструкции цитоскелета. Морфологически это проявляется увеличением объема клетки вплоть до ее разрыва. Вследствие последовательных деформаций возможно «расправление», даже исчезновение микроворсинок с потерей соответствующих функций (напр., потеря микроворсинок энтероцитами ассоциируется с синдромом мальабсорбции, деформация клеток почечного эпителия в случае нефропатий сопровождается нарушениями реабсорбции веществ).
2. Нарушение активного трансмембранного транспорта веществ
Избирательный трансмембранный транспорт веществ осуществляется через функционирующие ионные каналы и ионные насосы.
Ионные каналы образованы интегральными белками мембраны, которые могут создать гидрофильные трансмембранные пути, обеспечивая движение воды и, следовательно, пассивную диффузию простых молекул либо ионов. Существуют специфические каналы для каждого из основных ионов (Na+, K+, Cl–, Ca2+). Специфичность этих каналов обусловлена характеристиками белковой макромолекулы и, в особенности, «воротами» канала. Регуляция прохождения сквозь ионные каналы осуществляется при помощи различных механизмов. Если канал содержит распознающую субъединицу – рецептор, канал открывается при поступлении специфического химического сигнала извне – гормона либо медиатора. Другой вид регуляции – потенциалзависимый. Так, снижение потенциала покоя возбудимых клеток (нейронов, миоцитов) ниже критического уровня (пороговая деполяризация) ведет к раскрытию натриевых каналов с проникновением натрия в цитоплазму и генерацией потенциала действия.
Особенностью движения ионных потоков через мембранные каналы является тот факт, что однажды активированный канал остается открытым определенное время, после чего автоматически закрывается. Эта постоянная инактивации характерна каждому типу каналов, а мощность потока ионов Na+ в каждый момент деполяризации зависит от количества активных каналов в данный момент. Вместе с начавшейся реполяризацией и в зависимости от степени восстановления мембранного потенциала возможность открытия отдельных каналов снижается, количество одновременно активных каналов также уменьшается, а поток натрия постепенно снижается. Считается, что ионы Ca2+ участвуют в механизмах активации потенциалзависимых каналов Na+, так как уменьшение содержания внеклеточного кальция снижает порог открытия канала, в то время как повышение содержания кальция стабилизирует канал.
В отсутствие интегрального белка, играющего роль канала, пассивный трансмембранный транспорт осуществляется путем включения транспортируемого иона в гидрофильную полость подвижной мембранной структуры, внешняя поверхность которой липофильна. Эта структура, называемая транспортером, соединяясь с транспортируемым веществом на одной поверхности мембраны, может диффундировать на противоположную поверхность, где это вещество высвобождается.
Существуют вещества, называемые ионофорами, которые, действуя на уровне естественных либо искусственных мембран, могут увеличивать до 10.000 раз их проницаемость для определенных видов ионов. К ионофорам относятся некоторые антибиотики (ионофоры K+ и Na+). Из клеточных мембран выделен и эндогенный ионофор АХ347, специфичный ионам кальция.
Активный трансмембранный транспорт веществ осуществляется с потреблением метаболической энергии против электрохимического градиента. Активный транспорт осуществляется ионными насосами, которые способствуют трансмембранному переносу некоторых ионов и молекул: Н+, Na+, K+, Ca2+, аминокислот, углеводов и др. Самыми изученными являются Na+ - K+ и Ca2+ насосы.
Первичный активный трансмембранный транспорт Na+, K+ и Ca2+ осуществляется специальными ферментами – ионными насосами (например, K+, Na+ - АТФ-аза цитоплазматической мембраны, Ca2+ - АТФ-аза мембраны эндоплазматического ретикулума либо саркоплазматического ретикулума кардиомиоцитов), которые гидролизуют АТФ и таким образом получают энергию, необходимую для транспорта. Транспортные АТФ-азы образуют различные конформации Е1 и Е2 с различным сродством к Na+ и K+. Так, конформация Е1 K+, Na+ - АТФ-азы обладает повышенным сродством к Na+ и присоединяет внутри клетки 3 иона натрия, после чего пространственно поворачивается, перенося Na+ кнаружи. Вместе с переориентацией фермент изменяет конформацию на Е2, теряя сродство к Na+ и высвобождая его во внеклеточное пространство; в то же время возрастает сродство конформации Е2 к K+, расположенному внеклеточно. Это ведет к присоединению 2 ионов K+ из внеклеточного пространства, что ведет к преобразованию конформации обратно в Е1 и переориентации фермента внутриклеточно одновременно с потерей сродства к K+, который и высвобождается внутрь клетки. Далее процесс повторяется, функционируя постоянно и, таким образом, создавая градиент внутри - внеклеточной концентрации Na+ и K+. Так как обмен ионов происходит в отношении 3 Na+ на 2 K+, внутриклеточно образуется дефицит ионов Na и положительных зарядов – электрогенное действие ионного насоса, котрое ведет к образованию разности потенциалов с обеих сторон мембраны. Действие K+ - Na+ насоса обеспечивает градиент концентрации этих ионов в клетке и интерстиции, который для Na+ составляет 1:20, а для K+ - 4:1. Насос специфически блокируется сердечными гликозидами (особенно строфантином G) и неспецифически – уменьшением энергогенеза, например разобщением окислительного фосфорилирования и уменьшением синтеза АТФ.
Ca2+ - АТФ-аза действует сходным образом, путем последовательного изменения сродства к Ca2+, «закачивая» внутриклеточный кальций в эндо- (сарко-) плазматический ретикулум, создавая таким образом высокий градиент Ca2+ в гиалоплазме по сравнению с концентрацией этого иона во внеклеточном пространстве и в эндо- (сарко-) плазматическом ретикулуме, равный 1:10.000.
Вследствие деструкции цитоплазматической мембраны повреждаются все механизмы активного транспорта веществ. Следствием нарушения активного транспорта веществ является исчезновение градиентов концентрации электролитов (Na, K, Ca, Cl) между интерстицием и цитоплазмой и цитоплазмой и внутриклеточными структурами – митохондриями и эндоплазматическим ретикулумом. Соответственно исчезает и мембранный потенциал.
Устранение градиента калия
В клетке нормальное соотношение внутри- и внеклеточного калия равно 4:1, что, наряду с другими электролитами, создает электрический градиент и потенциал покоя у возбудимых клеток. Градиент концентрации калия также необходим для функционирования митохондрий. Уравнивание вне- и внутриклеточной концентраций калия устраняет потенциал покоя клетки (деполяризация) и делает невозможным возбуждение клетки (деполяризационное торможение). Благодаря увеличению внеклеточной концентрации ионов калия, уменьшается мембранный потенциал соседних клеток, увеличивается их возбудимость, что может служить фактором спонтанного запуска потенциала действия. Это явление можно наблюдать при инфаркте миокарда, когда повышение концентрации калия в очаге некроза способствует появлению фибрилляций сердца.
С другой стороны, калий, вышедший из клеток, проникает во внутреннюю среду организма, включая кровь (гиперкалиемия), что похожим образом влияет на другие возбудимые клетки, отдаленные от очага первичного повреждения (нейроны, кардиомиоциты). Рост концентрации ионов калия в крови в результате его высвобождения из клеток может наблюдаться при механической травме, аллергических и гипоксических состояниях, в случае назначения высоких доз сердечных гликозидов, что проявляется изменениями электрокардиограммы и электроэнцефалограммы.
Устранение градиента натрия
В клетке нормальное соотношение внутри- и внеклеточного натрия равно 1:20, что, наряду с градиентом калия и других электролитов, создает электрический градиент и потенциалы покоя и действия у возбудимых клеток. Градиент K+ и Na+ поддерживается благодаря функционированию потенциалзависимых каналов K+ и Na+, а также селективного насоса - K+, Na+ - АТФ-азы. Так как цитоплазматическая мембрана непроницаема для макромолекулярных веществ, внутриклеточная концентрация белков больше, чем во внеклеточном пространстве, что создает градиент концентрации белков, а также избыток внутриклеточного онкотического давления. В этих условиях изоосмолярность гиалоплазмы поддерживается посредством пониженной концентрации натрия в клетке. Таким образом, онко-осмотическое равновесие поддерживается путем вывода натрия из клетки, уменьшения его внутриклеточной концентрации и соответственного роста внеклеточной концентрации ионов натрия. Устранение градиента концентрации натрия при деструкции мембраны влечет за собой проникновение этого элемента внутрь клетки, что увеличивает внутриклеточное осмотическое давление, создавая осмо-онкотический градиент, который инициирует проникновение воды внутрь клетки путем осмоса, набухание клетки, цитолиз.
Устранение потенциала покоя
Благодаря разности концентраций ионов во вне- и внутриклеточном пространствах, на цитоплазматической мембране возбудимых клеток создается разность потенциалов, равная приблизительно –70 мВ. В случае прекращения функционирования мембранных ионных насосов возрастает проницаемость мембраны для ионов и уравнивается их внутри- и внеклеточная концентрация. Следствием этого является уменьшение мембранного потенциала, деполяризация мембраны, невозможность восстановления мембранного потенциала и, в итоге, деполяризационное торможение клетки.
Уменьшение электрического сопротивления цитоплазматической мембраны
Цитоплазматическая мембрана и мембрана клеточных органелл представляет собой диэлектрик, который может противостоять разности потенциалов до 200 мВ (потенциал пробоя), который превышает физиологический потенциал этих структур (75 мВ для цитоплазматической мембраны и 175 мВ для митохондриальной мембраны). Таким образом, в обычных условиях, собственный электрический потенциал не может пробить мембрану, так как сила поверхностного натяжения и вязкость цитоплазматической мембраны превышают электрический потенциал, а повреждения, образующиеся броуновским движением в липидном бислое, легко закрываются. Уменьшение электрического сопротивления цитоплазматической мембраны (напр., при деградации мембранных липидов фосфолипазой, мембранных белков протеиназами) ведет к снижению порога электрического пробоя. Когда порог пробоя снижен ниже критического уровня, собственный электрический потенциал клетки превосходит силу поверхностного натяжения и вязкость цитоплазматической мембраны, а образующиеся броуновским движением в липидном бислое повреждения не только не могут быть закрыты, но имеют тенденцию к увеличению вплоть до полного разрушения мембраны. Таким образом собственный мембранный потенциал разрывает и разрушает мембрану (электрический пробой, «electrical break-down»).
Устранение градиента кальция
В норме концентрация ионов Ca2+ в гиалоплазме равна приблизительно 10–7 ммоль/л, а во внеклеточном пространстве – 10–3 ммоль/л, таким образом, соотношение концентраций равно 1:10.000. То же соотношение поддерживается между гиалоплазмой и эндоплазматическим (саркоплазматическим) ретикулумом, а также между гиалоплазмой и митохондриями.
Ионы кальция проникают в клетки как путем диффузии, так и через мембранные кальциевые каналы, которые открываются в ответ на изменение мембранного потенциала (напр., при возбуждении клетки) либо вследствие взаимодействия гормонов со специфическими рецепторами мембраны. Постоянное выведение кальция из гиалоплазмы клеток и поддержание нормального градиента концентрации осуществляется кальциевыми насосами (Ca2+ - АТФ-аза) клеточной мембраны и эндоплазматического (саркоплазматического) ретикулума, а также системой накопления ионов Ca2+ в митохондриях.
При уменьшении синтеза АТФ в клетках ингибируется активность Ca2+ - АТФ-азы, уменьшается скорость выведения кальция из гиалоплазмы, что способствует накоплению ионов кальция до концентрации, равной 10–5 ммоль/л. Появляются изменения в клеточном цитоскелете, активируются сократительные структуры (актин и миозин), активируются ферментные системы клетки (АТФ-азы, фосфолипазы, протеазы, эндонуклеазы), повреждаются внутриклеточные мембраны и нарушаются метаболические процессы на уровне клетки.
Активация внутриклеточных ферментов
Общим эффектом увеличения концентрации кальция внутри клетки является активация внутриклеточных ферментов: АТФ-аз, протеаз, эндонуклеаз и фосфолипаз.
Активация клеточных АТФ-аз ведет к снижению запасов АТФ, что, наряду с первичным снижением процессов образования энергии, усугубляет энергодефицит.
Активация внутриклеточных протеаз ведет к запуску процессов аутолиза клетки – деградации собственных протеинов с дезинтеграцией самой клетки.
Активация эндонуклеаз ведет к деградации нуклеопротеидов (ДНК, РНК) и запуску процесса апоптоза.
Активация клеточных фосфолипаз (фосфолипаза А) ведет к деградации фосфолипидов из состава цитоплазматической мембраны, к образованию незакрываемых дефектов мембраны, что снижает как механическую, так и электрическую резистентность, нарушает барьерную функцию и увеличивает неизбирательную проницаемость. Этот эффект сходен с действием первопричины – повреждением цитоплазматической мембраны патогенным фактором – таким образом замыкается порочный круг. Одновременно с этим деградация фосфолипидов из состава цитоплазматической мембраны уменьшает электрическое сопротивление и ведет к электрическому разрыву мембраны.
9. Нарушение функционирования механизма трансмембранного обмена ионов Na+ и Н+.
Клеточный ацидоз
Клеточные повреждения сопровождаются внутриклеточным ацидозом с уменьшением внутриклеточного рН ниже 6,0. В патогенезе ацидоза участвуют следующие механизмы:
а) повышенный приток ионов водорода в клетку из внеклеточного пространства,
обусловленный первичным дисгомеостазом кислотно-основного баланса в организме;
б) избыточное образование кислых промежуточных продуктов обмена непосредственно в клетке ввиду усиления процесса гликолиза, нарушения цикла Кребса, гидролиза мембранных фосфолипидов, интенсивной деградации адениловых нуклеотидов; в)истощение и недостаточность буферных систем, вследствие чего становится невозможным ограничение роста концентрации ионов водорода;
г) недостаточность механизмов выведения ионов водорода из клетки.
Увеличение концентрации водородных ионов внутри клетки запускает цепь патологических изменений: нарушение функции белков вследствие изменения конформации их молекулы, активация гидролитических лизосомальных ферментов, увеличение проницаемости клеточных мембран как результат нарушения структуры мембранных липидов.
Внутриклеточная гиперосмолярность
Нормальная клеточная изоосмолярность – равенство осмотического давления внутри клетки и в интерстиции обеспечивается оптимальным балансом концентрации белков и электролитов с обеих сторон. Изоосмолярность поддерживает постоянный объем клетки и клеточных органелл. В нормальном сосотоянии в клетках содержится большее количество белка по сравнению с внеклеточной средой. Это создает осмо-онкотический градиент, что могло бы привести к увеличению объема клетки. Благодаря действию Na+, K+ - АТФ-азы, ионы натрия удаляются из клетки, что уменьшает внутриклеточное осмотическое давление и поддерживает изоосмолярность и постоянный объем клетки.
При повреждении мембраны и K+, Na+ - АТФ-азы (напр., при отравлении солями тяжелых металлов), при нарушении процессов энергогенеза в случае гипоксии, при отравлениях оксидом углерода избыток ионов натрия не удаляется из цитоплазмы и, таким образом, в клетке создается гиперосмолярность. Это, в свою очередь, способствует проникновению воды в клетку путем осмоса, что ведет к набуханию клетки, увеличению ее в объеме, росту механического давления внутри клетки и даже разрыву цитоплазматической мембраны. Схожие процессы имеют место и на уровне клеточных органелл.
Усиление анаэробных катаболических процессов, в особенности гликолитических, является универсальной реакцией клетки на дефицит энергии. Этот механизм изначально имеет компенсаторное значение для поврежденной клетки, так как направлен на восполнение дефицита энергии. Впоследствии интенсивный катаболизм ведет к накоплению внутри клетки промежуточных метаболических продуктов, напр., лактата, накоплению ионов водорода и декомпенсированному клеточному ацидозу со снижением рН ниже предела, совместимого с жизнью клетки.
Таким образом, все повреждения клеточной мембраны в итоге ведут к нарушению основных функций клетки и смерти последней.
Последствиями повреждений клеточной мембраны являются дистрофии, некробиоз и некроз, воспаление, атрофия, склерозирование.
4. Дисбаланс ионов и жидкости, изменение электрофизиологических свойств клетки:
этиология, патогенез, последствия.
Вслед за расстройством энергетического обмена или параллельно с ним нарушается нормальное распределение различных ионов между жидкостью околоклеточных и внутриклеточных пространств, а также между различными отсеками цитоплазмы. В результате существенно изменяется проницаемость мембран для многих ионов и, в первую очередь, для калия, натрия, кальция, магния и хлора. Дисбаланс ионов проявляется главным образом накоплением в цитоплазме натрия и потерей ею калия вследствие расстройств в функционировании натрий-калиевой-АТФ-азы плазмолеммы, что в свою очередь ведет к нарушению работы натрий-кальциевого обменного механизма. Следствие дисбаланса ионов является изменение мембранного потенциала, потенциала действия, распространение возбуждения по электровозбудимым структурам, а также электромеханического и электрохимического сопряжения. Именно эти изменения являются важнейшими признаками повреждения клеток. Примером могут служить изменения ЭКГ, ЭЭГ, ЭМГ электронейрограммы, нарушения секреторной и моторной функции специализированных клеток. Дополнительно дисбаланс ионов может вести к изменению объема клеток вследствие движения жидкости в клетку или из клетки - развитие гипергидратации или дегидратации. Например, если в клетке имеется избыток натрия, то в цитоплазму поступает вода (гипергидрия), если избыток натрия имеет место в тканевой жидкости, то вода поступает из клетки в околоклеточное пространство (гипогидрия). В обоих вышеперечисленных случаях возможны микроповреждения внутриклеточных и цитоплазматических мембран, распад митохондрий и других органелл, повреждение ядра.
6. Нарушение генетической программы клетки и механизмов ее реализации: этиология, патогенез, последствия.
Основными процессами, ведущими к изменению генетической информации клетки, являются мутации, экспрессия патогенных генов (например, онкогенов), подавление активности жизненно важных генов – репрессия (например, регулирующих ферментов) или внедрение в геном фрагмента чужеродной ДНК (например, интеграция фрагмента ДНК онкогенного вируса с ДНК клетки при опухолевом росте). Другим важным механизмом расстройства жизнедеятельности клетки может быть нарушение реализации генетической программы главным образом в процессе клеточного деления при митозе и мейозе (для развития половых клеток). Выделяют три группы нарушений митоза:
изменения в хромосомном аппарате,
повреждение структур, обеспечивающих процесс митоза,
нарушение разделения цитоплазмы и цитолеммы - цитотомия. Наиболее частыми нарушениями митоза первой группы являются изменения числа и структуры хромосом. Примерами расстройств второй группы могут служит формирование многополюсных или моноцентрических митозов, рассредоточение хромосом в метафазе, что является, в частности, следствием аномалии веретена. Нарушения процесса деления цитоплазмы и плазмолеммы проявляются преждевременной или задержанной цитотомией, а также ее отсутствием.
НАРУШЕНИЯ ПЕРИФЕРИЧЕСКОГО КРОВООБРАЩЕНИЯ И МИКРОЦИРКУЛЯЦИИ
1. Определение, причины и виды артериальной и венозной гиперемий.
Артериальная гиперемия - увеличение кровенаполнения органа или ткани вследствие увеличения притока артериальной крови по расширенным артериям и артериолам.
Причины и механизм артериальной гиперемии
К артериальной гиперемии может привести усиленное действие обычных физиологических раздражителей (солнечных лучей, тепла и др.), действие болезнетворных факторов (биологических, механических, физических), а также увеличение нагрузки или участок ткани, психогенные воздействия.
Артериальная гиперемия бывает физиологической и патологической.
Физиологическая артериальная гиперемия – возникает под действием обычных физиологических раздражителей. К физиологической артериальной гиперемии относят рабочую
(функциональную) и реактивную (постишемическую) гиперемию.
Рабочая гиперемия обусловлена метаболическими потребностями органа или ткани в связи с увеличением их функционирования. Например, гиперемия в сокращающейся мышце при физической работе, гиперемия поджелудочной железы и кишечной стенки в момент пищеварения, гиперемия секретирующей эндокринной железы, гиперемия слюнных желез. Увеличение сократительной активности миокарда ведет к росту коронарного кровотока, активация головного мозга сопровождается усилением его кровоснабжения. Реактивная (постишемическая) гиперемия наблюдается после временного прекращения кровотока (временной ишемии) и носит защитноприспособительный характер.
Патологическая артериальная гиперемия развивается под действием патологических раздражителей или в результате повышения чувствительности сосудов к обычным воздействиям. Она сопровождает развитие таких патологических процессов как воспаление, аллергия, ожоги, лихорадка.
Ее клинические примеры – гиперемия лица при инфекционных заболеваниях (корь, скарлатина), покраснение лица при невралгии тройничного нерва.
ВЕНОЗНАЯ ГИПЕРЕМИЯ - увеличение кровенаполнения органа или ткани вследствие нарушения оттока крови по венам.
Причины венозной гиперемии
1.внутрисосудистые – закупорка вен тромбом или эмболом,
2.внесосудистые – сдавление вен извне опухолью, спайкой, лигатурой, рубцом, отечной жидкостью, экссудатом, увеличенной маткой.
3.факторы самой сосудистой стенки – конституциональная слабость эластического аппарата вен, недостаточное развитие и пониженный тонус гладкомышечных элементов их стенок. Профессии, требующие ежедневного длительного (в течение нескольких часов) пребывания в вертикальном положении, способствуют венозной гиперемии в дистальных отделах нижних конечностей.
4.нарушения общей гемодинамики – ослабление функции правого желудочка сердца, уменьшение присасывающего действия грудной клетки, затруднение кровотока в малом круге кровообращения.
Механизмы артериальной и венозной гиперемий, этиология, патогенез.
Основные механизмы развития патологической артериальной гиперемии Различают два механизма: нейрогенный и связанный с действием местных химических (метаболических) факторов. Гиперемия, связанная с действием местных химических (метаболических) факторов, иногда называют миопаралитической, подчеркивая первичность нарушений сократительных свойств гладких мышц сосудов под влиянием химических веществ. Расширение сосудов вызывают гистамин, брадикинин, молочная кислота, избыток углекислоты, оксида азота, гипоксия, ацидоз тканевой среды
Нейрогенная артериальная гиперемия в зависимости от механизмов ее развития может быть нейротонической и нейропаралитической. Нейротонический механизм характеризуется преобладанием эффектов парасимпатических вазодилататорных влияний на сосудистую стенку (за счет ацетилхолина) по сравнению с симпатическими влияниями (примером является покраснение лица и шеи при патологических процессах во внутренних органах - яичниках, сердце; классическим примером нейротонической гиперемии у человека считается краска стыда или гнева на щеках). Нейропаралитический механизм заключается в снижении или отсутствии симпатических влияний на стенки артерий и артериол (например, при повреждении симпатических нервов, идущих к коже верхних конечностей, ушей, отмечается их покраснение; классическим примером нейропаралитической гиперемии у человека считается так называемый морозный румянец на щеках).
Проявлением нейропаралитического действия электрического тока считаются так называемые «знаки молнии» (зоны артериальной гиперемии по ходу прохождения тока при поражении молнией).
Изменение микроциркуляции при артериальной и венозной геперемий.
Расширение артериальных сосудов,
Ускорение кровотока по микрососудам,
Увеличение количества протекающей крови по сосудам гиперемированного участка,
Повышение внутрисосудистого давления,
Увеличение количества функционирующих капилляров,
Усиление лимфообразования и ускорение лимфообращения,
Уменьшение АВ разницы по кислороду.
Внешние признаки АГ
Покраснение зоны гиперемии.
Это обусловлено расширением кровеносных сосудов, увеличением количества функционирующих капилляров и повышением содержания оксигемоглобина в венозной крови.
Повышение температуры зоны гиперемии.
Артериальная кровь более теплая, кроме того, резко увеличиваются обменные процессы.
Увеличение тургора (напряжения) ткани.
Последствия -
Возможность разрывов сосудов с последующими кровотечениями и кровоизлияниями.
Венозная гиперемия.
Это состояние повышенного или (что очень важно!) неизмененного кровенаполнения органа или ткани при затрудненном оттоке крови по венам . ВГ может быть двух видов - общая и местная. Общее венозное полнокровие встречается при -
острых расстройствах (инфаркт миокарда, острый миокардит, миокардиодистрофия и т.д.); хронических расстройствах (пороки сердца, ИБС, фиброэластоз миокарда, хронический
миокардит, амилоидоз сердца).
Кроме того, венозное полнокровие может быть не только застойным, пассивным, но и активным (такая ситуация развивается в зонах коллатерального венозного полнокровия - в слизистой оболочке пищевода, прямой кишки, на передней брюшной стенке при открытии порто-кавальных анастомозов в условиях цирроза печени, а также при депонировании крови).
Длительно протекающая венозная гиперемия, сопровождается не только перестройкой венозного русла - выраженная гипертрофия мышечной оболочки вен, но и развитием веноартериальной реакции. Последняя заключается в рефлекторном спазме артериол и мелких артерий и сопровождается гипертрофией их стенок, впервые эта реакция была описана в 1935 г. Ф.Я.
Китаевым и легких при миткальном пороке, а позднее была обнаружена и в других органах. Сущность этой реакции заключается в предохранении капилляров от полнокровия и предупреждения обратного кровотока из венозной системы в артериальную и, как правило, встречается она в органах, имеющих малый спектр компенсаторно-приспособительных реакций (в частности, депонирования, оптимального венозного коллатерального полнокровия).
- Важнейшие причины венозной гиперемии:
А) нарушение работы сердца;
Б) уменьшение присасывающего действия грудной клетки;
В) нарушение проходимости в нем (обтурация тромбом или эмболом, а также внешнее сдавление вен рубцом, опухолью, жгутом, отечной жидкостью и т. д.).
Характер изменений микроциркуляторного русла при венозной гиперемии:
Расширение капилляров и венул,
Замедлением кровотока по микрососудам вплоть до стаза,
Повышение внутрисосудистого давления,
Маятникообразное движение крови в венулах,
Уменьшение интенсивности кровотока в области гиперемии,
Повышение проницаемости капилляров и венул и усиление фильтрации жидкости,
Нарушение лимфообращения,
Увеличение АВ разницы по кислороду.
Проявления и последствия
Острый венозный застой
Сдавление клеток. - per diapedesin
Проявления артериальной и венозной гиперемии.
Клинические признаки артериальной гиперемии – расширение мелких артерий и артериол, вен и капилляров, ускорение в них кровотока, пульсация мелких артерий и капилляров, увеличение числа видимых глазом сосудов, увеличение давления в артериолах, капиллярах и венах. В результате этого появляется: местная гиперемия, местное повышение температуры, увеличивается объем гиперемированного участка, повышается тургор тканей, усиливаются обмен веществ и функция органа.
Клинические проявления венозной гиперемии. Увеличение органа или участка ткани, цианоз, местное понижение температуры, отек, повышение давления в венах и капиллярах застойной области, замедление кровотока, выход эритроцитов за пределы сосудистого русла (диапетез). Длительное расширение вен приводит к растяжению их стенки, что может сопровождаться гипертрофией мышечной оболочки и явлениями варикозного расширения вен.
Последствия и значение артериальной и венозной гиперемии.
Значение артериальной гиперемии Артериальная гиперемия может иметь как положительное, так и отрицательное значение для организма. Это зависит от того: а) способствует ли она соответствию между интенсивностью микроциркуляции и метаболическими потребностями ткани и б) обусловливает ли она устранение каких-либо местных нарушений в них. Если артериальная гиперемия способствует всему этому, то ее роль положительна, а если нет, то она оказывает патогенное влияние.
Положительное значение артериальной гиперемии связано с усилением как доставки кислорода и питательных веществ в ткани, так и удаления из них продуктов метаболизма, что необходимо, однако, лишь в тех случаях, когда потребность тканей в этом повышена. При физиологических условиях появление артериальной гиперемии связано с усилением активности (и интенсивности обмена веществ) органов или тканей. Например, артериальную гиперемию, возникающую при сокращении скелетных мышц, усилении секреции желез, повышении активности нейронов и т.д., называют функциональной. При патологических условиях артериальная гиперемия также может иметь положительное значение, если она компенсирует те или иные нарушения. Такая гиперемия возникает в случаях, когда ткань испытывает дефицит кровоснабжения. Например, если местный кровоток был до того ослабленным (ишемия) вследствие сужения приводящих артерий, наступающая вслед за этим гиперемия, называемая постишемической, имеет положительное, т.е. компенсаторное значение. При этом в ткань приносится больше кислорода и питательных веществ, лучше удаляются продукты обмена веществ, которые накопились во время ишемии. Примерами артериальной гиперемии компенсаторного характера могут служить местное расширение артерий и усиление кровотока в очаге воспаления.
Отрицательное значение артериальной гиперемии может иметь место, когда потребность в усилении кровотока отсутствует или степень артериальной гиперемии избыточна. В частности, вследствие местного повышения давления в микрососудах могут возникать кровоизлияния в ткань в результате разрыва сосудистых стенок (если они патологически изменены) или же диапедеза, когда наступает просачивание эритроцитов сквозь стенки капилляров; может развиться также отек ткани.
Эти явления особенно опасны в центральной нервной системе.
Виды нарушений при венозной гиперемии.
1.Местные изменения связаны с кислородным голоданием ткани (гипоксией). При этом первоначально гипоксия обусловлена ограничением притока артериальной крови, а затем действием на тканевые ферментные системы продуктов нарушенного обмена, следствием чего является нарушение утилизации кислорода. Кислородное голодание вызывает атрофические и дистрофические изменения, избыточное разрастание соединительной ткани (цирроз печени при венозном застое, вызванном сердечной недостаточность).
2.Общие гемодинамические нарушения возникают при закупорке крупных венозных сосудов (воротная, нижняя полая вена), что сопровождается снижением артериального давления, нарушением питания жизненно важных органов.
6.Определение и причины ишемии.
ИШЕМИЯ - уменьшение кровенаполнения органа или ткани в результате ограничения или полного прекращения притока артериальной крови.
Типы ишемии в зависимости от причины и механизмов ее возникновения. Компрессионная ишемия – возникает в результате сдавления артерий извне лигатурой, рубцом, опухолью, инородным телом.
Обтурационная ишемия – возникает в результате частичного сужения или полного закрытия просвета артерий атеросклеротической бляшкой, тромбом или эмболом, инородным предметом.
Ангиоспастическая ишемия – возникает в результате спазма артерий, вызванных эмоциональным воздействием (страх, волнение, гнев), физическими факторами (холод, травма, механическое раздражение), химическими веществами, биологическими факторами (токсины бактерий). В основе спазма могут лежать нервные рефлекторные механизмы или непосредственное действие раздражителей на гладкие мышцы сосудов (вазопрессин).
7.Этиология, патогенез, проявления ишемии и ее последствия.
Компенсация нарушения притока крови при ишемии
При ишемии нередко наступает полное или частичное восстановление кровоснабжения пораженной ткани (даже если препятствие в артериальном русле остается). Это зависит от коллатерального притока крови, который может начинаться сразу же после возникновения ишемии. Степень такой компенсации зависит от анатомических факторов кровоснабжения соответствующего органа. К ним относятся особенности артериальных ветвлений и анастомозов.
Различают:
Органы и ткани с хорошо развитыми артериальными анастомозами (когда сумма их просвета близка по величине к таковой закупоренной артерии) - это кожа, брыжейка. В этих случаях закупорка артерий не сопровождается каким-либо нарушением кровообращения на периферии, так как количество крови, притекающей по коллатеральным сосудам, с самого начала бывает достаточным для поддержания нормального кровоснабжения ткани.
Органы и ткани, артерии которых имеют мало (или вовсе не имеют) анастомозов, и поэтому коллатеральный приток крови в них возможен только по непрерывной капиллярной сети. К таким органам и тканям относятся почки, сердце, селезенка, ткань мозга. При возникновении препятствия в артериях указанных органов в них возникает тяжелая ишемия, и в результате ее - инфаркт.
Органы и ткани с недостаточными коллатералями. Они весьма многочисленны - это легкие, печень, стенка кишечника. Просвет коллатеральных артерий в них обычно в большей или меньшей степени недостаточен, чтобы обеспечить коллатеральный приток крови.
Стадии патогенеза нарушений в участке, где произошла ишемия.
1.Нарушение энергетического обмена. Проявляются снижением тканевого дыхания, активацией гликолиза, уменьшение содержания в клетках АТФ. Это связано с недостаточной доставкой кислорода, снижением активности и синтеза ферментов, выходом ферментов из поврежденных клеток, разобщением окисления и фосфорилирования.
2.Нарушение энергозависимых процессов в клетках, вызванное уменьшением образования энергии. При этом нарушаются специфические функции клеток (сократительная, секреторная), механизмы активного транспорта веществ (работа ионных насосов), снижение биосинтеза белков. Как следствие развивается повреждение клеток и некробиотические изменения, что может заканчиваться образованием очага некроза – инфарктом.
3.Усиление биосинтеза компонентов соединительной ткани – коллаген, гликопротеины, которые являются основой для последующего склерозирования данного участка ткани или органа Признаки характерные для ишемии.
Побледнение участка органа или ткани, снижение его температуры, нарушение чувствительности (ощущение онемения, покалывания, «ползанья мурашек»), болевой синдром, уменьшение скорости кровотока и органа в объеме, понижение артериального давления на участке артерии, расположенном ниже препятствия, понижение напряжения кислорода на участке органа или ткани где произошла ишемия, уменьшение образования тканевой жидкости и снижение тургора ткани, нарушения функции органа или ткани, дистрофические изменения.
8. Виды, механизмы и причины стаза.
СТАЗ - это замедление и остановка тока крови в капиллярах, мелких артериях и венах органа или ткани.
Виды стаза и причины их развития
Все разновидности стаза подразделяют на первичные и вторичные.
Первичный (истинный капиллярный) стаз. В его патогенезе имеют значение два фактора.
1. внутрикапиллярная агрегация эритроцитов (их склеивание и образование конгломератов, затрудняющих кровоток),
2.замедление кровототока вследствие сгущения крови, за счет повышения проницаемости стенки сосудов, расположенных в зоне стаза.
Вторичный стаз подразделяется на: ишемический и венозный (застойный). Ишемический стаз является исходом тяжелой ишемии, при которой снижается приток артериальной крови в ткань, снижается артериовенозная разница давлений, резко замедляется скорость кровотока по микрососудам, отмечается агрегация форменных элементов крови и остановка крови в сосудах.
Венозный стаз является исходом венозной гиперемии, при которой снижается отток венозной крови, снижается артериовенозная разница давлений, отмечается застой крови в микрососудах, повышается вязкость крови, отмечается агрегация форменных элементов крови, и это обеспечивает остановку тока крови.
9.Проявления и последствия стаза.
Стаз – это замедление и остановка крови в микрососудах органа или ткани.
Причины: 1) ишемия; б) факторы, вызывающие агрегацию и агглютинацию клеток крови в микрососудах органа или ткани.
Разновидности стаза условно подразделяют на 3 (три) группы:
Истинный капиллярный стаз – его формирование начинается с активации и агрегации клеток крови, адгезии их к сосудистой стенке.
Ишемический стаз – развивается в результате: а) полного прекращения притока крови из соответствующих артерий в капиллярную сеть; б) замедлением скорости кровотока; в) турбулентным характером кровотока (смена ламинарности на турбулентность приводит к активации, агрегации и адгезии форменных элементов крови).
Венозно-застойный стаз – является результатом: а) замедления оттока венозной крови; б) сгущения крови; в) изменения вязкости; г) повреждения клеток с освобождением и активацией факторов свертывания.
Проявления и последствия стаза. Могут быть внешние и микроскопические.
Внешние – в зависимости от вида стаза внешние признаки соответствуют признакам венозного застоя или ишемии.
Микроскопические – в просветах капилляров неподвижные агреганты эритроцитов и других клеток крови. Величина просвета капилляров зависит от причины стаза. На фоне ишемии диаметр уменьшен. В условиях венозного застоя – просвет сосудов увеличен, имеется отек тканей и микрокровоизлияния.
При быстром устранении причины стаза ток крови в сосудах микроциркуляторного русла восстанавливается и в тканях не развивается каких-либо существенных изменений. Длительный стаз обуславливает развитие дистрофических изменений в тканях и их гибель.
Механизмы истинного капиллярного стаза. Непосредственная причина стаза – внутрисосудистая агрегация эритроцитов. Она м.б.: а) локальная; б) генерализованная.
Факторы внутрисосудистой агрегации эритроцитов:
Химические факторы, повреждающие стенки капилляров:
= увеличение проницаемости сосудистой стенки и переход в ткани жидкостей, солей и низкодисперсных белков;
= увеличение концентрации в крови крупнодисперсных белков (глобулинов и фибриногена; = адсорбция этих белков на поверхности эритроцитов уменьшает их поверхностный потенциал; = агрегация эритроцитов.
Химические повреждающие агенты, проникающие внутрь капилляров. Изменяют физикохимические свойства эритроцитов и вызывают их агрегацию
Функциональное состояние артериол:
= сужение приводящих артериол – способствует агрегации за счет замедления кровотока;
= выброс гистамина – угнетает агрегацию за счет ускорения кровотока.
10. Причины расстройств микроциркуляции. Типовые формы нарушений микроциркуляции.
Нарушения микроциркуляции
Расстройства микроциркуляции делят на внутрисосудистые нарушения, связанные с изменением самих сосудов и внесосудистые.
Внутрисосудистые нарушения. Наиболее важные внутрисосудистые нарушения – это расстройства реологических особенностей крови из-за изменения суспензионной стабильности клеток крови и ее вязкости. В нормальных условиях кровь имеет характер стабильной суспензии клеток крови и ее части. Сохранность этой стабильности обеспечивается величиной отрицательного заряда эритроцитов и тромбоцитов, определенным соотношением белков плазмы (альбумины с одной стороны и глобулины и фибриногена с другой), а также достаточной скоростью кровотока.
Уменьшение величины отрицательного заряда эритроцитов, причиной которого чаще всего является абсолютное или относительное увеличение содержания положительно заряженных молекул глобулинов или фибриногена и их адсорбция на поверхности эритроцитов, что приводит к снижению суспензионной стабильности крови и агрегации эритроцитов и других клеток крови. Данный феномен получил название «сладж». Основные особенности сладжирования крови - это прилипание друг к другу эритроцитов, лейкоцитов и тромбоцитов и повышение вязкости крови, что затрудняет ее перфузию через микрососуды.
Нарушение проницаемости стенки сосудов
Сосуды обмена (капиллярные и венулы) характеризуются двумя основными функциями:
осуществлением движения крови и способностью пропускать в направлении кровь-ткань и обратно воду, растворенные газы и белковые вещества. Регуляция кровообращения в системе сосудов обмена подчиняется закономерностям пре- и посткапиллярного кровотока, а также местным гуморальным влияниям. Морфологической основой проницаемости капиллярных сосудов и венул является эндотелий сосудов и базальная мембрана. Механизм перехода веществ через сосудистую стенку может быть пассивным и активным. При патологии часто наблюдается увеличение или уменьшение интенсивности перехода веществ через сосудистую стенку не только вследствие изменения интенсивности кровотока, но и в результате истинного нарушения сосудистой проницаемости, которое сопровождается изменением структуры стенки самого сосуда. В морфологическом отношении повышение сосудистой проницаемости характеризуется увеличением промежутков между эндотелиоцитами вследствие их сокращения и усилением везикулярного транспорта. В механизме повышения сосудистой проницаемости при травме, ожоге, аллергии, воспалении большое значение придают кислородному голоданию, сдвигу реакции среды в кислую сторону (ацидозу), накоплению местных метаболитов, образованию биологически активных веществ.
Внесосудистые нарушения.
Наиболее важными являются два типа внесосудистых нарушений.
1 тип – это нарушения которые влияют на состояние микроциркуляции и служат дополнительным патогенетическим механизмом ее нарушений в условиях патологии. При некоторых патологических процессах (воспаление, аллергическое повреждение тканей) из тканевых базофилов при их дегрануляции в окружающее микрососуды интерстициальное пространство выбрасываются биологически активные вещества и ферменты.
2.тип нарушений окружающей соединительной ткани включает в себя изменения периваскулярного транспорта интерстициальной жидкости вместе с растворенными в ней веществами, образования и транспорта лимфы.
11. Причины и механизмы «сладжа».
Причины, приводящие к этим нарушениям 1.при перевязке сосудов, 2.при различных видах шока, 3.олигурии, 4.острой сосудистой недостаточности. 5.при гипотермии, 6.при заболеваниях сопровождающихся увеличением в крови содержания глобулинов и фибриногена и снижением содержания альбумина.
В зависимости от характера воздействия сладж может быть обратимым (только при агрегации эритроцитов) и необратимым (агглютинация эритроцитов). Последовательность образования агрегатов клеток крови.
В первые минуты после повреждения, преимущественно в капиллярных сосудах образуются агрегаты из тромбоцитов и хиломикронов. Они плотно фиксируются к стенке микрососудов образуя белый тромб. В первые часы после повреждения уже образуются эритроцитарные агрегаты. Патофизиологические последствия агрегации эритроцитов проявляются нарушением микроциркуляции и последующими нарушениями метаболизма и функции органов и систем.
Нарушения микроциркуляции обусловлены:
1.частичной обтурацией сосудов вследствие оседания на их внутренней оболочке эритроцитарных агрегатов, обладающих массой, большей по сравнению с массой отдельных эритроцитов.
2.полной обтурацией микрососудов агрегатами тромбоцитов и эритроцитов. При этом крупные агрегаты, состоящие из нескольких сотен эритроцитов, могут полностью перекрыть просвет артериол и венул. Агрегаты меньших размеров достигают более мелких сосудов, вызывая их эмболию.
3.резким замедлением кровотока, сепарацией (отделением) плазмы от эритроцитов, маятникообразным движением плазмы со взвешенными в ней агрегатами, стазом. При этом происходит набухание стенки сосудов, происходит повышение ее проницаемости, выход жидкости за ее пределы, сгущение крови и повышение вязкости. Создаются условия для образования множественных микротромбов с дальнейшим нарастанием тяжести микроциркуляторных расстройств. Эти нарушения микроциркуляции, которые характеризуются нарушения метаболизма, функций органов и тканей, а также недостаточным уровнем трофического обеспечения, называют капилляро-трофической недостаточностью.
Типы сладжа. 1.классический – крупные размеры агрегатов, неровные очертания контуров и плотная упаковка эритроцитов. 2.декстрановый – различная величина агрегатов, округлые очертания, плотная упаковка эритроцитов. 3.аморфный грануловидный – мелкие агрегаты в виде гранул, состоящих из нескольких эритроцитов.
12. Тромбоз, виды тромбов.
Тромбоз – это процесс прижизненного образования на внутренней поверхности стенки сосудов сгустков крови, состоящих из ее элементов. Тромбы бывают: пристеночные (частично уменьшают просвет сосуда) и закупоривающие.
В зависимости от строения различают: Белый тромб – образуют тромбоциты, лейкоциты и небольшое количество белков плазмы, красные – образуют эритроциты, связанные между собой нитями фибрина и смешанные – чередующиеся белые и красные слои.
Основные три фактора, способствующие тромбообразованию (триада Вирхова).
1.Повреждение сосудистой стенки – возникает под действием физических факторов (механическая травма), химических, биологических (эндотоксины бактерий) факторов, также при нарушении питания и метаболизма сосудистой стенки.
2.Нарушение активности свертывающей и противосвертывающей систем крови и сосудистой стенки. Для образования тромбов большое значение имеет как повышение активности свертывающей системы крови за счет повышения в ней концентрации прокоагулянтов, так и понижение активности противосвертывающей и фибринолитической систем.
3.Замедление кровотока. В венах тромбы образуются чаще, чем в артериях, в сосудах нижних конечностей чаще, чем в верхних конечностях.
Фазы процесса тромбообразования состоит из двух фаз: клеточной и плазматической.
Клеточная фаза – адгезия, агрегация и агглютинация тромбоцитов. Плазматическая фаза – цепь последовательных биохимических реакция свертывания крови, конечным результатом которых является образование фибрина – как важного компонента тромба.
13. Эмболия. Классификация. Этиология, патогенез.
Эмболия – закупорка сосудов телами, приносимыми током крови или лимфы. Эти тела называются эмболами.
Классификация:
1.В зависимости от происхождения эмболов, эмболия бывает экзогенная и эндогенная.
2.По локализации эмболия бывает большого, малого круга кровообращения, и системы воротной вены.
3.Редко бывает ретроградная эмболия – когда движение эмбола не подчиняется законам гемодинамики, а движется по силе тяжести самого эмбола.
И парадоксальная эмболия – наблюдается при незаращении межпредсердной или межжелудочковой перегородки, в результате чего эмболы из вен большого круга кровообращения и правой половины сердца переходят в левую, минуя малый круг.
Эмболия экзогенного происхождения.
1.Воздушная – при ранении крупных вен головы и шеи, которые плохо спадаются и давление в них близко к нулю или отрицательное. В результате в поврежденные вены засасывается воздух, особенно на высоте вдоха.
2.Газовая эмболия – развивается при резком перепаде атмосферного давления от повышенного к нормальному (у водолазов), или от нормального к пониженному (при быстром подъеме на высоту или разгерметизации кабины летательного аппарата). При этом уменьшается растворимость газов в тканях и крови, происходит переход газов из растворенного состояния в газообразное, и закупорка пузырьками этих газов капилляров, расположенных главным образом в системе большого круга кровообращения.
3.Бактериальная, паразитарная и плотными инородными телами.
Эмболия эндогенного происхождения.
1.Эмболия тромбом (тромбоэмболия) – оторвавшимся тромбом,
2.жировая – повреждение костного мозга, подкожной клетчатки,
3.тканевая – обусловлена занесением в кровеносное русло обрывков различных тканей организма при повреждении, эмболия клетками злокачественных опухолей, при метастазировании,
4.эмболия околоплодными водами – при попадании околоплодных вод во время родов в поврежденные сосуды матки на участке отделившейся плаценты
