
esmeron_2011-1
.pdf
Клиренс плазмы был снижен до 1,8 мл/кг/мин, а Vdss, t1/2-beta и MRT были заметно повышены: до 1,28 л/кг, 29,5 и 15,5 ч соответственно. Экскреция препарата с мочой была такой же, как и у пациентов во время хирургических вмешательств. Метаболиты в моче обнаружены не были.
III.4. Эффективные концентрации Эсмерона
III.4.1. Исследования с фармакокинетико-динамическим моделированием
Особенности фармакокинетики и фармакодинамики Эсмерона были изучены Wierda и соавт. у взрослых людей, грудных детей и детей старшего возраста [224, 227–229]. В этих исследованиях проводилась оценка следующих параметров: константа равновесия (Ke0), концентрация препарата в эффективном компартменте тела при 50% блокаде нервно-мышечного проведения (EC50), рассчитанная болюсная доза, обеспечивающая 90% блокаду (ED90), а также наклон кривой зависимости эффекта от концентрации препарата (гамма). Результаты фармакокинетико-динамического моделирования представлены в таблице 5. Установлено различие по параметрам Ke0, EC50 и гамма между грудными детьми и детьми старшего возраста [227].
Полученные результаты свидетельствуют о том, что концентрации Эсмерона, необходимые в эффективном компартменте для индукции 50% блокады нервно-мышечной проводимости у грудных де-
Таблица 5
Показатели фармакокинетико-динамического моделирования у грудных детей, детей старшего возраста и у взрослых
|
|
Грудные дети |
Дети старшего |
Взрослые |
|
Показатель |
Ед. изм. |
возраста |
|||
[227] |
[224, 228] |
||||
|
|
[227] |
|||
|
|
|
|
||
|
|
|
|
|
|
N |
мин-1 |
5 |
5 |
5 |
|
Ke0 |
0,25 |
0,32 |
н/д |
||
EC50 |
мл/л |
1,19 |
1,65 |
1,5 |
|
Гамма |
|
5,7 |
3,9 |
4,3 |
|
ED90 |
мг/кг |
0,26 |
0,34 |
0,3 |
Ke0 – константа равновесия между эффективным участком и центральным компартментом; EC50 – концентрация в эффективном компартменте, обеспечивающая 50% блокаду нервно-мышечной проводимости; ED90 –рассчитанная болюсная доза, обеспечивающая 90% блокаду; гамма – наклон кривой (крутизна) зависимости эффекта от концентрации препарата; н/д – нет данных.
21
тей наименьшие, а у детей старшего возраста наибольшие. Это позволило сделать предположение о том, что грудные дети в большей, а дети старшего возраста в меньшей степени чувствительны к Эсмерону, чем взрослые. Изменения наклона кривой зависимости концентрации от времени соответствуют такому предположению.
III.4.2. Эффективные концентрации в плазме крови
III.4.2.1. Эффективные концентрации в плазме крови
увзрослых
Влитературе имеется очень мало сведений об абсолютных концентрациях миорелаксантов в плазме крови. Тем не менее этот вопрос может представлять интерес, когда предполагается наличие уменьшен-
ной или увеличенной чувствительности рецепторов. Значения EC50, установленные в описанных выше исследованиях с фармакокинетикодинамическим моделированием, дают качественную оценку эффективной плазменной концентрации препарата при наличии 50% нервномышечного блока, допускающую существование равновесия между различными компартментами тела с почти равными концентрациями в них действующего вещества [227, 228]. В этом случае эффективная концентрация Эсмерона, необходимая для достижения 50% блока у здоровых взрослых людей, должна составлять около 1,5 мкг/мл.
III.4.2.2. Эффективные концентрации в плазме крови в условиях гипотермии
Влияние гипотермии на концентрацию Эсмерона в плазме крови при использовании поддерживающего режима введения препарата изучалось при операциях аортокоронарного шунтирования, во время которых хирургические вмешательства частично были выполнены в условиях гипотермии [195, 196]. Определение концентрации препарата в плазме крови проводилось каждый раз, когда ответ на единичный стимул (single twitch response) достигал 5% от контрольной величины. В состоянии нормотермии концентрация Эсмерона в плазме в среднем составляла 1,4 мкг/мл. При гипотермии и после согревания пациента концентрации препарата были примерно на 50% ниже [196].
III.4.2.3. Эффективные концентрации в плазме крови у крайне тяжелых больных
При продолжительном введении Эсмерона в ОИТ (до 110 ч; медиана продолжительности 40 ч), средняя концентрация препарата в
22
плазме крови при устойчивом состоянии нервно-мышечного блока составляла 1,9 мкг/мл, что практически соответствовало значениям, полученным во время хирургических вмешательств. Какой-либо зависимости от продолжительности введения препарата не установлено, то есть чувствительность рецепторов к Эсмерону со временем, вероятно, не меняется [178].
III.5. Элиминация
В организме миорелаксанты подвергаются метаболизму под действием ферментов или саморазрушаются (элиминация Хофмана). Характер элиминации миорелаксантов определяет продолжительность их действия.
Деполяризующие миорелаксанты (сукцинилхолин) гидролизуются холинэстеразой плазмы крови – псевдохолинэстеразой. При генетической недостаточности псевдохолинэстеразы действие сукцинилхолина может продолжаться до 2–6 ч, по другим данным, длительная релаксация скелетных мышц может длиться 6–8 ч вместо 5–7 мин из-за медленного гидролиза препарата [81, 236]. Гидролиз деполяризующих препаратов также замедляется при гипотермии, при беременности, заболеваниях печени и под воздействием некоторых лекарственных средств [74].
Наиболее продолжительно действующие недеполяризующие миорелаксанты главным образом выделяются почками (пипекуроний). Препараты средней продолжительности действия в большей степени выделяются вместе с желчью в неизменном виде и в виде метаболитов (векуроний и рокуроний) или подвергаются спонтанному гидролизу в плазме (атракурий, цис-атракурий) [1–4, 238].
Элиминация Хофмана – это спонтанная биодеградация миорелаксантов (атракурий, цис-атракурий) неферментативным путем в организме при физиологических значениях pH ≈ 7,4 и t° ≈ 37 °С. Скорость разрушения миорелаксантов зависит от рН среды: увеличивается при повышении рН, поэтому при ацидозе глубина и продолжительность блока нервно-мышечной передачи возрастают и снижаются при алкалозе. Это обстоятельство затрудняет прогноз относительно длительности нервно-мышечной блокады. Скорость саморазрушения этих миорелаксантов также зависит от температуры тела, при снижении температуры тела с 37° С до 23° С время полувыведения атракурия может увеличиться с 18 до 49 мин, поэтому при использовании данного препарата в условиях гипотермии доза его должна быть значительно (до 50%) снижена [1–4, 238].
23
При использовании препаратов, которые элиминируются с желчью и мочой, следует принимать во внимание наличие заболеваний печени и почек: при печеночной или почечной недостаточности метаболизм миорелаксантов замедляется и их действие становится более продолжительным [1–4, 238].
Первыми экскрецию Эсмерона с калом и мочой исследовали Proost и соавт. Поскольку предполагалось, что препарат неустойчив в щелочной среде, имеющейся в норме в кишечнике, дизайн исследования предполагал изучение элиминации Эсмерона с желчью, получаемой через Т-образные дренажи с жидкостью, выделяющейся через стому, а также содержание препарата в ткани печени, участки которой были получены во время хирургических операций [164]. Результаты оказались скорее разочаровывающими, чем информативными, ввиду многочисленных практических и методологических сложностей.
По этой причине пришлось расширить исследование, включив в число его участников еще 10 пациентов, у которых была изучена элиминация Эсмерона с мочой и калом, что было признано допустимым при используемой методике анализа. В течение 1–8 дней после хирургического вмешательства в кале определялись различное содержание Эсмерона. По причине нечастого стула и, в некоторых случаях, ранней выписки из стационара, диапазон суммарного количественного выделения препарата в моче и кале составил 16–100%. Среднее количество Эсмерона, выделенного с мочой и калом, оказалось равным 27 и 31% соответственно. Средний процент суммарного выделения Эсмерона составил 58%. У четырех пациентов величина суммарной экскреции была более 80% от введенной дозы. Доля метаболитов в экскретируемых средах составляла очень малый процент общего выделения: менее 0,4% в моче и менее 2,5% в каловых массах [164].
Для более подробного изучения экскреции Эсмерона у восьми здоровых добровольцев было проведено исследование баланса массы с использованием Эсмерона, меченного радиоактивным углеродом [44, 181]. После введения интубационной дозы меченого Эсмерона около 90% препарата экскретировалось на протяжении 9 дней с мочой и калом примерно в равном соотношении. В среднем 2,7% введенного радиоактивного углерода выделялось в составе углекислого газа с выдыхаемым воздухом. Экскреция с мочой оказалась наибольшей в течение первых 12 ч (68% от общего количества радиоактивного углерода, выделенного с мочой). Верно ли то, что и с желчью на протяжении первых 12 ч выделяется бóльшая часть препарата – неясно, поскольку неизвестно время пассажа желчи через кишечник.
24
III.6. Метаболиты
Ни в одном из исследований метаболиты Эсмерона выявлены не были.
Как правило, метаболиты миорелаксантов не вызывают серьезных побочных эффектов при проведении обычного анестезиологического пособия. Тем не менее, если миорелаксанты вводятся продолжительный период времени, то даже те из них, которые обладают средней продолжительностью действия, могут приводить к развитию побочных эффектов из-за наличия метаболитов.
Продуктами элиминации Хофмана являются лауданозин и моночетвертичный акрилат. Метаболит атракурия лауданозин может обладать возбуждающим действием на центральную нервную систему и снижать судорожный порог, а моноакрилаты могут быть высокоактивными и токсичными. Выведение цисатракурия считается в основном органонезависимым, однако его метаболиты (лауданозин и четвертичный моноакрилат) выводятся через печень и почки. Токсичность лауданозина, чувствительность к температуре тела и рН, характерные для атракуриума, в равной степени свойственны и ци-
сатракурию [4, 13, 112, 136].
Незначительная часть пипекурония подвергается в печени деацетилированию (20%), однако основная его часть и его метаболиты выводятся главным образом почками (70%), поэтому его не следует применять при почечной патологии, поскольку длительность действия пипекурония увеличивается у таких пациентов [4].
Продукты метаболизма векурония, такие как 3-дезацетил-веку- роний, так же как и сам препарат, способны вызывать блокаду нервно-мышечной проводимости, что в ряде ситуаций может пролонгировать его эффект [13, 112, 136]. Предполагаемыми метаболитами Эсмерона являются 17-дезацетил-Эсмерон и 16N-дезаллил- Эсмерон. Для них характерна очень слабая миорелаксирующая активность, поэтому маловероятно, что они оказывают серьезное влияние на фармакодинамические характеристики Эсмерона [136]. Кроме того, эти метаболиты не были выявлены в существенных количествах у пациентов, получавших Эсмерон, ни в плазме крови, ни в моче, ни в кале.
25
IV. Фармакодинамика
Эсмерон обладает дозозависимым эффектом, что позволяет применять его в большинстве клинических ситуаций. Через 60 с после введения препарата в рекомендуемой начальной дозе 0,6 мг/кг (2×ED90) хорошие или отличные условия для интубации достигаются у большинства пациентов. Данные клинических исследований показывают, что в этой стандартной интубационной дозе Эсмерону присущи такая же продолжительность действия и скорость восстановления, что и другим миорелаксантам средней продолжительности действия. При использовании более высоких доз Эсмерона начало его действия может быть быстрее, а длительность действия – дольше. При использовании более низких доз начало действия может быть позже, а продолжительность действия – короче. Тем не менее при соответствующем уровне анестезии хорошие или отличные условия для интубации могут быть достигнуты при использовании более низких доз Эсмерона в течение 90–120 с. Устранение нервно-мышечной блокады легко достигается назначением антихолинэстеразных препаратов.
IV.1. Время начала действия
Начало действия интубационной дозы Эсмерона быстрее, чем у всех имеющихся недеполяризующих миорелаксантов [8, 29, 68, 78, 109, 230]. Предполагается, что основная причина быстрого развития нервно-мышечного блока при использовании Эсмерона – это его относительно низкая сила действия [92]. Это обеспечивает наличие большего количества молекул миорелаксанта в кровотоке, что приводит к значительному смещению градиента концентраций в сторону биофазы рецепторов [30, 52].
Основная причина значимости показателя времени начала действия миорелаксанта связана с тем, что это время является важным фактором, определяющим скорость развития адекватных условий для интубации [8]. В то же время, это понятие не такое четкое, как может показаться на первый взгляд. Скорость развития адекватных условий для интубации по данным различных балльных систем указывает на динамичный характер развития блока, причем о синхронности его наступления в жевательной мышце и различных мышцах гортани, включая голосовые связки, речь не идет.
Тем не менее время начала действия определяет тот промежуток времени, который должен пройти между введением миорелаксанта и ларингоскопией, хотя для каждого миорелаксанта следует оце-
26
нить, насколько время развития нервно-мышечной блокады в мышце, приводящей большой палец кисти, совпадает с формированием адекватных условий для интубации. В отношении Эсмерона было показано, что начало его действия в мышцах гортани происходит быстрее, чем в мышце, приводящей большой палец кисти, где обычно измеряют этот параметр, при этом хорошие и отличные условия для интубации развиваются быстрее, чем полная нервно-мышечная блокада [55, 129, 130].
|
|
|
|
|
Таблица 6 |
|
Зависимость времени начала действия от дозы Эсмерона |
||||
|
|
|
|
|
|
|
Доза (мг/кг) |
|
Время начала действия |
|
Ссылки |
|
|
|
|||
|
|
|
|
|
|
|
0,3–0,45 |
|
Среднее 2–4 мин |
97, 108, 161, 163 |
|
0,6 |
|
Короткое 1–2 мин |
6, 14, 29, 68, 129 |
||
|
0,9–1,0 |
|
Ультракороткое 45–60 с |
46, 148, 136, 226 |
|
|
|
|
|
|
|
Вопределенных пределах время начала действия зависит от введенной дозы, как показано в таблице 6.
Помимо дозы на время начала действия могут влиять иные факторы, в частности, применяемый метод стимуляции нерва: однократным импульсом (Single Twitch) или серией из четырех импульсов (train-of-four, TOF). Хотя режим TOF в целом считается более чувствительным и надежным методом оценки нервно-мышечной функции, чем стимуляция однократным импульсом, было показано, что более высокая частота стимулов при использовании TOF-стимуля- ции может влиять на процесс нервно-мышечной передачи за счет повышения температуры стимулируемой мышцы и ее чувствительности к недеполяризующим препаратам. Таким образом, с учетом этих обстоятельств, результаты TOF могут в большей степени отражать состояние мышцы, приводящей большой палец кисти, а не состояние релаксации организма пациента в целом [58, 123].
Галогенизированные ингаляционные анестетики, которые, как известно, влияют на продолжительность действия Эсмерона, не изменяют время начала его действия [72]. Потенциирование эффекта нервно-мышечного блока со стороны этих препаратов проявляется только при длительной анестезии [6].
Вцелом, у разных пациентов следует ожидать колебаний показателя времени начала действия препарата в широких пределах.
27

IV.2. Время и условия для интубации
Клинические исследования показали, что хорошие и отличные условия для интубации трахеи могут быть достигнуты не только при использовании стандартной интубационной дозы Эсмерона (0,6 мг/кг), но и при более низких (0,3–0,45 мг/кг) и высоких дозах (до 1,2 мг/кг) во время сбалансированной анестезии или при быстрой последовательной индукции анестезии [42, 109, 160, 161, 163, 166]. Для последней рекомендуется доза 1,0 мг/кг.
IV.2.1. Условия для интубации после введения стандартной интубационной дозы
У большинства пациентов клинически приемлемые условия для интубации достигались через 60 с после введения Эсмерона в дозе 0,6 мг/кг, что было продемонстрировано для взрослых пациентов и детей [42, 69, 82, 127, 166, 185, 205]. В одном из исследований был сделан вывод о том, что Эсмерон является хорошей альтернативой сукцинилхолину для быстрой интубации пациентов при операции аортокоронарного шунтирования [184].
Поскольку вызванная Эсмероном нервно-мышечная блокада мышц гортани развивается быстрее, но не бывает такой глубокой,
|
120 |
|
|
|
|
|
|
100 |
|
|
|
|
Гортань |
|
80 |
|
|
|
|
Мышца, |
|
|
|
|
|
приводящая |
|
|
|
|
|
|
|
|
% |
60 |
|
|
|
|
большой |
|
|
|
|
палец кисти |
||
Т1, |
|
|
|
|
||
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
20 |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
0,0 |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
|
|
|
Время, мин |
|
|
|
Рис. 3. Развитие нервно-мышечного блока мышц гортани и мышцы, приводящей большой палец кисти после введения Эсмерона в дозе 0,5 мг/кг. По Meistelman и соавт. [129].
28
как блокада мышцы, приводящей большой палец кисти (рис. 3), оказывается, что интубацию можно выполнить до момента достижения полного блока аддуктора [42, 130, 166]. Эти данные совпадают с наблюдениями, которые были сделаны ранее при изучении векурония [50, 51].
Dubois и соавт. подтвердили эти данные в клинической практике и показали, что при использовании Эсмерона хорошие или отличные условия для интубации достигаются до момента наступления 100% блока, то есть раньше, чем время начала действия (табл. 7) [55]. Авторы сравнили Эсмерон с сукцинилхолином для интубации 24 пациентов, получавших анестезию тиопенталом/фентанилом/закисью азота. Интубацию выполняли сразу после падения ответа на первый стимул (T1) на 80% при TOF-стимуляции (T1 80). Хотя было обнаружено, что Эсмерон начинает действовать несколько позже, чем сукцинилхолин, время до завершения интубации было одинаковым в обеих группах.
В нескольких исследованиях проводилось прямое сравнение времени начала действия и условий для интубации после введения Эсмерона в дозе 0,6 мг/кг и сукцинилхолина в дозе 1,0–1,5 мг/кг [42, 55, 82, 166, 214]. Оказалось, что условия для интубации через 60 с после введения Эсмерона были такими же хорошими, как и после применения сукцинилхолина (рис. 4). Кроме того, не было установлено статисти-
Таблица 7
Фармакодинамические характеристики
(среднее ± ошибка средней SD) и условия для интубации после введения Эсмерона в дозе 0,6 мг/кг или сукцинилхолина в дозе 1,0 мг/кг. Время интубации: время до завершения интубации.
По Dubois и соавт. [55]
|
|
Эсмерон |
|
Сукцинилхолин |
||
|
|
|
||||
|
|
|
|
|
|
|
|
N |
12 |
|
|
12 |
|
|
Время начала действия (с) |
130 (±46) |
74 |
(± |
37) |
|
|
T1 80 (с) |
70 (±24) |
41 |
(± |
15) |
|
|
Время интубации (с) |
85 (±23) |
76 |
(± |
29) |
|
|
Оценка условий интубации: |
|
|
|
|
|
|
Отлично |
9 |
|
|
9 |
|
|
Хорошо |
3 |
|
|
2 |
|
|
Плохо |
0 |
|
|
1 |
|
|
Неадекватно |
0 |
|
|
0 |
|
|
Клиническая продолжительность |
|
|
|
|
|
|
действия (мин) |
30 (±10) |
8 |
(± |
2) |
|
|
|
|
|
|
|
|
29
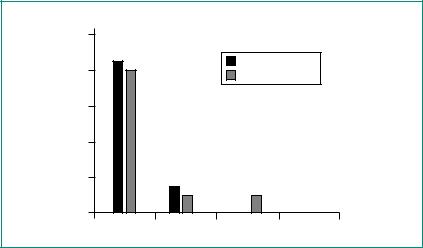
чески значимого различия условий для «отсроченной» интубации через 90 с [42, 82]. Плохие или неадекватные условия эпизодически возникали при использовании обоих препаратов, как через 60 с, так и через 90 с или позже. Причинами для «отсроченной» интубации после введения сукцинилхолина или Эсмерона были повышенный тонус жевательной мышцы, закрытые или движущиеся голосовые связки или трудности, обусловленные анатомическими особенностями.
% |
|
|
|
100 |
|
|
|
80 |
|
Эсмерон |
|
|
Сукцинилхолин |
||
|
|
||
60 |
|
|
|
40 |
|
|
|
20 |
|
|
|
0 |
|
|
|
Отличные |
Хорошие |
Плохие |
Неадек- |
|
|
|
ватные |
Рис. 4. Условия для интубации через 1 мин после введения Эсмерона в дозе 0,6 мг/кг (n=20) или сукцинилхолина в дозе 1,0 мг/кг (n=10). По Puhringer и соавт. [166].
Авторы этих публикаций в целом сходятся на том, что, несмотря на различия фармакодинамики Эсмерона и сукцинилхолина, включая различное время начала действия, определяемое по мышце, приводящей большой палец кисти, условия для интубации через 60 с после введения соответствующих миорелаксантов в стандартных интубационных дозах одинаковы [42, 55, 82, 166].
IV.2.2. Условия для интубации после введения низкой интубационной дозы
При использовании для интубации низких доз Эсмерона (0,3–0,45 мг/кг) приемлемые условия для интубации обеспечиваются:
30
