
- •Введение
- •Глава 1
- •Измененная перфузия
- •Микроэмболия
- •Глава 2
- •Физиология головного мозга
- •Повреждение головного мозга в условиях искусственного кровообращения и стратегии нейропротекции
- •Фармакологические вмешательства
- •Список литературы
- •Глава 6
- •Энцефалопатический синдром
- •Судорожные синдромы
- •Список литературы
Фармакологические вмешательства
Более глубокое понимание патофизиологии нейронального повреждения дает надежду на успешное использование фармакологической защиты при кардиохирургических вмешательствах в условиях искусственного кровообращения. Необходимость применения неиропротекторов на всех этапах кардиохирургических операций обусловлена большим числом факторов, которые могут поражать центральную нервную систему как интраоперационно, так и в послеоперационном периоде. В настоящее время нет единой точки зрения на профилактическую нейропротекцию в кардиохирургии, хотя выбор препаратов достаточно широк [155, 158]. За исключением некоторых препаратов для анестезии, многие прототипы ней-ропротективных препаратов первоначально были использованы для лечения инсультов. Многочисленные наблюдения за тем, что некоторые барбитураты могут уменьшать метаболические потребности головного мозга, способствовали проведению исследований по их нейропротективному потенциалу. В 1986 году были впервые представлены результаты применения барбитуратов для нейропро-текции [137].
Барбитураты угнетают ядра ретикулярной формации ствола головного мозга и вызывают седативный и снотворный эффект. Механизм их действия связывают в настоящее время с торможением передачи нервных импульсов за счет блокады K/Na-насосов на уровне пре- и постсинаптических мембран нервных клеток. Возбудимость нейронов понижается вследствие стабилизации потенциала клеточных мембран, причем потребление О2 головным мозгом падает на 20-30% за счет уменьшения функциональной активности и угнетения окислительных процессов нейронов. Нейропротектив-ное действие барбитуратов включает в себя угнетение метаболизма ГМ, уменьшение отека, образования свободных радикалов и выброса возбуждающих нейротрансмиттеров [11, 103]. Экспериментальные данные указывают на то, что терапия барбитуратами улучшает исход на моделях неполной ишемии [120], однако эффективность их использования для защиты головного мозга во время ИК не была доказана. В 1982 году было исследовано влияние тиопентала (15 мг/кг) на степень неврологической дисфункции у 204 кардиохирургических пациентов [180]. Хотя результаты и показали лучшую защиту головного мозга при применении тиопентала, различия между группами были недостоверными. Подобное исследование из Института сердца в Техасе включало 182 пациента, оперированного на открытом сердце [137]. Неврологическая оценка этих пациентов на 10-й день после операции выявила отсутствие неврологического дефицита в обследуемой группе, тогда как в контрольной группе частота неврологических осложнений составила 7,5%. Это было первое исследование, которое продемонстрировало эффективность барбитуратов в нейропротекции в клинической практике [121].
Большое исследование нейропротективного действия барбитуратов было проведено в 1991 году [203]. Триста пациентов, оперированных в условиях гипотермического ИК (28 °С) по поводу ишемической болезни сердца (ИБС), были разделены на две группы: в первую вошли больные, которым на протяжении всего ИК вводился тиопентал для получения электрического молчания на ЭЭГ, вторая группа была контрольной. Оценка неврологического статуса проводилась на 2-й и 5-й день после операции. В обследуемой группе больных отчетливый нейропротективный эффект тиопентала не был достигнут, кроме того, пациенты в этой группе требовали более высоких доз инотропной поддержки, чем в контрольной [137].
При внедрении в широкую клиническую практику пропофола неизбежно встал вопрос о его нейропротективных свойствах у кардиохирургических пациентов. Механизм действия пропофола, как и большинства средств для внутривенной анестезии, до конца не известен. Предполагается, что на фоне его введения идет подавление у-аминомасляной кислоты (ГАМК) - медиаторной передачи в высших отделах ЦНС. Пропофол уменьшает мозговой кровоток, потребление кислорода головным мозгом, одновременно повышает мозговое сосудистое сопротивление без воздействия на сосудисто-мозговую реактивность в ответ на изменения РаСО2. Влияние пропофола на метаболические потребности головного мозга и церебральный кровоток сходно с таковым тиопентала [44].
При оценке влияния пропофола на церебральный кровоток и метаболизм головного мозга было выявлено, что он может играть роль в уменьшении эмболизации сосудов ГМ вследствие уменьшения мозгового кровотока [133]. Однако вызываемое пропофолом «электрическое молчание» на электроэнцефалограмме (ЭЭГ) при операциях на открытом сердце не всегда уменьшает частоту и тяжесть неврологических и нейропсихологических расстройств [157].
Изофлюран при вдыхаемой концентрации от 2 до 3% (1,5-2,0 MAC) также вызывает «электрическое молчание» на ЭЭГ. В отличие от внутривенных анестетиков, супрессия ЭЭГ изофлюраном не сопровождается уменьшением церебрального кровотока, хотя потребление кислорода уменьшается значительно. Изофлюран, по сравнению с анестезией закисью азота и фентанилом, значительно уменьшает ишемически-индуцированный выброс глутамата в гип-покампе. Этот эффект анестетика сравним с эффектом поверхностной гипотермии [143].
Изучение блокаторов кальциевых каналов в кардиохирургии также представляет значительный интерес. Исследования нимодипина, L-изомера блокаторов кальциевых каналов, показали эффективность нейропротекции у больных с субарахноидальными кровоизлияниями [145], но не у больных с травмой головы. Из всех неиропротсктивных агентов, эффективных в эксперименте, только кальциевые блокаторы широко применяются в кардиохирургии. Внутриклеточное накопление кальция - один из основных факторов, ведущих к смерти клетки при церебральной ишемии. Блокаторы кальциевых каналов показали в эксперименте свою действенность в плане ограничения ишемического повреждения [25, 88]. Эти препараты также эффективны для лечения ишемического инсульта у людей [75]. У кардиохирургических пациентов, получавших нимодипин, в послеоперационном периоде отмечалось улучшение нейропсихологического статуса [66]. Однако малое количество пациентов не позволило сделать более определенных выводов о влиянии нимодипина на частоту неврологических осложнений.
Представляют большой практический и научный интерес результаты проспективного двойного слепого рандомизированного исследования, опубликованные в 1996 году [109]. Нейропротективная эффективность нимодипина исследовалась у 400 пациентов при реконструктивных операциях на клапанах сердца, но была прекращена после обследования 150 больных из-за большей смертности в группе с применением кальциевого блокатора. При окончании исследования в группе с применением нимодипина летальность составила 10,7%, а в контрольной группе - 1,3%. Кроме того, частота кровотечений в первой группе составила 13,3 и 4,1% в контрольной. При этом достоверных различий в частоте неврологических осложнений между группами выявлено не было. Авторы объясняют более высокую частоту осложнений и смертности при использовании нимодипина кровотечениями, возникшими из-за вазодилятирующе-го и антиагрегационного действия препарата. Принимая во внимание результаты проведенного исследования, в будущем будет сложно оправдать другое большое клиническое испытание блокаторов кальциевых каналов для защиты головного мозга в кардиохирургии.
Системный воспалительный ответ, возникающий при операциях в условиях искусственного кровообращения, сопровождается выбросом цитокинов в ответ на активацию коагуляции, фибринолиза и комплемента. Было показано, что бычий ингибитор протеаз - апротинин, значительно уменьшает интра- и послеоперационную кровопотерю и потребности в переливании препаратов крови. Несмотря на ранние исследования о повышении риска периопераци-онного инфаркта миокарда [51], было показано, что использование апротинина уменьшает частоту неврологических осложнений при операциях в условиях искусственного кровообращения [181] в связи с его противовоспалительными свойствами.
Указания на то, что продукция свободных радикалов, которая имеет место при ИК [92] и церебральной ишемии [48], дают возможность предположить нейропротективную роль ловушек свободных радикалов во время операций в условиях искусственного кровообращения [42].
В свете научных данных о роли возбуждающих нейромедиа-торов в патогенезе повреждения головного мозга при проведении ИК применение блокаторов NMDA-рецепторов весьма перспективно. Единственное место локализации NMDA-рецепторов - головной и спинной мозг, что позволяет избежать отрицательного воздействия специфических препаратов на сердечно-сосудистую систему. Экспериментальные исследования подтвердили эффективность превентивного назначения антагонистов NMDA-рецепторов во время проведения ИК и полной глубокой гипотермической остановки кровообращения [29, 164]. Было показано, что конкурентный антагонист глутаматных рецепторов, ремацемида гидрохлорид, улучшает нейропсихологическую функцию в проспективном, рандомизированном, двойном слепом исследовании пациентов после операции аортокоронарного шунтирования в условиях ИК [18]. По сравнению с контрольной группой, пациенты, получавшие ремацемид, показали лучшее выполнение трех из десяти нейропсихологических тестов. К неспецифическим блокаторам NMDA-рецепторов относятся кетамин и магний, которые широко используются в клинической практике.
Кортикостероиды известны в кардиохирургии более 40 лет, но, хотя подходы к их применению менялись несколько раз, механизм их действия до настоящего времени окончательно не определен. Это же касается и дозы вводимых гормонов. Первоначально стероиды назначались исходя из их гемодинамического эффекта - ва-зодилятации и увеличения емкости венозного русла при лечении синдрома низкого сердечного выброса после операций в условиях искусственного кровообращения. В конце 1960-х годов были представлены данные о мембрано-стабилизирующем эффекте на лизо-сомальные мембраны [151]. Было показано, что введение стероидов в начале искусственного кровообращения препятствует избыточной вазоконстрикции и улучшает перфузию тканей, что в конечном итоге уменьшает сроки пребывания больных в отделении интенсивной терапии после операции. Позднее было обнаружено, что применение стероидов потенцирует защиту миокарда за счет ингибирования фосфолипаз [61].
С развитием молекулярной биологии были описаны противовоспалительные эффекты стероидов. Стероидные гормоны уменьшают образование провоспалительных цитокинов, TNF-a, IL-1|3, IL-6 и 1L-8 [99, 191]. Кроме того, стероиды усиливают продукцию противовоспалительного цитокина 1L-10 [188]. Теоретически, уменьшение воспалительной реакции во время ИК при назначении стероидов должно улучшать течение послеоперационного периода, но на практике это не всегда подтверждается. Отрицательные эффекты назначения стероидов заключаются в выбросе эндотоксинов во время ИК; ухудшении толерантности к глюкозе; увеличении числа инфекционных осложнений; замедлении заживления ран и увеличении сроков искусственной вентиляции легких (ИВЛ) [80, 188].
Сведения о нейропротективном действии стероидов при проведении искусственного кровообращения немногочисленны и противоречивы. По экспериментальным данным одних авторов [177, 178], системное введение стероидов уменьшает проницаемость сосудов головного мозга и способствует церебропротекции, по данным других [169] - запускает процессы запрограмироваиной гибели нервных клеток после операций в условиях глубокой гипотермической остановки кровообращения. Ряд других фармакологических средств, способных ингибировать ишемическое повреждение, еще не прошел клинических исследований в кардиохирургии. Эти препараты включают аминостероиды [83] и вещества, действующие на образование оксида азота [192] и блокирующие адгезию лейкоцитов.
Исследования последних лет продемонстрировали, что воспалительные цитокины усугубляют ишемическое повреждение [20, 57]. В кровеносном русле ишемизированной ткани происходит агрегация лейкоцитов, которая ведет к эндотелиальной дисфункции и дальнейшему повреждению. Выявление рецепторов, ответственных за адгезию лейкоцитов к эндотелию, дало толчок к разработке специфичных моноклональных антител к этим рецепторам [76, 142]. Моноклинальные антитела к молекулам адгезии показали свою эффективность в экспериментальных работах по транзиторной фокальной ишемии [47, 127]. Кроме того, олигосахариды и олигопептиды, имеющие структурное сродство к связывающим рецепторам эндотелия, конкурентно ингибируют адгезию лейкоцитов [123]. Применение этих олигосахаридов может уменьшать реперфузионное повреждение сердца и легких [34] и блокировать адгезию лимфоцитов к эндотелию миокарда в эксперименте [195]. Таким образом, проведенные предварительные исследования указывают на то, что новые фармакологические агенты весьма эффективны в плане защиты головного мозга и в будущем могут быть использованы в кардиохирургии.
В конечном итоге, выживаемость нейронов головного мозга зависит от блокады или уменьшения интенсивности ишемических каскадов, запускаемых повышением внутриклеточного кальция и ведущих к гибели клеток. И, хотя в последние годы достигнуты большие успехи в понимании молекулярных механизмов ишемического повреждения головного мозга, многие важные проблемы остаются нерешенными. Как только будут выделены гены и их продукты, ответственные за ишемическую гибель нейронов, все силы исследователей будут направлены на разработку специфической терапии для предотвращения гибели и улучшения репарации нейронов. До этого времени будет необходимо применение терапевтического «коктейля» для воздействия на отдельные звенья патогенеза (активацию комплемента, воспаление, реперфузионное повреждение, вазоконстрикцию, свободные радикалы) ишемического повреждения нейрональной ткани.
Церебральный метаболизм при гипотермии
Согласно современным представлениям, защитный эффект гипотермии основан на увеличении толерантности всех органов и систем организма к кислородному голоданию, которое возникает при выключении кровообращения. Фундаментальный эффект гипотермии заключается в прогрессивном снижении движения молекул [150]. Это связано с действием холода на скорость метаболических процессов, подчиняющихся закону Ван-Гоффа-Аррениуса, которая определяется активностью многих ферментных систем. Взаимосвязь между активностью ферментов при температуре t] и их активностью при температуре t2 описана уравнением Ван-Гоффа (van't Hoff): где Q - это коэффициент Вант-Гоффа, рассчитываемый на каждые 10 °С изменения температуры, а &, и к2 - скорости реакций при абсолютных температурах tl и t2 [183]. Таким образом, если фермент имеет Ql0, равный 2, то его скорость реакции будет уменьшаться наполовину на каждые 10 °С снижения температуры. У взрослого человека Q приблизительно равен 2,2 [136], а у детей он составляет 3,7. Поэтому защитный эффект гипотермии, при одинаковой температуре, у детей намного сильнее, чем у взрослых. Более выраженное снижение метаболизма у молодых пациентов может быть связано с особой чувствительностью незрелых нейронов и глиальных элементов к гипотермии или может отражать более низкую массу мозга и эффективное охлаждение.
В то время как церебральный кровоток уменьшается в линейной зависимости от температуры головного мозга, его метаболизм уменьшается экспоненциально [78, 119]. В соответствии с изложенными выше обстоятельствами гипотермия оказывается ключевой стратегией, применяемой для уменьшения ишемического повреждения органов и тканей. Протективное действие гипотермии на мозг от ишемического повреждения характеризуется рядом механизмов, включающих сохранение запасов высокоэнергетических фосфатов, предотвращение выброса возбуждающих нейротранс-миттером, ограничение проницаемости мембран и предотвращение входа кальция в клетку. При гипотермии значительно уменьшается мозговой кровоток, потребность мозга в кислороде, макроэргических соединениях, менее выражена интоксикация мозга продуктами промежуточного обмена, свободными радикалами [22, 94, 98, 105, 106, 107, 202], снижается синтез белков [4] и замедляются процессы его распада [9].
Основную особенность клеток головного мозга составляет сочетание высокого уровня метаболической активности и низкого запаса кислорода, небольшого резерва высокоэнергетических фосфатов и карбогидратов [14, 168]. Ряд авторов исследовал защитное действие гипотермии путем измерения запасов высоко энергетических фосфатов с помощью ЯМР с фосфором [136]. Было показано, что, в то время как запасы АТФ быстро истощались при нормотермии, уровень АТФ при глубокой гипотермии был постоянным (15-20 °С). При гипотермии уровень активности Na-K-АТФ-азы и Са-АТФ-азы значительно замедлены. Сокращена утилизация АТФ и фосфокреатина, сохранен ионный гомеостаз.
Уровень АТФ, при котором происходит потеря ионного гомеостаза, до настоящего времени еще не определен. Выявлено, что в результате 25-минутной глубокой гипотермической остановки кровообращения значительно снижается содержание креатинфосфата, в то время как запасы АТФ в изолированном перфузируемом мозге крыс сохранены [136].
Защитное действие гипотермии связано с ее влиянием на ферментативные системы клетки. В эксперименте было показано [49], что при нормотермической ишемии мозга в течение 5 мин активность кальцийзависимой протеинкиназы уменьшалась на 39% и сохранялась таковой в течение 2 ч после ишемии, тогда как понижение температуры до 32 °С не вызывало изменения активности этого фермента.
Другой важный внутриклеточный фермент - протеинкиназа С, участвующий в выбросе нейротрансмиттеров и экспрессии генов. При 20-минутной нормотермической ишемии отмечалось выраженное ингибирование этого фермента, а при понижении температуры до 27 °С активность протеинкиназы С не снижалась [41]. По мнению авторов, это существенный фактор гипотермической толерантности организма к гипоксии, поскольку неконтролируемая активация протеинкиназы С является пусковым фактором гибели клетки.
Выраженный нейропротективный эффект гипотермии мозга связан с тем, что понижение температуры (например, до 28,0 °С) увеличивает латентный период формирования аноксической деполяризации в среднем до 207,4 с (при нормотермии аноксическая деполяризация нейронов развивается в среднем через 55 с) (рис. 2) и уменьшает в связи с этим экситоксическое действие возбуждающих нейромедиаторов [10]. Таким образом, при гипотермии нейроны головного мозга переходят в состояние относительного покоя. Возбуждающие нейромедиаторы могут быть ответственными за ишемическое повреждение мозга [124]. Установлено, что глутамат индуцирует селективное повреждение нейронов гиппокампа [163]. Гипотермия в сочетании с анестетиками значительно уменьшает выделение глутамата при аноксии, что снижает экситоксическое действие этого возбуждающего нейромедиатора [30, 59, 93, 139, 184]. Из всего изложенного следует, что гипотермия повышает
о |
250 -| 200 ■ |
|
207 |
|
ГС "; |
150 ■ |
|
/^ |
|
Врег |
100 ■ |
55 ^S |
|
|
|
50 ■ |
|
|
|
|
0 ■ |
|
|
|
37,5 28,0
Температура, °С
Рис. 2. Зависимость времени наступления аноксической деполяризации нейронов от температуры [10].
адаптационные возможности нервной ткани к энергетическому голоданию [6, 119].
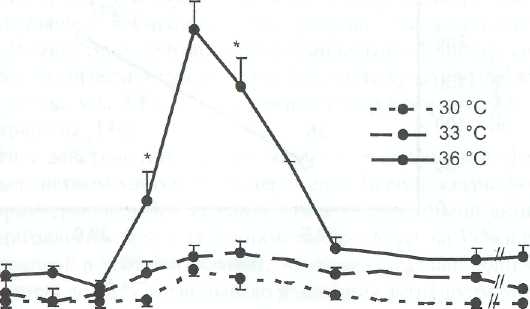
Последними исследованиями было показано, что для получения отчетливого защитного эффекта гипотермии температуру в головном мозге можно уменьшить лишь на 2-3 °С, т. е. до 33-34 °С, что, однако, не согласуется с общепризнанной точкой зрения о степени снижения интенсивности общего метаболизма при понижении температуры (коэффициент Q]0). Оказывается, что при поверхностной гипотермии происходит выраженное снижение высвобождения возбуждающих нейротрансмиттеров (рис. 3). Когда температура снижается с 36 до 33 °С, ожидаемый подъем глутамата не регистрируется [39].
Минимальный уровень гипотермии (34 °С) предотвращает ишемическое повреждение нейронов в СА-1 слое гиппокампа по сравнению с иормотермией. Умеренная гипотермия в 27 °С не оказывала дополнительного защитного эффекта [23, 38]. Поверхностный уровень гипотермии может быть достаточным для предотвращения значительного выброса возбуждающих нейротрансмиттеров, но недостаточным для уменьшения метаболизма головного мозга, которое наблюдается при более глубоком уровне гипотермии.
40 ■
30 ■
20 ■
10 ■
10 20 30 40 50 60 70 80 90 100 110 170 f<r- Ишемия—»/
Время,мин
Рис. 3. Влияние температуры на высвобождение глутамата в головном мозге [39].
Применение только одной гипотермии обеспечивает достаточную защиту головного мозга в условиях глубокой гипотермической остановки кровообращения [78]. Другие факторы, включающие, в частности, препараты для анестезии, обеспечивают лишь небольшую часть церебропротекции при температуре 15-20 °С. Тогда как при умеренной гипотермии, анестезиологические агенты и другие церебропротективные препараты, такие как блокаторы кальциевых каналов, барбитураты и антагонисты NMDA-рецепторов приобретают определенное значение, так как церебральный метаболизм повышен. Если глубокая гипотермия используется в качестве единственного церебропротективного агента, то факторы, влияющие на мозговой кровоток, такие как РаСО2, будут способствовать равномерному охлаждению головного мозга, усиливая его защиту [100].
Гипотермия не только подавляет метаболизм клеток мозга, но и увеличивает внутриклеточный рН. Ацидоз, связанный с периодом остановки кровообращения и увеличением продукции лактата и пирувата [31, 134,154], вносит существенный вклад в повреждение клеток мозга. Поэтому гипотермия может благотворно воздействовать на мозг путем уменьшения степени внутриклеточного ацидоза [187].
Охлаждение само непосредственно вызывает переориентацию метаболических путей в организме [7, 8, 96]. В результате чего метаболизм глюкозы, которая служит основным источником энергии для головного мозга, во время гипотермии переключается на пентозо-фосфатный цикл. В процессе пентозо-фосфатного превращения глюкозы генерируется рибозо-5-фосфат [3]. Этот углевод и его производные используются для синтеза важных биологических молекул, а именно РНК, ДНК, АТФ, что способствует репарации генетического материала клеток во время гипоксии и предотвращает их гибель.
В условиях низких температур за счет изменения физико-химических характеристик увеличивается жесткость клеточных мембран по типу перехода из золя в гель [12]. Это связано с замещением полиненасыщенных жирных кислот в мембранах клеток на насыщенные жирные кислоты [13]. Функционально новое состояние мембран во время гипотермии объясняет тот факт, что клетка становится более устойчивой по отношению к гипоксии. Увеличение жесткости каркаса внутренней оболочки мембран митохондрий обусловливает уменьшение активности дыхательных ферментов. В связи с чем при охлаждении до 25 °С снижение потребления кислорода в мозге составляет 1/3 по сравнению с потреблением кислорода при температуре 37 °С [26, 162].
Гипотеза о том, что чем ниже уровень гипотермии, тем вы-раженнее ее защитный эффект, оказалась неверной. Фундаментальные исследования в области искусственной гипотермии позволили существенным образом пересмотреть существовавшие ранее положения [150]. Нормальный клеточный метаболизм зависит от активности Na-K-АТФ-азы, которая поддерживает градиент ионов калия и натрия в клетке [115]. При понижении температуры клетки ниже 15 °С происходит необратимое ингибирование Na-K-АТФ-азы, что способствует избыточному поступлению ионов натрия и воды в клетку [132]. Кроме того, глубокая гипотермия может изменять проницаемость биологических мембран из-за изменения физических свойств мембранных липидов [152], что также приводит к свободной диффузии ионов через клеточную мембрану.
В

А
|
|||||
|
at |
|
|
ИГ |
|
L |
1 |
i |
|
|
|
В |
|
|
|
|
|
и |
i |
|
|
||
1 |
4 |
■ |
НУ-1 |
■"№ |
|
2 |
|
|
|
|
|
|
и |
Ч |
|
|
|
■! |
|
|
|
|
|
|
1 |
f |
Чг |
|
|
i Их |
|
|
ri |
||
В

••W
A
II
Рис. 4. Структурно-фазовые нарушения клеточных мембран в процессе развития холодовой смерти теплокровного организма [13].
I. Фронтальная плоскость мембраны: А - доменная мозаичная структура жидкостных (светлые) и ригидных (затемненные) участков мембраны; Б - формирование жидкостных ячеек на этапе формирования ригидных кла стеров разной плотности; В - сжатие жидкостных участков мембраны, со держащих белковые частицы.
II. Поперечное (фронтальное) сечение мембраны: А - формирование жид костных ячеек и выталкивание в их зону белковых частиц из более ригидных участков мембраны; Б - необратимая агрегация белковых частиц и их вытал кивание из структуры мембраны (В).
По некоторым данным [116], при охлаждении клеток животных белковые частицы сначала перемещаются из ригидных кластеров мембраны в жидкостные, где по мере развития этого процесса они подвергаются латеральному сжатию, агрегации и в конечном счете выталкиваются из мембраны как инородные тела (рис. 4), что приводит к нарушению структурной целостности мембраны [108] и последующей секвестрации ионов и биомолекул [97]. Таким образом, значительное понижение температуры (менее 15 °С) может приводить к тем повреждениям, которые характерны для гипоксии, но все это естественно замедляется во много раз по сравнению с нормотермическими условиями.
