
- ••Основы кислородно- транспортной функции крови и кислотно- основного состояния
- •Фундамент реаниматолога
- •Критическое состояние – это крайняя степень любой, в том числе ятрогенной патологии, при
- •Системы гомеостаза, наиболее быстро и остро нарушающиеся у больных в критическом состоянии
- •КТФК
- •Анатомия и физиология внешнего дыхания
- •Главная функция
- •Система дыхания
- •Полость носа:
- •Практически важно помнить, что:
- •Гортань
- •• Гортань – сфинктер
- •Трахея
- •Трахея
- •Бронхиальное дерево
- •Доля,
- •Кондуктивная зона: бронхи
- •Практически важно помнить, что:
- •Дыхательная зона
- •Строение респираторной
- •Альвеолы
- •Дыхательная мембрана
- •Дыхательная мембрана
- •Управление вентиляцией
- •Центральные хеморецепторы
- •Периферические хеморецепторы
- •Центральная и периферическая регуляция дыхания
- •Кривые ответа CO2
- •Хроническая гипоксемия (годы)
- •Хроническая дыхательная недостаточность с гиперкапнией
- •Дыхательные объемы и емкости
- •Мышцы «спокойного» дыхания
- •Мышцы «форсированного» дыхания
- •Мышцы «форсированного» дыхания
- •Практически важно помнить, что:
- •Легочные емкости и объемы
- •Функциональная остаточная
- •Кислородный каскад организма
- •Кислородный каскад и газообмен на клеточном уровне
- •Причины нарушения кислородного баланса
- •Факторы, влияющие на поглощение кислорода легкими
- •Респираторный компонент
- •Вентиляция легких – аэрация альвеолярного пространства для обеспечения адекватного удаления СО2 и в
- •Градиенты давлений для обеспечения
- •Влияние альвеолярной вентиляции на поглощение кислорода легкими
- •Влияние альвеолярной вентиляции на поглощение кислорода легкими
- •Зависимость VD
- •Расчетная доля мертвого
- •Объем мертвого пространства
- •Легочный комплайенс
- •Альвеолярное поверхностное натяжение
- •Факторы, снижающие легочный
- •Определение легочно-торакального комплайнса (Clt)
- •Снижение Cl
- •Физические факторы, определяющие вентиляцию: резистивность
- •Сопротивление воздухоносных путей (resistant)
- •Определение сопротивления дыхательных путей (Raw)
- •Легочный газообмен
- •Газообмен в легочных капиллярах (O2 и CO2)
- •Роль диффузионных процессов в доставке кислорода тканям
- •Капиллярно-альвеолярная взаимосвязь
- •Пассивная диффузия О2 через альвеолярно- капиллярную мембрану
- •Легочные капилляры
- •Диффузия О2 и СО2
- •Диффузия О2 и СО2
- •Перенос кислорода из альвеолы в кровь зависит и от диффузии, и от перфузии
- •Вентиляционно-перфузионные соотношения
- •V/Q: норма и патология
- •Механизмы поддержания V/Q
- •V/Q: норма и патология
- •PaO2/ FiO2 при разных уровнях a-v DO2 и шунтрирования
- •Гипоксемия, вызванная шунтированием
- •Гипоксемия, вызванная шунтированием
- •Гипоксемия, вызванная шунтированием
- •Шунт
- •Важно помнить:
- •Гемический компонент
- •Транспорт O2 и СО2 кровью
- •Транспорт кислорода кровью
- •Эритроциты
- •Структура гемоглобина А ( 22 22)
- •Структура гемоглобина А
- •Присоединение и отдача О2 гемоглобином А
- •Кислород, связанный с гемоглобином
- •Насыщение кислородом артериальной
- •Кривая диссоциации оксигемоглобина
- •Факторы, влияющие на КДО
- •Дисгемоглобины
- •Содержание кислорода в артериальной крови (CaO2 ctO2)
- •Доставка кислорода тканям (DО2)
- •Классическая взаимосвязь между потреблением и доставкой О2 тканям
- •Доставка и потребление кислорода
- •Патофизиология обеспечения кислородом тканей
- •Газообмен в тканях
- •Диффузия кислорода в тканях
- •Факторы, влияющие на диффузию кислорода в тканях
- •Потребление кислорода (VО2)
- •Экстракция кислорода (О2 Ext)
- •Причины тканевой гипоксии
- •Повышенное потребление О2 при критических состояниях
- •Потребление кислорода (VO2) (ml/min)
- •Линейная зависимость между доставкой и потреблением кислорода при шоке
- •Кислород в смешанной венозной крови (SVО2)
- •Причины низкого уровня кислорода в смешанной венозной крови
- •Цикличность диагностического процесса при диагностике тканевой гипоксии
- •Лактат-ацидоз – результат перфузионного дефицита и маркер тканевой гипоксии
- •Оценка респираторного компонента (1)
- •Оценка респираторного компонента (1)
- •Быстрый ориентировочный расчет AaDO2
- •Напряжение О2 в артериальной крови и ДО2 при разных FiO2 и PB –
- •Оценка респираторного компонента (2)
- •Оценка гемического компонента
- •Оценка гемодинамического компонента
- •Алгоритм диагностики гипоксемии
- •Алгоритм диагностики гиперкапнии
- •Основные газовые индексы
- •Кислотно-основное состояние и его нарушения
- •Почки и лёгкие являются основными органами, которые поддерживают постоянную
- •Что такое «кислота»?
- •Теория Аррениуса (1887)
- •Теория Bronsted-Lowry (1923)
- •Теория Льюиса (1923)
- •Теория Усановича (1939)
- •Какая теория используется на практике?
- •Преимущества использования рН
- •Конечно, есть таблица конвертации
- •pN внутриклеточной жидкости меняется в зависимости от Т
- •Альфа-стат vs рН-стат
- •Альфа-стат vs рН-стат
- •Пример из кардио
- •Откуда берётся «кислота» в организме?
- •«Респираторная» кислота
- •Единственный источник СО2 – полный метаболизм углеводов и жиров
- •«Метаболические» (нелетучие) кислоты
- •Три линии обороны организма против нарушений КОС – (кислоты)!
- •Полузащитник
- •Защитник
- •Вратарь
- •Буферы
- •Эксперимент Свана и Питтса
- •Буферные системы
- •Буферные системы организма
- •Буферная система СО2-бикарбонат
- •Буферизация во вне- и внутриклеточном пространствах
- •Респираторная регуляция
- •Центральный контроль респираторного компонента КОС
- •Периферические хеморецепторы чувствительны к СО2, О2 и рН.
- •Уравнение Хендерсона-Хассельбаха
- •Бланк стандартного исследования КОС на аппарате ABL-835
- •Взятие пробы артериальной крови
- •Взятие пробы артериальной крови
- •Условия забора артериальной крови из лучевой артерии для исследования кислородного статуса
- •Anion gap – анионная разница (промежуток)
- •Характер метаболического ацидоза на основании АР
- •Редкости:
- •Интерпретация «разницы дельта». Важно: если результат выглядит странно – скорее всего он ошибочен!
- •И наконец! Расстройства КОС
- •Всё очень просто!
- •Интерпретация исследования КОС
- •Интерпретация исследования КОС
- •Респираторный ацидоз
- •Респираторный ацидоз
- •Центральная - депрессия дыхания
- •Нейромышечные расстройства↓VA
- •Патология лёгких или грудной клетки
- •Патология дыхательных путей ↓VA
- •↑FiCO2
- •На практике, практически все случаи респираторного ацидоза связаны со снижением альвеолярной вентиляции (VA)
- •Патофизиологические эффекты гиперкапнии
- •Метаболический ацидоз
- •Метаболический ацидоз
- •Классификация
- •Патофизиологические эффекты метаболического ацидоза
- •Сердечно-сосудистая система
- •Принципы компенсации метаболического ацидоза организмом (вспомните футбольную аналогию!)
- •Принципы коррекции метаболического ацидоза
- •Основные виды метаболического ацидоза
- •Лактаткт т--ацидозз – результатз т т перфузионногоз го дефицитата и маркерк
- •Прогностическая роль концентрации лактата в крови
- •Концентрация лактата в крови
- •Механизмы развития лактат-ацидоза
- •Лактат-ацидоз
- •Лактат-ацидоз типа В (реже)
- •Принципы лечения лактат-ацидоза
- •Кетоацидоз
- •ДКА - диагностика
- •ДКА - лечение
- •NaHCO3 при метаболическом ацидозе
- •Факторы,, влияющие на КДО
- •Расчёт дозы NaНСО3
- •Нежелательные эффекты NaНСО3
- •Что делать с «пузырьками»?
- •Респираторный алкалоз
- •Причины респираторного алкалоза
- •Клинические эффекты гипокапнии
- •Клинические проявления гипокапнии
- •Компенсация респираторного алкалоза
- •Оценка тяжести респираторного алкалоза
- •Метаболический алкалоз
- •Причины развития метаболического алкалоза
- •Факторы, поддерживающие метаболический алкалоз
- •Потеря HCl с желудочным соком (рвота, потери по зонду) и использование диуретиков (фуросемида
- •Классификация метаболического алкалоза по уровню Cl- в моче
- •Риск гипоксемии!
- •Коррекция метаболического алкалоза
- •И ещё раз вкратце...
- •Интерпретация КОС (для тех, кто выжил)
- •Шаг № 2. Оценка соответствующих изменений РаСО2 и НСО3-
- •Шаг № 3. Ищите другие «улики»
- •Шаг 4. Оценка компенсаторного ответа Для респираторных расстройств
- •Шаг № 4. Правило 2 – для хронического респираторного ацидоза («4 за 10»)
- •Шаг № 4. Правило 3 для острого респираторного алкалоза («2 за 10»)
- •Шаг 4. Правило 4 для хронического респираторного алкалоза («5 за 10»)
- •Шаг 4 для метаболических расстройств Правило 5 для метаболического ацидоза
- •Шаг 5. Диагноз нарушения КОС
- •Вопросы?

Теория Аррениуса (1887)
•Кислота – в-во, диссоциирующее в водном р-ре до Н+
•Основание – до ОНˉ
•Нейтральность – [Н+] = [ОНˉ]
•Ограничения:
- некоторые в-ва, обладающие св-вами кислот, не
содержат Н+, а оснований – ОНˉ - рассматривает только водные растворы

Теория Bronsted-Lowry (1923)
•Наиболее распространённая в современной медицине
•Кислота – донор [Н+]
•Основание – акцептор [Н+]
•У каждого донора [Н+] есть соответствующий ему акцептор – конъюгированная пара
•Сильная кислота с лёгкостью отдаёт [Н+] молекуле воды → ↑[Н3О+]
•Нет понятия «электронейтральности»

Теория Льюиса (1923)
•Стимулом послужило наличие в-в (н-р, СО2), проявляющие св-ва кислот в р-рах, но не имеющие в составе [Н+]
•Кислота – потенциальный акцептор электронной пары
•Основание – потенциальный донор электронной пары
•Согласно Льюису, [Н+] сам по себе является кислотой

Теория Усановича (1939)
•«С мира по нитке»
•Кислота – в-во, являющееся донором катиона, или акцептором аниона или электрона
•Основание – в-во, являющееся донором аниона, или акцептором катиона

Какая теория используется на практике?
•Проще других – Bronsted-Lowry. Использовать Н2СО3 вместо СО2
•На практике большинство из нас понимают кислоту, как:
-[Н+] в растворе (Аррениус)
-донор [Н+] (Bronsted-Lowry)
-и даже СО2, как «кислоту» (Льюис)

pH = - log10[Н+]
• Для Н2О при 22°С:
[Н+] = [ОН-] = 1×10-7 моль/л
•рН (Н2О) = - log (1× 10-7) = - (-7.0)= 7.00
•Поскольку основание log = 10 (log10), именения рН на 1 ед. соответствуют изменению [Н+] в 10 раз (в обратную сторону):
Р-р с рН 3 содержит [Н+] в 10 раз больше, чем р-р с рН 4
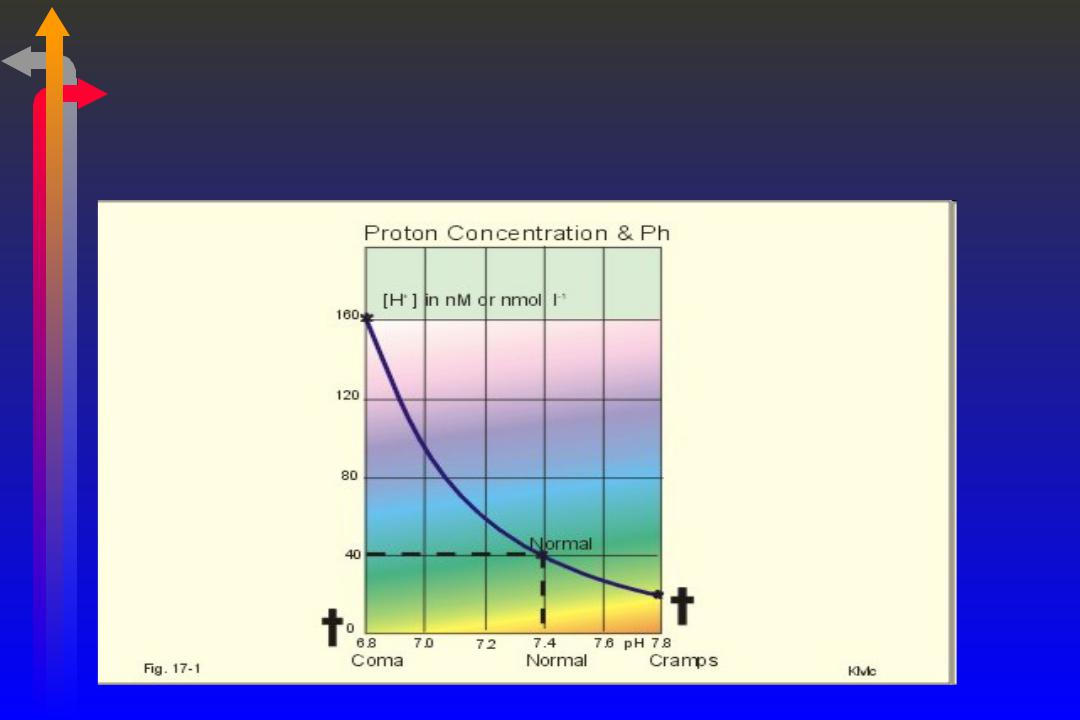
Соотношение [Н+] (у) и рН (х) нелинейно!

Преимущества использования рН
•Традиционный, широкоупотребляемый символ
•Отражает активность Н+, а не концентрацию (см. устройство рН-электрода далее) – реальное св-во физиологических систем
•Н+ не присутствуют в р-рах в чистом виде

Простой способ конвертации между рН и [Н+]
•рН – 7.4 = [Н+] – 40 нмоль/л
•Увеличение/уменьшение [Н+] в 2 раза приводит к изменениям рН на 0.3 в другую сторону. (log 2 = 0.3)
•Например, если [Н+] – 80 нмоль/л → рН = 7.1

Конечно, есть таблица конвертации
рН |
[Н+] нмоль/л |
6.8 |
158 |
6.9 |
125 |
7.0 |
100 |
7.1 |
79 |
7.2 |
63 |
7.3 |
50 |
7.4 |
40 |
7.5 |
31 |
7.6 |
25 |
7.7 |
20 |
