
- •Физика молекулярная физика. Термодинамика сборник задач
- •Введение
- •Количественное распределение задач по параграфам и по уровню сложности
- •01. Молекулярное строение вещества. Законы идеальных газов формулы
- •01.01. Молекулярное строение вещества
- •01.02. Уравнение газового состояния
- •01.03. Смеси газов
- •02. Молекулярно-кинетическая теория газов формулы.
- •02.01. Концентрация молекул
- •02.02. Основное уравнение кинетической теории газов. Энергия молекул
- •02.03. Скорости молекул
- •03. Элементы статистической физики формулы
- •03.01. Распределение Больцмана
- •03.02. Распределение молекул по скоростям и импульсам
- •03.03. Распределение молекул по кинетическим энергиям поступательного движения
- •03.04. Длина свободного пробега и число столкновений молекул
- •03.05. Явления переноса: диффузия, вязкость, теплопроводность
- •04. Физические основы термодинамики формулы
- •04.01. Вычисление количества теплоты
- •04.02. Уравнение теплового баланса
- •04.03. Теплоемкость идеального газа
- •04.04. Работа расширения газа
- •04.05. Первое начало термодинамики
- •04.07. Энтропия
- •05. Реальные газы. Жидкости формулы
- •05.01. Уравнение Ван-дер-Ваальса
- •05.02. Критическое состояние
- •05.03. Внутренняя энергия
- •05.04. Поверхностное натяжение. Капиллярные явления
- •05.05. Гидродинамика
01. Молекулярное строение вещества. Законы идеальных газов формулы
Количество вещества ν тела (системы) (число структурных элементов (молекул, атомов, ионов и т. п.), содержащихся в системе или теле. Количество вещества выражается в моль. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг):
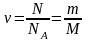 ,
,
здесь N – количество частиц (молекул, атомов, ионов и т. п.), составляющих тело (систему), NA = 6,022∙1023 моль–1 – постоянная Авогадро, m – масса вещества, M – молярная масса (масса одного моля вещества);
Относительная молекулярная масса вещества:
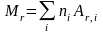 ,
,
здесь ni – число атомов i-го химического элемента, входящего в состав молекулы данного вещества; AR,i – относительная атомная масса этого элемента. Относительные атомные, массы приводятся в таблице Д. И. Менделеева.
Связь молярной массы M с относительной молекулярной массой MR вещества:
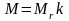 ,
,
здесь k = 10–3 кг/моль.
Молярная масса смеси газов:
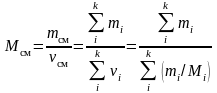 ,
,
здесь νi, mi, Mi – соответственно количество вещества, масса и молярная масса i-го компонента смеси; k – число компонентов смеси.
Уравнение состояния идеального газа (уравнение Клапейрона–Менделеева):
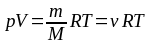 ,
,
здесь p – давление газа, V – объем, занимаемый газом, m – масса газа, M – его молярная масс, R = NA∙k = 8,31 Дж∙моль–1∙К–1 – универсальная газовая постоянная (молярная газовая постоянная), k = 1,38∙10–23 Дж∙К–1 – постоянная Больцмана, T – термодинамическая (абсолютная) температура, ν – количество вещества.
Изопроцессы:
Изотермический процесс: T = const, p1V1 = p2V2;
Изобарический процесс: p = const, V1T2 = V2T1;
Изохорический процесс: V = const, p1T2 = p2T1.
Плотность идеального газа:
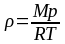 ;
;
Массовая доля компонента смеси газов
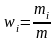 ,
,
здесь mi – масса i-го компонента смеси, m – масса смеси.
Закон Дальтона:
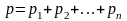 :
:
здесь p – давление смеси газов, pi – парциальное давление i-го компонента смеси;
Масса одной молекулы или одного атома:
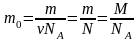 ;
;
ЗАДАЧИ
01.01. Молекулярное строение вещества
Уровень 1.
1. Какое количество вещества содержится в теле, состоящем из 1,204·1024 молекул? Число Авогадро 6,02·1023 моль-1. [2]
2. Какую массу (в г) имеют 3·1023 молекул азота? Молярная масса азота 28 кг/кмоль. Число Авогадро 6·1023 моль-1. [14]
3. Какова масса (в г) 50 молей кислорода? Молярная масса кислорода 32 кг/кмоль. [1600]
4. Определить относительную молекулярную массу Mr: 1) воды; 2) углекислого газа CO2, 3) поваренной соли NaCl. Относительная атомная масса водорода – 1 г/моль, кислорода – 16 г/моль, углерода – 12 г/моль, натрия – 23 г/моль, хлора – 35 г/моль.
1) [18] 2) [44] 3) [58]
5. Найти молярную массу M серной кислоты H2SO4. Полученный ответ умножьте на 1000 (запишите ответ в г/моль). Относительная атомная масса водорода – 1 г/моль, кислорода – 16 г/моль, серы – 32 г/моль. [98]
6. Определить массу m1 молекулы: 1) углекислого газа; 2) поваренной соли. NА = 6,022·1023. Относительная атомная масса кислорода – 16 г/моль, углерода – 12 г/моль, натрия – 23 г/моль, хлора – 35 г/моль. Полученный ответ умножьте на 1028 и округлите до целого значения.
1) [731] [730] 2) [963] [964]
7. Определить количество вещества ν азота массой m = 2 кг. Молярная масса азота M = 0,028 кг/моль. Полученный ответ округлите до целого значения. [71] [72]
8. В баллоне вместимостью V = 3 л находится кислород массой m = 4 г. Определить количество вещества ν молекул газа. Молярная масса кислорода M = 0,032 кг/моль. Полученный ответ умножьте на 1000. [125]
9. Кислород при нормальных условиях (p = 105, T = 273 К) заполняет сосуд вместимостью V = 1,12 л. R = 8,31 Дж/(моль·К). Определить количество вещества ν газа. Полученный ответ умножьте на 1000 и округлите до целого значения. [49] [50]
10. Кислород при нормальных условиях (p = 105, T = 273 К) заполняет сосуд вместимостью V = 112 л. R = 8,31 Дж/(моль·К). Определить массу m газа. Молярная масса кислорода M = 0,032 кг/моль. Полученный ответ умножьте на 1000 и округлите до целого значения. [158] [157]
11. Сколько атомов содержится в газах массой 1 г каждый: 1) гелии; 2) углероде; 3) фторе; 4) полонии? NА = 6,022·1023. Относительная атомная масса гелия – 4 г/моль, углерода – 12 г/моль, фтора – 19 г/моль, полония –209 г/моль. Полученный ответ умножьте на 10-20 и округлите до целого значения.
1) [1506] [1505] 2) [502] [501] 3) [317] [316] 4) [29] [28]
12. В сосуде вместимостью V = 5 л находится однородный газ количеством вещества ν = 0,2 моль. Определите молярную массу этого газа (в г/моль), если его плотность ρ = 1,12 кг/м3. [28]
Уровень 2.
1. Во сколько раз в 3 г водорода больше молекул, чем в 9 г воды? Молярная масса водорода 2 кг/кмоль, воды 18 кг/кмоль. [3]
2. Считая, что атмосферный воздух состоит только из кислорода и азота и что молярная масса воздуха 29,12 кг/кмоль, определите процентное содержание молекул кислорода в смеси. Молярная масса кислорода 32 кг/кмоль, азота – 28 кг/кмоль. [28]
3. В сосуде вместимостью V = 1,6 л находится кислород, количество вещества ν которого равно 0,2 моль. Молярная масса кислорода M = 0,032 кг/моль. Определить плотность ρ газа. [4]
4. Определить число N молекул азота массой m = 0,2 кг. Молярная масса азота M = 0,028 кг/моль. NА = 6,022·1023. Полученный ответ умножьте на 10-23 и округлите до целого значения. [43] [44]
5. В баллоне вместимостью V = 3 л находится кислород массой m = 4 г. Определить число N молекул газа. Молярная масса кислорода M = 0,032 кг/моль. NА = 6,022·1023. Полученный ответ умножьте на 10-20 и округлите до целого значения. [753] [752]
6. Определить количество вещества ν водорода, заполняющего сосуд вместимостью V = 3 л, если плотность газа ρ = 6,65∙10–3 кг/моль. Полученный ответ умножьте на 1000 и округлите до целого значения. [10] [9]
7. Колба вместимостью V = 0,5 л содержит газ при нормальных условиях (p = 105, T = 273 К). Определить число N молекул газа, находящихся в колбе. NА = 6,022·1023. R = 8,31 Дж/(моль·К). Полученный ответ умножьте на 10-21 и округлите до целого значения. [13] [14]
Уровень 3.
1. Одна треть молекул азота массой m = 10 г распалась на атомы. Определить полное число N частиц, находящихся в газе. Молярная масса азота M = 0,028 кг/моль. NА = 6,022·1023. Полученный ответ умножьте на 10-21 и округлите до целого значения. [287] [286]
2. Рассматривая молекулы жидкости как шарики, соприкасающиеся друг с другом, оценить порядок размера диаметра молекулы сероуглерода CS2. Плотность сероуглерода ρ = 1260 кг/м3. Молярная масса сероуглерода M = 0,076 кг/моль. NА = 6,022·1023. π = 3,14. Полученный ответ умножьте на 1012 и округлите до целого значения. [464] [465]/[576] [577]
3. Рассматривая молекулы жидкости как шарики, соприкасающиеся друг с другом, оценить порядок размера диаметра молекулы ртути. Плотность ртути ρ = 13600 кг/м3. Молярная масса ртути M = 0,200 кг/моль. NА = 6,022·1023. π = 3,14. Полученный ответ умножьте на 1012 и округлите до целого значения. [290] [291]/[360] [361]
