
738
.pdf
Международной системы единиц (СИ). В табл.1 Приложения приведены основные и производные единицы величин, используемые в теплотехнике.
1.1.2. Термодинамические параметры
К термодинамическим параметрам состояния относят т е м п е р а т у- р у, д а в л е н и е, у д е л ь н ы й о б ъ е м и п л о т н о с т ь.
Температура
Понятие температуры является одним из важнейших в теплотехнике. С молекулярно-кинетической точки зрения температура характеризует интенсивность движения структурных частиц системы. Более строгое определение температуры как физической величины дается при рассмотрении второго закона термодинамики.
Температура – это термодинамический параметр, определяющий тепловое состояние системы. Численное значение температуры является мерой отклонения состояния данного тела от теплового равновесия с другим телом, состояние которого принято за начало отсчета.
Температура системы измеряется с помощью различных по принципу действия термометрических устройств. При этом на шкалах этих устройств регистрируется не интенсивность теплового движения микрочастиц, а изменение физического свойства чувствительного элемента, находящегося в тепловом соприкосновении с системой, например, изменение объема жидкости или газа при нагревании; зависимость электрического сопротивления металла от температуры и др. Шкала таких устройств имеет температурную градуировку. Градуировка производится путем деления разности показаний устройства в двух произвольно выбранных постоянных температурных точках на некоторое число равных частей, называемых г р а д у с а м и. Так как выбор постоянных температурных точек произволен, то существует несколько температурных шкал. Для численного определения температуры в единицах СИ установлено две температурные шкалы: т е р м о д и н а м и ч е с= к а я и Международная п р а к т и ч е с к а я (МПТШ) с одинаковой ценой деления шкалы – градусом.
В термодинамической температурной шкале за начало отсчета принимается наинизшая температура, при которой возможно полное прекращение теплового движения микрочастиц. Эта точка отсчета называется а б с о -
л ю т н ы м |
н у л е м температуры. Термодинамическая температура обо- |
значается Т, |
за единицу температуры принят кельвин (К). |
По МПТШ за нуль отсчета принимается температура тройной точки воды; за 100 делений шкалы – температура точки кипения воды. Эта градуировка соответствует температурной шкале, предложенной в 1742 г. шведским физиком А. Цельсием, по которой температура обозначается t и за единицу принимается градус Цельсия (оС).
11
Эталлон градуса основывается на одиннадцати реперных точках с фиксированными значениями температуры. Это температуры фазовых равновесий между жидкостью и паром или жидкостью и твердой фазой чистых веществ при нормальном атмосферном давлении. Ниже приведены температуры ряда реперных точек:
точка кипения водорода |
– 252,87 0С; |
|
точка кипения кислорода |
– 182,96 |
0С; |
тройная точка воды |
+ 0,01 0С; |
|
точка кипения воды |
+100,00 0С; |
|
точка затвердевания цинка |
+419,58 |
0С; |
точка затвердевания золота |
+1064,43 |
0С. |
Связь между температурами по установленным шкалам имеет вид: |
||
T = t + 273, 15 |
(1.1) |
|
В некоторых странах находят применение и другие шкалы: температурная шкала, выраженная в градусах Фаренгейта (0F) и температурная шкала, выраженную в градусах Ренкина (0R). Соотношения между значениями температуры, выраженными в градусах Цельсия (t, 0C), в кельвинах (Т, К), в
градусах Фаренгейта (tF, 0F) и в градусах Ренкина (TR, |
0R), таковы: |
|
t = T – 273, 15 = (tF – 32)/1, 8 = (TR / 1, 8) – 273, 15. |
(1.2) |
|
|
Давление |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Давление – физическая величина, |
характеризующая |
интенсивнсть |
|||||||||||
|
нормальных сил, с которыми одно тело действует на поверхность дру- |
|||||||||||||
|
гого. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В газах и жидкостях давление создается в |
результате воздействия |
||||||||||||
структурных частиц на контрольную поверхность системы. Величина давле- |
||||||||||||||
ния оценивается силой, приходящейся на единицу поверхности, при усло- |
||||||||||||||
вии, |
что сила |
равномерно распределена по поверхности и направлена по |
||||||||||||
нормали к ней. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Давление обозначается p, за его единицу в СИ принят паскаль (Па). |
|||||||||||||
Паскаль равен давлению, вызываемому силой 1Н, |
действующей на поверх - |
|||||||||||||
|
|
|
С** |
|
|
ность 1 м2 . |
Величина силы в |
|||||||
|
|
|
С |
|
* |
|
1Н = 1 кг · 1 м/с |
2 |
= 1(кг· м)/с |
2 |
. |
|||
|
pизб |
|
С |
|
|
|
|
|||||||
|
|
|
|
|
|
Давление |
в системе, |
отсчитывае- |
||||||
|
pизб |
|
|
|
|
|
||||||||
|
pизб |
|
|
|
|
мое от нулевого значения, называ- |
||||||||
p**абс |
|
|
|
|
|
|||||||||
|
|
|
|
|
ется а б с о л ю т н ы м и обозна- |
|||||||||
p |
абс* |
|
|
|
|
|
||||||||
p абс |
pраз |
|
|
|
чается pабс. Абсолютное атмосфер- |
|||||||||
|
|
|
pраз |
|
** |
|||||||||
|
|
|
pраз |
|
|
|
|
|
|
|
|
|
||
|
|
|
С |
** |
|
|
|
|
|
|
|
|
||
|
pбар |
|
|
С |
** |
ное давление, именуют б а р о м е т |
||||||||
|
pбар |
|
|
|
С |
р и ч е с к и м |
(pбар.). |
Давление в |
||||||
|
pбар |
|
|
|
|
|||||||||
|
|
** |
|
|
|
системе, |
превышающее атмосфер- |
|||||||
|
|
p |
**абс |
|
|
|
ное (барометрическое), |
называют |
||||||
|
|
p |
**абс |
|
|
|
||||||||
|
|
|
p абс |
|
|
|
и з б ы т о ч н ы м (ризб), а |
|
недо- |
|||||
|
|
|
|
|
|
|
|
|||||||
|
|
Рис. 1.1 |
|
|
|
стающее до атмосферного – р а з р |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
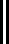
я ж е н и е м (рраз). |
На рис. 1.1 |
наглядно |
представлена |
связь |
ука- |
|
занных давлений |
* |
где |
* |
|
** |
где |
в системе С , |
р абс.> рбар., и в системе С , |
|||||
р**абс.< рбар. Отсюда |
р*абс = ризб + рбар |
|
р**абс = рбар – рраз . |
|
|
|
|
и |
|
|
|||
Иногда используются внесистемные единицы давления: бар; мм рт.ст.; мм вод. ст.; техническая атмосфера (ат); физическая атмосфера (атм ). Численные соотношения между единицами давления приведены в табл.2 Приложения. Ниже внесистемные единицы выражены через паскаль.
1 бар = 1 105 Па = 1 105 Н/м2; |
1 мм рт.ст. = 133,3 Па; |
1 мм вод. ст. = 9,81 Па; |
1 бар = 750 мм рт.ст.; |
1ат = 1 кг/см2 = 735,6 мм рт.ст. = 0,981 105 Па; 1атм = 1,033 кг/см2 = 760 мм рт.ст. = 1,013 105 Па.
Удельный объем
Удельный объем – физическая величина, равная отношению объема системы к ее массе:
v =V/m,
где v – удельный объем, м3 /кг; m – масса, кг.
|
Плотность |
|
|
|
Плотность – физическая величина, равная отношению массы системы |
|
|
к ее объему: |
|
|
= m/V, |
где |
– плотность, кг/м3. |
|
. |
Очевидно, что плотность системы – величина, обратная ее удельному |
|
объему.
Массу системы и ее объем, как правило, не относят к параметрам состояния, но определенные с их помощью v и ρ являются термодинамическими параметрами.
1.1.3. Состояние термодинамической системы
Состояние термодинамической системы описывается совокупностью термодинамических и калорических параметров, по которым можно отличить данную систему от других, а также проследить за изменениями, возникающими в системе при ее взаимодействии с окружающей средой.
Если термодинамическая система закрытая и энергоизолированная, то с течением времени внутри системы между различными ее частями прекращается обмен энергией и веществом, одноименные параметры во всех точках системы принимают одинаковое значение. Такое состояние системы называется р а в н о в е с н ы м. При невыполнении указанных условий состояние системы является н е р а в н о в е с н ы м.
13

Понятие равновесного состояния играет в термодинамике чрезвычайно важную роль: только равновесные состояния термодинамических систем и их изменения могут быть количественно описаны методами термодинамики.
Для задания состояния термодинамической системы иногда используют так называемые “н о р м а л ь н ы е ф и з и ч е с к и е у с л о в и я” (НФУ) или “н о р м а л ьн ы е т е х н и ч е с к и е у с л о в и я” (НТУ).
При нормальных физических (атмосферных) условиях значения температуры и давления равны соответственно t = 0 оС, р = 760 мм рт.ст.
При нормальных технических условиях t = 15 оС и р =735,6 мм рт.ст. Как отдельные, так все параметры системы могут изменяться. Всякое изменения, происходящее в системе и связанное с изменением хотя бы одного из ее параметров состояния, называется т е р м о д и н а м и ч е с к и м
п р о ц е с с о м.
Процесс изменения состояния системы, который может происходить в случае какого-либо взаимодействия с окружающей средой, представляет собой отклонение от состояния равновесия. Если процесс изменения состояния системы протекает так медленно, что в системе в каждый момент времени успевает установиться практически равновесное состояние, то его можно назвать к в а з и р а в н о в е с н ы м п р о ц е с с о м. Степень приближения квазиравновесного процесса к чисто равновесному будет тем больше, чем медленнее изменяется состояние системы.
Равновесные процессы изменения состояния характеризуются определенными зависимостями термодинамических параметров и поэтому допускают графическое изображение.
Среди различных термодинамических процессов особый интерес представляют так называемые “з а м к н у т ы е” (или к р у г о в ы е) процессы, при которых система, пройдя через ряд последовательных состояний, возвращается в начальное состояние.
1.1.4. Энергия термодинамической системы
Энергия
Понятие энергии неразрывно связано с материей. Все, что нас окружает, что воспринимается человеком и существует независимо от него, это материя. Необходимым условием существования материи является движение. И если масса служит количественной характеристикой материи, то энергия является физической мерой ее движения.
Э н е р г и я – это общая количественная мера движения и взаимодействия всех видов материи.
Исторически же сложилось так, что энергию стали классифицировать по формам движения. Механической форме движения соответствует кинетическая энергия; соединению и разложению молекул – химическая энергия; перемещению электронов в проводниках – электрическая энергия и т.д. Та-
14
кое разделение энергии на виды удобно для исследования и анализа явлений природы.
Всякая термодинамическая система обладает определенной энергией, которая, независимо от конкретных форм проявления, обозначается Е. За единицу энергии в СИ принят д ж о у л ь (Дж) – производная единица, определяемая через основные величины. Джоуль – это энергия, затраченная системой при перемещении точки приложения силы 1 Н на расстояние 1 м в направлении действия силы, т.е. 1 Дж = 1 Н ٠ 1 м .
Вычислить абсолютное значение энергии термодинамической системы невозможно, нет нуля отсчета энергии. Такое положение не играет существенной роли для практики, потому что при исследовании энергообмена важна не абсолютная величина энергии, а ее изменение. Для отдельных же форм энергии с целью количественной оценки их изменений в процессах устанавливается условное “начало отсчета”.
В общем случае энергия термодинамической системы Е включает в себя кинетическую энергию механического движения тела или тел внутри нее Ек, потенциальную энергию системы во внешнем поле (гравитацион-
ном, электромагнитном, сил давления) Еп и |
в н у т р е н н ю ю |
энергию |
(связанную с энергией микрочастиц тел, входящих в систему) Ев: |
|
|
Е = Ек + Еп + Ев |
. |
(1.3) |
В технической термодинамике, как |
правило, рассматривают непо- |
|
движную в окружающей среде термодинамическую систему, форма и размеры которой могут изменяться. Однако может иметь место и перемещение тел или тела внутри системы со скоростью с. В большинстве случаев гравитационной и электромагнитной составляющими потенциальной энергии пренебрегают. Существенной в таких системах будет потенциальная энергия в поле сил давления, которая выражается через объем и давление:
|
Еп = pV. |
(1.4) |
Величина |
pV представляет собой энергию, которую нужно было затратить |
|
для того, |
чтобы ввести тело объемом V во внешнюю среду, имеющую по- |
|
всюду одинаковое давление p. |
|
|
Внутреннюю энергию Ев в технической термодинамике обозначают U. Таким образом, энергия системы, рассматриваемой технической тер-
модинамикой, равна кинетической энергии, потенциальной энергии в поле сил давления и внутренней энергии:
Е = m |
с2 |
+ pV + U . |
(1.5) |
|
2 |
||||
|
|
|
Внутренняя энергия
Понятие внутренней энергии системы связано с микроскопическим строением последней. Это значит, что систему нужно рассматривать как совокупность большого числа структурных частиц (молекул, атомов, ионов и т.д.). Внутренняя энергия включает в себя энергию хаотичного (теплового) движения всех микрочастиц системы, энергию взаимодействия этих частиц,
15

энергию электронных оболочек атомов. В термодинамической системе, состоящей из идеального газа, учитывается только тепловая энергия микрочастиц, включающая энергию поступательного, вращательного и колебательного движений.
Под внутренней энергией понимают калорический параметр, характеризующий совокупность энергии теплового движения микрочастиц системы.
За единицу внутренней энергии принят джоуль.
Особенностью внутренней энергии U является то, что она однозначно является функцией состояния термодинамической системы. Значение внутренней энергии в каком-либо произвольно выбранном процессе не зависит от того, каким образом система пришла в это состояние. Иначе говоря, изменение внутренней энергии ∆U1-2 при переходе системы из сотояния 1 в состояние 2 не зависит от пути перехода и равно ∆U1-2 = U2 – U1 .
В круговых процессах изменение внутренней энергии равно нулю.
Энтальпия
В уравнении энергии термодинамической системы (1.5) внутренняя энергия U и потенциальная энергия в поле сил давления pV характеризуют физическое состояние системы, допустимо их объединить и представить в виде некоторой функции состояния – э н т а л ь п и и. Название «энтальпия», которое было введено в термодинамику Д. Гиббсом, происходит от греческого слова “нагревать”.
|
|
Калорический параметр термодинамической системы, равный сумме |
|||
|
|
внутренней энергии и энергии в поле сил давления, называется эн- |
|||
|
|
тальпией. |
|
|
|
|
Энтальпия обозначается I. Согласно определению: |
|
|||
|
|
I = U + pV. |
|
(1.6) |
|
|
За единицу энтальпии принят джоуль. |
|
|
|
|
|
С учетом выражения (1.6) уравнение энергии термодинамической си- |
||||
стемы запишется в виде: |
|
|
|
||
|
|
Е = I + m |
с2 |
. |
(1.7) |
|
|
2 |
|||
|
|
|
|
|
|
Если система неподвижна, то энтальпия равна полной энергии системы объемом V, находящейся под давлением р.
Энтальпия является одной из вспомогательных функций, использование которых значительно упрощает термодинамические расчеты. Она не может быть измерена непосредственно, а определяется, как и внутренняя энергия, только расчетным путем.
Внутренняя энергия и энтальпия характеризуются рядом общих свойств:
16
1)Внутренняя энергия и энтальпия как функции состояния являются неодинаковыми для разных систем и тел, входящих в систему, т.е. являются не универсальными, а индивидуальными параметрами для каждого вещества.
2)Абсолютные значения внутренней энергии и энтальпии определяют-
ся с точностью до постоянных U0 |
и |
I0, выбранных в качестве стандарт- |
ных. Так, в состоянии а абсолютные значения U и I запишутся следую- |
||
щим образом: |
|
|
Uа= Uа-0 + U0 |
и |
Ia = Ia-0 +I0 . |
В термодинамике, как правило, искомой величиной является изменение внутренней энергии и энтальпии, поэтому выбор стандартного состояния для определения ∆ U и ∆ I может быть произвольным.
3) Внутренняя энергия и энтальпия являются экстенсивными (аддитивными) величинами. Для системы, заданной несколькими телами, внутренняя энергия и энтальпия равны, соответственно, сумме внутренних энергий и энтальпий отдельных тел, т.е.
Uc = n |
U i и |
Ic = n |
Ii . |
i 1 |
|
i 1 |
|
Однако удельные значения внутренней энергии и энтальпии относятся к интенсивным параметрам. Удельные массовые значения внутренней энергии и энтальпии вычисляют с помощью соотношений:
u =U/m и i = I/m
и выражают в Дж/кг.
1.1.5. Теплота и работа – формы энергообмена
Обмен энергией между закрытой термодинамической системой и внешней средой или между телами внутри системы может осуществляться посредством двух качественно различных форм. Одна форма обмена энергией происходит без видимого перемещения тел и системы в целом, другая - сопровождается изменением ее размеров или расположения ее тел в пространстве.
Для процессов, изучаемых в технической термодинамике, первый способ передачи энергии может быть реализован только при хаотическом, ненаправленном движении микрочастиц внутри неравновесной системы или при обмене энергией термодинамической системы и окружающей среды, имеющих разные температуры. Такую форму называют т е п л о о б м е н о м. Для количественной оценки теплообмена введено понятие т е п л о т ы.
Теплота
Под теплотой понимают количество энергии, которой термодинамическая система обменивается с окружающей средой микроскопическим путем (теплообменом).
Обмен энергией в форме теплоты возможен и между телами внутри системы.
17
Теплота здесь понимается только как форма передачи энергии, и неверно говорить, что она выражает свойство системы, тем более содержится в системе. Можно говорить о теплоте, подведенной к системе или от нее отведенной, но нельзя говорить об увеличении или уменьшении теплоты в той или иной системе, т.е. не следует путать теплоту и внутреннюю тепловую энергию.
Теплоту обозначают Q. За единицу теплоты принят джоуль. В термодинамике подводимую теплоту принято считать положительной, отводимую – отрицательной.
Вторая форма передачи энергии связана с изменением объема системы
иперемещением ее в окружающей среде под воздействием различных силовых полей – гравитационного, упругостного, магнитного; поля сил давления
идр. Такая форма энергообмена, реализуемая макроскопическим путем,
называется р а б о т о й.
Работа
Под работой понимают количество энергии, которой термодинамическая система обменивается с окружающей средой в результате макроскопического, упорядоченного, направленного движения.
Работа обозначается L. За единицу работы принят джоуль.
В термодинамике работу, совершаемую системой по преодолению внешних сил, принято считать положительной, а совершаемую внешними силами над системой - отрицательной. Работа, связанная с увеличением объема системы, называется работой расширения (Lрасш.); с уменьшением объема
– работой сжатия (Lсж.). Работа процесса
В общем случае термодинамическая система может совершать одновременно работу по увеличению своего объема; работу по преодолению внешних сил давления, сил трения; работу по преодолению воздействия гравитационных, магнитных и других полей. Тогда техническая (полезная) работа системы с учетом правила знаков может быть выражена в виде:
Lтех = Lрасш - Lд - ∑Lпр , |
(1.8) |
где Lтех – техническая работа системы; |
|
Lрасш – работа расширения; |
|
Lд – работа по преодолению поля сил давления; |
|
∑Lпр – сумма работ по преодолению сил трения, гравитационных, |
|
магнитных и прочих полей. |
|
Выразим работу через термодинамические параметры. |
Пусть система |
будет задана |
в виде объема |
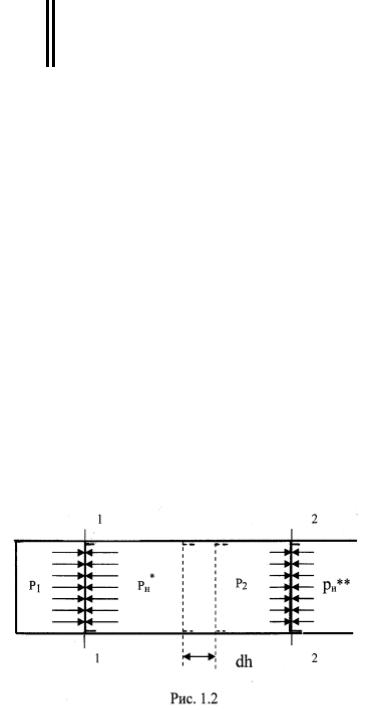
газа, находящегося в цилиндре под поршнем, рис. 1.2. Давление газа над поршнем р1. При давлении окружающей среды рн*, равном р1,
поршень будет неподвижен. При бесконечно медленном уменьшении давления среды от рн* до рн** поршень переместится из положения 1 в положение 2. Произойдет равновесный процесс расширения газа с совершением работы. Элементарное значение этой работы будет равно силе, действующей на поршень pF, умноженной на перемещение поршня dh, т.е.
dLрасш = pF dh,
где F – площадь поршня;
p – давление газа, имеющее величину p1> p> p2.
Так как Fdh = dV, то dL расш = pdV.
Проинтегрировав последнее выражение от начального состояния до
конечного, получим: |
|
Lрасш = 12 pdV . |
(1.9) |
При увеличении объема системы не вся работа расширения полезно использована, часть ее затрачена на вытеснение среды. Для того, чтобы ввести систему объемом V в окружающую среду с давлением p, необходимо
затратить работу по преодолению поля сил давления среды, равную |
pV. Для |
рассматриваемого примера эта работа будет равна: |
|
Lд = pн**V2 – pн*V. |
|
Так как при равновесном процессе pн* = р1 и рн**= р2, то |
|
Lд = p2V2 – p1V1 = 12 d ( pV ) . |
(1.10) |
Для систем, расматриваемых в технической термодинамике, величиной ∑Lпр в (1.8) можно пренебречь, тогда техническая работа будет равна разности между работой расширения и работой по преодолению поля сил давления:
Lтех = Lрасш – Lд.
Используя выражения (1.9) и (1.10), получим: |
|
Lтех = – 12 Vdp . |
(1.11) |
Обратимся к выражению (1.8). Если сумма работ по определению сил трения, гравитационных, магнитных и прочих полей принять равной нулю, то работа системы при переходе из одного состояния в другое есть не что иное, как работа техническая.
Правые части выражений (1.9) и (1.11) представляют собой определенные интегралы непрерывных и положительных внутри промежутка 1-2 функций. Такие интегралы имеют простое геометрическое истолкование.
Так, интеграл вида 12 p(V )dV численно равен площади под кривой функции p(V), изображенной на графике, рис. 1.3, где по оси ординат отложено давление, а по оси абсцисс – объем. Интеграл – 12 V (P)dp = 21V ( p)dp также числен-
но равен площади под кривой, но уже функции V(p), изображенной в координатах pV, рис.1.4. Отсюда работа расширения численно равна площади,
19
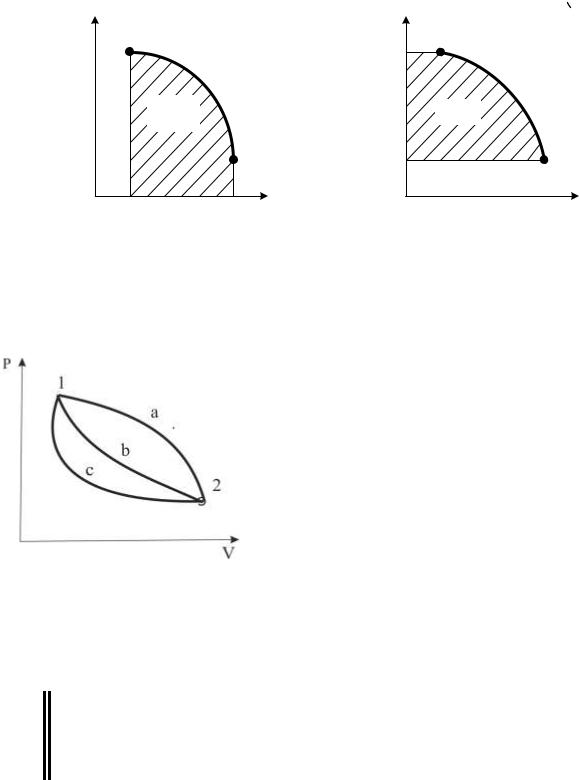
ограниченной кривой процесса 1-2, ординатами V1 и V2 и осью абсцисс, т.е.
Lрасш = F1-2-V2-V1-1.
Техническая работа численно равна площади, ограниченной кривой процесса 1-2, абсциссами p1 и p2 и осью ординат, т.е. Lтех =L 2-P2-P1-1.
p |
|
|
p |
1 |
|
|
1 |
|
|
|
|
|
|
|
p1 |
L расш |
|
|
L тех |
|
|
|
2 |
|
|
2 |
p2 |
V1 |
V2 |
V |
V |
|
|
|
|
Рис. 1.3 |
|
|
Рис. 1.4. |
Работа процесса |
зависит не только от параметров |
начального и |
||||
конечного состояний, но и от того, |
по какому пути осуществляется этот |
|||||
процесс. Как видно из |
рис.1.5, работа расширения и работа техническая |
|||||
будут существенно различаться в процессах 1-а-2, 1-б-2 и 1-с-2. |
|
|||||
|
|
Отсюда |
работа |
как термодинамиче- |
||
|
ская |
величина есть, прежде всего ф у н к ц |
||||
|
и я п р о ц е с с а. Теплоту и работу, отне- |
|||||
|
сенные к массе системы, называют п р и в е д |
|||||
|
е н н ы м и или |
удельными |
Приведенная |
|||
|
теплота q и приведенная работа l выража- |
|||||
|
ются в Дж/кг и .вычисляются с помощью со- |
|||||
|
отношений. |
|
|
|
|
|
|
|
q = Q / m и l = L / m. |
||||
|
Учитывая это, выражения (1.9) и (1.11) |
|||||
|
запишутся: |
|
|
|
|
|
Рис. 1.5 |
lрасш = 2 pdv |
и |
lтех |
= – 2 vdp .. |
||
|
|
1 |
|
|
1 |
|
Здесь рассматриваются системы, в которых протекают о б р а т и м ы е процессы, хотя в действительности все реальные процессы в той или иной степени н е о б р а т и м ы.
Обратимым называют такой процесс, который может быть осуществлен в обратном направлении через те же состояния и точно с тем же обменом энергии в форме теплоты и работы, что и в прямом напправлении.
20
