
483
.pdfганических растворителях могут растворяться и другие пигменты (например, хлорофилл, ксантофиллы, ликопин), их отделяют от каротина путем настаивания с адсорбентами (оксид кальция и оксид алюминия). Интенсивность окрашивания прямо пропорциональна содержанию каротина в исследуемом растительном сырье. Кристаллический каротин легко окисляется на воздухе, поэтому для приготовления шкалы стандартных растворов используют бихромат калия [6].
Лабораторное оборудование и материалы: доски, но-
жи, измельчители растительных образцов, фарфоровая ступка и пестик, стеклянные палочки, шпатели, весы лабораторные (±0,01 г), воронки стеклянные, колбы мерные на 50 мл с пробками, колбы конические с пробками, цилиндры мерные на 5 и 10 мл, пипетки, кюветы с толщиной 1 или 2 см, спектрофотометр.
Объекты анализа: корнеплоды моркови, картофель с белой и жёлтой мякотью, капуста, листовые овощи (петрушка, шпинат и др.), яблоки (зелёные, жёлтые).
Ход анализа
1.Произвести измельчение растительного сырья.
2.Взять навеску мезги 3-5 г в фарфоровую ступку, добавить песок на кончике шпателя.
3.К навеске растительного материала добавить 5 г безводного сернокислого натрия и 5 мл петролейного эфира (бензина), растереть до однородной массы в течение 5 минут.
4.Прилить в ступку еще 10 мл эфира (бензина) и растирать в течение 5 минут.
5.Аккуратно слить только полученный экстракт в колбу
скрышкой на 50 мл, добавить 5 г окиси алюминия 10%-ной влажности и 0,5 г окиси кальция.
5.К остатку мезги добавить еще 10 мл эфира (бензина) и растирать в течение 5 минут.
41

6.Количественно перенести полученный экстракт в колбу к остальной вытяжке.
7.Экстрагирование навески продолжить до полного обесцвечивания получаемого экстракта. Общий объем вытяжки довести 50 мл эфиром (бензином).
8.Экстракт тщательно перемешать, закрыть крышкой и оставить в покое на 15 минут.
9.Надосадочный экстракт аккуратно отобрать пипеткой
вкювету шириной 2-3 см и фотометрировать на спектрофотометре при λ = 450 нм.
Приготовление шкалы образцовых растворов. Для приготовления шкалы используют 6 мерных колб на 50 мл, которые последовательно нумеруют и добавляют при помощи бюретки 1, 2, 5, 10, 15 и 20 мл образцового раствора бихромата калия K2Cr2O7 с концентрацией 0,00416 мг/мл. Объем раствора в колбах доводят до метки дистиллированной водой, перемешивают.
Для записи результатов и удобства проведения последующих расчётов можно использовать следующую форму
(табл. 5).
Таблица 5
Форма таблицы для записей результатов анализа
|
|
|
Эквивалентное |
|
|
|
Кол-во |
Концентрация |
стандартному |
Оптическая |
|
№ |
раствора |
раствору |
|||
раствора K2Cr2O7, |
плотность |
||||
колбы |
K2Cr2O7 |
K2Cr2O7 |
|||
мг/мл |
раствора (D) |
||||
|
в колбе, мл |
содержание |
|||
|
|
|
|||
|
|
|
каротина, мг |
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
|
Исследуемый раствор |
|
|
||
|
|
|
|
|
|
Количество каротина в растительном сырье определяют с помощью калибровочного графика, построенного на осно-
42
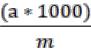
вании данных таблицы. По оси Х откладываем содержание бихромата калия в колбе (мг), а по оси Y – оптическую плотность раствора (D). Зная оптическую плотность раствора исследуемого образца, по калибровочному графику находим содержание каротина в аналитической пробе.
Содержание каротина (К, мг/кг сырья) в составе выбранного продукта с учётом объёма полученного экстракта и массы навески рассчитывают по формуле:
К = |
, |
(11) |
где а – массовая концентрация каротина, определённая по градуированному графику, мг;
1000 – коэффициент пересчета на кг растительного сырья; m – масса навески сырья, г.
Контрольные вопросы:
1.Рассчитайте необходимое количество продуктов в рационе взрослого человека, учитывая суточную потребность в витамине А, Е
иС.
2.Охарактеризуйте витамин А1 как биологически активное ве-
щество.
3.Какие сопутствующие условия увеличивают усвоение витамина А организмом человека? Привести пример.
43
Лабораторная работа № 8.
ОПРЕДЕЛЕНИЕ ОРГАНИЧЕСКИХ КИСЛОТ ЯГОД И ПЛОДОВ
Растение содержит органические кислоты в свободном состоянии и в виде нейтральных солей. В свободном состоянии органические кислоты находятся в ягодах, плодах и листьях некоторых растений (щавель, ревень и др.). В большинстве случаев они связываются с нейтральными солями, что придает растениям приятный вкус. В клеточном соке обычно скапливается несколько видов органических кислот, среди которых иногда превалируют одна или две. Так, в ягодах красной смородины много янтарной кислоты, в листьях табака, в плодах цитрусовых – лимонной, в листьях и плодах брусники – редкой парааминобензойной кислоты, в клюкве – хинной. Больше всего распространены лимонная, яблочная и винная кислоты.
Органические кислоты играют разнообразную роль в растительной клетке. Из них четыре кислоты – пировиноградная, щавелево-уксусная, α-кетоглутаровая и фумаровая кислоты – принимают участие в нейтрализации аммиака и в прямом образовании аминокислот, а, следовательно, белков и амидов.
Уксусная кислота – исходный продукт для синтеза жирных кислот, эфирных масел и смол; щавелево-уксусная и пировиноградная кислоты участвуют в фотосинтезе растений по С4-типу (цикл Хэтча-Слэка) и т.д.
Органические кислоты определяют осмотический потенциал клетки, влияют на проницаемость мембраны, регулируют рН клеточного сока. Иногда они откладываются в клеточном соке в больших количествах в виде кальциевых солей, что блокирует действие этого элемента.
Большинство органических кислот образуется при окислении углеводов в цикле Кребса, но некоторые из них образуются и при фотосинтезе.
44
При анализе растительного сырья различают следующие виды кислотности:
1)общая кислотность, или общее содержание кислоты – общее количество анионов и недиссоциированных молекул кислоты;
2)«истинная кислотность» – концентрация водородных ионов (рН);
3)титруемая кислотность – титруемые щелочью одноосновные кислоты.
Принцип метода основан на извлечении кислот из рас-
тертого растительного материала в результате нагревания с водой при температуре 80-90оС. Величину кислотности определяют прямым титрованием 0,1 Н гидроксидом натрия в присутствии индикатора – фенолфталеина. Момент перехода среды в щелочной диапазон (рН>7) фиксируется визуально – появление розовой окраски. Для расчёта количества кислот используют коэффициент для кислоты, превалирующей в объекте анализа [4].
Лабораторное оборудование и материалы: доски, но-
жи, измельчители, фарфоровые чашки на 100 мл, стеклянные палочки, шпатели, весы лабораторные (±0,01 г), водяная баня, стаканы химические на 250 мл, колбы мерные на 250 мл, бумажные фильтры, пипетки на 50 мл, бюретки, колбы конические на 100 мл.
Объекты анализа: ягоды (клюква, брусника, смородина, малина), фрукты (яблоки, виноград, апельсины), листовые овощи (салат, щавель, ревень).
Ход анализа
1. Для определения титруемой кислотности готовят лабораторную пробу не менее 250 г растительного материала, измельченного и растёртого до однородной массы. Из пробы обязательно удаляют плодоножки, косточки, плотные стенки семенных камер.
45
2.На технических весах отвешивают 25 г мезги и без потерь переносят в стакан вместимостью 250 см3.
3.Прилипшие частицы смывают дистиллированной водой, при помощи которой общий объём доводят до 150 мл.
4.Стакан с содержимым выдерживают в течение 30 мин на кипящей водяной бане.
5.По окончанию времени экспозиции стакан вынимают
исодержимое количественно (при помощи воды) переносят в мерную колбу вместимостью 250 см3.
6.Содержимое колбы перемешивают и доводят раствор до метки дистиллированной водой.
7.После охлаждения, жидкость в колбе фильтруют через вату, марлю или бумажный складчатый фильтр. Полученный фильтрат используют для определения кислотности.
8.Берут пипеткой 50 мл фильтрата, помещают в коническую колбу на 100 мл.
9.Раствор титруют 0,1 Н раствором NaOH в присутствии двух капель фенолфталеина. Момент перехода среды в щелочной диапазон наступает резко, поэтому нужно добавлять щелочь по каплям!
Используя все исходные и полученные данные, производим расчёт титруемой кислотности (ТК, %) с использованием следующего алгоритма:
а) определяем истинное количество щёлочи, пошедшей на титрование (А, мл), для чего количество мл 0,1 Н раствора NaOH (В, мл) умножаем на величину поправки к титру (К) NaOH. Получаем уравнение вида А = В * К;
б) устанавливаем количество щёлочи (С, мл), которая пошла бы на титрование всего фильтрата (250 мл) с учётом аликвоты, взятой для титрования (50 мл), для этого используем пропорцию:
на 50 мл вытяжки пошло – А мл NaOH. на 250 мл вытяжки (или 25 г навески) – С мл NaOH.
46
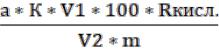
Получаем уравнение вида С = 250 * А / 50;
в) данное количество мл NaOH соответствует 25 граммам навески. Соответственно, на 100 г навески пошло бы в 4 раза больше мл NaOH. Выражение количества израсходованного раствора NaOH на 100 г навески позволяет представить полученный результат в %;
г) на последнем этапе расчётов для выражения результатов в % конкретной кислоты, превалирующей в составе объекта исследования, необходимо количество мл 0,1 Н раствора щелочи, пошедшей на титрование, перемножить на соответствующий коэффициент.
Так, при исследовании винограда переводят на винную кислоту (0,0075), при исследовании цитрусовых – на лимонную (0,0064), при исследовании плодов семечковых и косточковых – на яблочную (0,0067). Для установления преобладающей кислоты в прочих объектах исследования возможно использование лекционного материала.
Представленный алгоритм расчёта количества мл 0,1 Н раствора NaOH, пошедшего на титрование, можно заменить формулой:
ТК, % = |
, |
(12) |
где а – количество 0,1 Н раствора NaOH, пошедшего на титрование, мл
k – поправка к титру щёлочи;
V1 – общий объем экстракта, полученного из навески, мл; 100 – пересчет в %;
Rкисл. – коэффициент для превалирующей кислоты в составе объекта исследования;
V1 – объем экстракта, взятого для титрования, мл; m – масса навески сырья, мг.
При использовании коэффициента пересчета на яблочную кислоту груши имеют титруемую кислотность от 0,10 до
47
0,60%, сливы – от 0,4 до 3,5%, лимоны – от 3,8 до 8%, грана-
ты – от 0,2 до 9,0%, инжир – от 0,2 до 0,6%.
Для закрепления представленного алгоритма расчёта предлагается решение следующей задачи:
На титрование молочной кислоты СН3СНОНСООН в растительной навеске массой 1 г расходуют 14 см3 0,1 моль/дм3 раствора гидроксида натрия. Рассчитать содержание [Wмк, % (маc.)] молочной кислоты в анализируемом веществе.
Титриметрические (или объемные) методы анализа основаны на точном измерении объема раствора с известной концентрацией, требующегося для реакции с определяемым веществом.
Вданном случае следует понимать, что вещества реаги-
руют между собой в эквивалентных количествах (ν1 = ν2) и то, что массы (или объёмы) реагирующих и образующихся веществ пропорциональны молярным массам (объёмам) их эквивалентов.
Вусловиях задачи не дан объем, в котором экстрагировали навеску, поэтому считаем концентрацию без разбавления пробы.
Долю молочной кислоты в продукте (Wмк, %) рассчитываем по формуле:
Wмк = (VNaOH * С * Мэ * 100) / (m * 1000) = 12,6 , (13)
где VNaOH – объем титранта, пошедшего на нейтрализацию молочной кислоты, мл;
С – молярная концентрация эквивалента гидроксида натрия, моль/л;
Мэ – молярная масса эквивалента молочной кислоты, г/моль;
100 – пересчет в %; m – масса навески, г;
1000 – пересчет из мл в л.
48
Контрольные вопросы:
1.Какую роль выполняют органические кислоты в растительном организме?
2.Назовите превалирующие виды органических кислот в составе плодов сельскохозяйственных культур.
3.Каким образом изменяется количество органических кислот в составе растений по мере их созревания?
49
Лабораторная работа № 9.
КАЧЕСТВЕННОЕ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ДУБИЛЬНЫХ ВЕЩЕСТВ
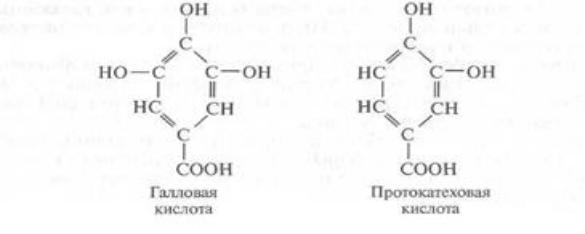
Дубильные вещества относятся к безазотистым соединениям, получившим свое название из-за коры дуба, которая первоначально была использована для дубления кожи, делающего ее эластичной. Они обладают вяжущим вкусом, способностью осаждать белки; с железом образуют танины. Дубильные вещества имеют большое значение в пищевой промышленности. Вкус многих вин зависит именно от использования при обработке кожицы ягоды винограда, в которой содержатся дубильные вещества. При выведении сортов растений, из которых приготавливают зеленый чай, отбор ведут с учетом наименьшего количества дубильных веществ. Побурение яблок на срезе вызвано деятельностью полифенолоксидазы, окисляющей дубильные вещества.
По химической природе дубильные вещества близки к фенолам. Большинство дубильных веществ плодов и ягод являются производными галловой и протокатеховой кислот. В некоторых растениях галловая кислота содержится не только
ввиде дубильных веществ, но и в свободном виде, например,
вчайном листе, дубовой коре, корнях гранатового дерева, древесине эвкалипта.
50
