
483
.pdfЛабораторная работа № 5.
МИКРОХИМИЧЕСКИЙ АНАЛИЗ ЗОЛЫ РАСТЕНИЙ
В составе растений обнаружены практически все химические элементы периодической системы Д.И. Менделеева. Между тем для нормального прохождения жизненного цикла им необходимо лишь 20 из них: С, Н, О, N, Р, К, Si, S, Na, Cl, Са, Мg, Fе, Мn, В, Со, Zn, Сu, Мо I. Среди этих элементов только 17 являются собственно минеральными, а С, Н и О поступают в растения преимущественно в виде СО2, О2, Н2О. Около 99% массы растений приходится на водород, углерод, кислород, азот и лишь 1% – занимают другие элементы. На долю углерода приходится – 50-60%, водорода – 3-4%, кислорода – 25-30%, азота – 9-10% сухого вещества (прил. 6).
Помимо перечисленных 20 элементов отдельные культуры положительно относятся на внесение Al, F, W, Li. Эти элементы принято называть условно необходимыми, поскольку их «необходимость» для всех растений экспериментально окончательно не установлена.
Все элементы, входящие в группу «необходимых», физиологически незаменимы, а их функции в растениях строго специфичны. Недостаток любого из них приводит к глубокому нарушению обмена веществ и физиолого-биохимических процессов у растений, ухудшению их роста и развития, снижению продуктивности, качества урожая. При остром дефиците элементов этой группы у растений появляются характерные признаки голодания. Между тем, количественные потребности растений в том или ином элементе резко различаются.
Большое значение при оценке качества урожая сельскохозяйственных культур имеет зольность – остаток от сжигания сухого вещества растений, представленный зольными элементами. Зола составляет 0,5-5% массы сухого вещества
31
растений. Однако отдельные ткани и органы существенно отличаются по ее содержанию. Так, семена содержат около 3% золы от сухой массы, листья – 10-15%, травянистые стебли и корни – 4-5%. Ткани растений, состоящие из живых клеток, содержат золы больше, чем ткани, состоящие из мертвых клеток. Количество золы в растении в значительной степени зависит от состава почвы и используемых удобрений, условий увлажнения.
Состав золы растений различен и отражает неодинаковую потребность культур в элементах минерального питания.
Принцип метода основан на получении золы растений посредством сжигания навески материала при температуре 550оС. Зольный остаток растворяют в воде и проводят качественные реакции, указывающие на наличие элементов питания в его составе [10].
Лабораторное оборудование и материалы: фарфоровые чашки на 25 мл, стеклянные палочки, бумажные фильтры (чёрная лента), шпатели, стеклянные пробирки, воронки на 5 мл, цилиндры мерные на 10 мл, предметные стекла, микроскоп, трубочка с оттянутым тонким капилляром, штатив для пробирок.
Объекты анализа: зола листьев и семян различных культурных растений (горох, пшеница, клевер, ячмень, козлятник, овес и т.д.).
Ход анализа
1. Качественные реакции на присутствие хлора и серы.
1.1.В фарфоровую чашку берут навеску золы и добавляют 5 мл дистиллированной воды;
1.2.Навеску золы растирают в водном растворе с помощью пестика в течение 3 минут;
1.3.Полученную суспензию фильтруют в пробирку через бумажный фильтр, установленный в воронке;
32
1.4.Отфильтрованный раствор разделяют на 2 равные части для последующего определения хлора (пробирки №1) и серы (пробирка №2) в составе золы, которые находятся в соединениях с натрием, калием, кальцием и другими зольными элементами;
1.5.В пробирку №1 приливают 2 капли 1%-ного раствора AgNO3 и перемешивают;
1.6.Качественная оценка наличия хлора в составе золы возможна за счёт протекания следующей химической реакции:
КCl + AgNO3 → AgCl↓ + КNO3
1.7.Визуальное определение количество хлора в составе золы основано на характере появившегося окрашивания – появление опалесценции, помутнение раствора или выпадения белого осадка;
1.8.В пробирку №2 приливают 3 капли 25%-ного раствора соляной кислоты, после чего содержимое перемешивают;
1.9.Приливают 5 капель 5%-ного раствора BaCl2. О присутствии в золе растений серы, в виде сульфат иона, можно судить за счёт протекания следующей химической реакции:
К2SO4 + BaCl2 → BaSO4↓ + 2КCl
1.10. Визуальное определение количества серы в составе золы основано на характере появившегося окрашивания раствора – появление опалесценции, помутнение раствора или выпадения белого осадка.
2. Качественные реакции на присутствие кальция, калия, магния и фосфора.
2.1. В фарфоровой чашке готовят новую вытяжку золы, используя для этого 2-3 мл 10%-ного раствора соляной кислоты;
33
2.2.Навеску золы растирают с помощью пестика в течение 3 минут до однородной массы и фильтруют, перенося с помощью стеклянной палочки на фильтр;
2.3.Для проведения всех реакций достаточно 5-7 капель фильтрата, которые прямо с кончика воронки по капле наносят на каждое предметное стекло по количеству определяемых элементов;
2.4.Последующую работу выполняют с соблюдением максимальной чистоты стекол и капиллярной трубочки. Микроскопический анализ нужно проводить только на высохших, чистых препаратах при малом увеличении микроскопа;
2.5.Для приготовления препаратов на противоположный край предметных стёкол наносят требуемый по реакции реактив;
2.6.Каждое предметное стекло заранее подписывают в нижнем левом углу маркером или восковым карандашом, обозначая искомый элемент;
2.7.Реакцию ведут с помощью капиллярной трубочки, аккуратно соединяя на каждом стекле капли мостиком, не размазывая реактивы по стеклам;
2.8.Капиллярную трубочку после каждой реакции промывают проточной, а затем дистиллированной водой. После подсыхания мостиков их просматривают под малым увеличением микроскопа;
2.9.Полученные кристаллы зарисовывают в тетрадь и идентифицируют при помощи рисунков (рис. 1);
2.10.Для обнаружения кальция капельку вытяжки соединяют мостиком с 1%-ным раствором серной кислоты (H2SO4). При этом в мостике происходит следующая реакция:
CaCl2 + H2SO4 → CaSO4+ 2HCl
2.11. Для обнаружения калия капельку вытяжки соединяют мостиком с раствором Na3[Cо(NO2)6] – гексанитро-(III)-
34
кобальтатом натрия. В этом случае реакция идет по уравнению:
2KCl + Na3[Cо(NO2)6] → K2Na[Cо(NO2)6]↓ + 2NaCl
2.12. Для обнаружения магния к капельке испытуемого раствора добавляют водный раствор аммиака (NH4OH). Затем на противоположный край стекла наносят раствор кислого фосфорнокислого двузамещённого натрия (Na2HPO4) и только потом каплю раствора золы соединяют мостиком. Реакция идет по уравнению:
MgCl2 + NH4OH + Na2HPO4 → NH4MgPO4 + 2NaCl +H2O
2.13. Для обнаружения фосфора капельку вытяжки соединяют мостиком с каплей 1%-ного раствора молибдата аммония ((NH4)2MoO4) в азотной кислоте (HNO3). Реакция идет по уравнению:
H3PO4 + 12(NH4)2MoO4 + 2HNO3 → (NH4)3PO4*12MoO3 +
21NH4NO3 + 12H2O
3. Качественная реакция на присутствие железа.
3.1.Присутствие железа определяют в вытяжке, которую получают путем прибавления соляной кислоты на фильтр с оставшейся золой;
3.2.Фильтрат собирают в ступку и к нему прибавляют 1-2 см3 желтой кровяной соли (К4[Fe(CN)6]). В присутствии в золе железа образуется берлинская лазурь. В этом случае реакция идет по уравнению:
К4[Fe(CN)6] + FeCl3 = KFe[Fe(CN)6]↓ + 3KCl
После окончания работы делают выводы о наличии и количестве определяемых элементов в составе золы сельскохозяйственных культур.
35
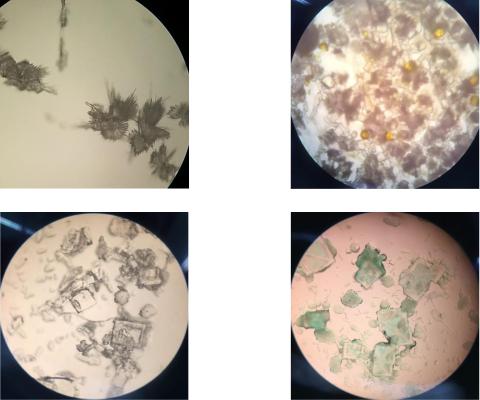
Кристаллы сульфата кальция |
Кристаллы кобальтонитрита калия |
Кристаллы фосфорно-аммиачно- |
Кристаллы фосфорно-молибденового |
магнезиальной соли |
аммония |
Рисунок 1. Снимки кристаллов солей зольных элементов (Са, К, Mg, Р) полученные при микроскопировании сделанных препаратов (×10)
Контрольные вопросы:
1.Какие элементы относятся к числу жизненно важных и необходимых компонентов минерального питания?
2.Какие элементы остаются в составе золы растений?
3.В чём заключается особенность микрохимического метода анализа золы растений? С какими из ранее освоенных методов определения он схож?
36
Лабораторная работа №6.
ОПРЕДЕЛЕНИЕ АКТИВНОСТИ УРЕАЗЫ В СЕМЕНАХ БОБОВЫХ И ЗЕРНОБОБОВЫХ КУЛЬТУР
Ферменты – это органические катализаторы внутриклеточных процессов. Все биохимические реакции в клетке катализируются ферментами или их целыми сопряженными системами. Ферменты — это белковые вещества, характеризующиеся высокой специфичностью катализа различных биохимических реакций.
Один из наиболее знакомых нам ферментов – уреаза. Уреаза катализирует гидролиз мочевины до аммиака и углекислого газа по уравнению: уреаза
CO(NH2)2 + H2O → CO2 + 2NH3
Уреаза присутствует преимущественно в тканях растений, содержащих уреиды. Значение уреазы отмечается в разложении мочевины, образующейся в растительных клетках в результате распада различных ассимилятов, например, пуринов, белков, нуклеиновых кислот. Уреаза имеет огромное значение в круговороте азота в природной среде и непосредственно в сельскохозяйственном производстве. В почвах и питательных грунтах образовавшийся в результате уреазной активности, аммиак служит непосредственным источником азотного питания растений.
Уреаза – гидролитический фермент из группы амидаз. Ингибиторами фермента являются тяжелые металлы, перекись водорода, ацетогидроксамовая кислота. В больших количествах фермент присутствует в зерне гороха, вики, соевых бобах, в флоэме березы, клёна и др., но бобы сои являются источником препаративного выделения фермента.
Принцип метода основан на определении активности фермента после экстракции из растительного сырья 0,05 М фосфатным буферным раствором с мочевиной (рН 6,9-7,0 ед.
37
рН) при температуре 30 оС. Щелочную реакцию среды от образующегося в результате активности уреазы аммиака нейтрализуют избытком 0,1 М соляной кислоты и проводят обратное титрование 0,1 М раствором гидроксидом натрия [3].
Лабораторное оборудование и материалы: фарфоровая ступка и пестик, стеклянные палочки, шпатели, весы лабораторные (±0,01 г), водяная баня, колбы для титрования на 150200 мл, пипетки на 10 и 50 мл, воронки стеклянные, стаканы химические на 50 мл, колбы мерные на 50 мл с пробками, бюретки, мерный цилиндр на 10 мл.
Объекты анализа: соевая мука, гороховая мука, пророщенные зерна вики, гороха, сои.
Ход анализа
1.Измельчить растительное сырье.
2.Взять навеску мезги 1 г в ступку и растереть с 5 мл буферного раствора с рН 7,0 до однородной кашицы.
В случае анализа муки взять навеску 1 г в химический стакан на 50 мл.
3.Количественно перенести содержимое ступки или стакана в мерную колбу на 50 мл c помощью небольших порций (5-10 мл) буферного раствора.
4.Довести содержимое колбы буферным раствором до метки, хорошо перемешать и перелить колбу для титрования на 200 мл.
5.Колбу с экстрактом поставить на водяную баню, закрыв воронкой при температуре 30 оС, и выдержать 30 минут, периодически помешивая.
6.При помощи пипетки в колбу внести 50 мл раствора
0,1 М соляной кислоты и перемешать, охладить колбу в холодной воде до комнатной температуры (20 оС).
7.В колбу добавить фенолфталеин и оттитровать содержимое колбы раствором 0,1 М гидроксида натрия до появления слаборозовой окраски.
38
8.Параллельно провести контрольное титрование: в колбу для титрования пипеткой внести 50 мл буферного раствора и 10 мл 0,1 М раствора соляной кислоты и повторить все процедуры, описанные выше, начиная с п. 5.
9.Активность уреазы (мг азота) рассчитать по формуле:
U = 14*k*0,1*(V0-V1)/30*m , |
(10) |
где k – поправочный коэффициент к титру гидроксида натрия;
V0 – объем 0,1 М гидроксида натрия, истраченного в контрольном титровании, мл;
V1 – объем 0,1 М гидроксида натрия, пошедшего на титрование исследуемого экстракта, мл;
m – масса навески, г.
Сделать вывод об активности уреазы в исследуемом материале.
Контрольные вопросы:
1.Какие группы ферментов принято выделять в составе растений? Какой принцип заложен в основе их классификации?
2.От каких факторов и условий зависит активность ферментов?
3.Приведите примеры процессов жизнедеятельности растений, которые протекают при непосредственном участии ферментов.
4.Что входит в состав ферментов?
39
Лабораторная работа №7.
ОПРЕДЕЛЕНИЕ КАРОТИНА В ОВОЩАХ И ФРУКТАХ
Витаминами принято называть группу низкомолекулярных органических веществ различного химического строения, которые выполняют важные биологические функции в живых организмах. Эти вещества объединены по их значению для нормального обмена веществ и жизнедеятельности животных и человека. В отличие от основных питательных веществ витамины требуются в значительно меньших количествах. Они являются во многих случаях составными частями биокатализаторов – ферментов.
Растительные организмы, являясь продуцентами, обладают уникальными способностями в биосинтезе различных органических веществ. Используя энергию солнца и элементы неорганической природы, они создают огромное количество соединений, в их числе и витамины. Природные соединения, превращающиеся в организме человека в витамины, называются провитаминами (прил. 4).
Каротин (С40Н56) – это растительный предшественник витамина А (провитамин А). Именно этот желто-оранжевый пигмент под воздействием ферментов и желчных солей превращается в известный нам ретинол – жирорастворимый витамин, антиоксидант. В чистом виде каротин нестабилен, встречается как в растительных продуктах, так и в животных источниках.
Известны три изомера каротина α-, β- и γ-, из которых наиболее распространен β-каротин. В животном организме молекула β-каротина при окислительном распаде образует две молекулы, а α- и γ-каротин – одну молекулу витамина А.
Принцип метода основан на способности каротина растворяться в органических растворителях (бензин, петролейный эфир и др.), окрашивая их в желтый цвет. Так как в ор-
40
