
483
.pdf
Жиры с высоким йодным числом при хранении легко прогоркают и теряют свои пищевые достоинства.
Йодные числа большинства животных жиров колеблются в пределах 30…70, а растительных – в пределах 120…160.
Приведенный в данной работе метод является удобным для сравнительной оценки образцов и отбора в процессе селекции растений с повышенной или пониженной степенью ненасыщенности масла.
Принцип метода заключается в определении йодных чисел для масел по показателям преломления, определяемых на рефрактометре при 20°С [9].
Лабораторное оборудование и материалы: весы лабо-
раторные (±0,01 г), химические стаканы на 25 мл, пипетки, рефрактометр с термометром.
Объекты анализа: различные виды растительных масел, растительное масло, хранящееся при разных условиях, масла с вышедшим сроком годности.
Ход анализа
1.В химический стакан перенести 5-10 г средней пробы
масла.
2.При помощи пипетки нанести несколько капель масла на предметное стекло рефрактометра.
3.Для каждого из образцов определить показатель пре-
ломления (nD20) при температуре близкой к 20°С в 3-х кратной повторности.
4.Результаты всех определений в группе записывают в сводную таблицу 3.
Таблица 3
Результаты определения йодного числа масел
|
|
|
|
|
Нормируемая |
Вид |
Показатель преломления (nD20) |
величина йодного |
|||
растительного |
|
|
|
|
числа масла |
масла |
|
|
|
|
|
1 проба |
2 проба |
3 проба |
среднее |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
21
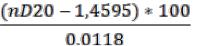
Величину йодного числа (J) вычисляют по формуле, в которую подставляют среднюю величину показателя преломления, полученную для 3-х параллельных проб масла, взятых из одного образца:
J = |
(7) |
где J – йодное число;
nD20 – показатель преломления масла при 20°С;
1,4595 – показатель преломления для растительных ма-
сел;
100 – перевод в %.
Определение кислотного числа растительных жиров
Кислотное число – физическая величина, равная массе гидроокиси калия (мг), пошедшей на титрование, выражается в мг КОН / г.
Принцип метода заключается в растворении определенной массы растительного жира в растворителе, с последующим титрованием (нейтрализацией) щелочью свободных жирных кислот и других сопутствующих триглицеридам веществ до точки эквивалентности [9].
Лабораторное оборудование и материалы: весы лабо-
раторные (±0,01 г), шкаф сушильный лабораторный с терморегулятором, баня водяная, термометр, таймер, конические колбы на 250 мл, мерный цилиндр на 50 мл, бюретки.
Объекты анализа: растительные масла (оливковое, подсолнечное, рапсовое, репейное, горчичное, кукурузное), растительные спреды.
Ход анализа
1. Прозрачное незастывшее растительное масло перед взятием навески для анализа хорошо перемешать. При наличии в жидком масле мути или осадка, а также при анализе застывших масел часть лабораторной пробы (50 г) поместить в
22
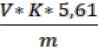
сушильный шкаф, в котором поддерживается температура (50±2)°С, нагреть до заданной температуры. Затем масло перемешать. Если после этого масло не становится прозрачным, его необходимо фильтровать при температуре 50°С.
2.В коническую колбу вместимостью 250 мл взять навеску растительного масла массой 3-5 г с точностью до 0,01 г.
3.В колбу с навеской масла при помощи мерного цилиндра прилить 50 мл спиртоэфирной нейтрализованной смеси.
4.Содержимое колбы перемешать. Если при этом масло не растворяется, его необходимо нагреть на водяной бане до температуры (50±2)°С, затем охладить под струёй водопроводной воды до 20°С.
5.К полученному раствору добавить несколько капель индикатора фенолфталеина для визуального контроля точки эквивалентности при переходе уровня рН из кислой в щелочную среду (рН = 8,2).
6.При помощи бюретки полученный раствор при постоянном помешивании необходимо титровать 0,1 молярным раствором гидроксида калия (натрия) до получения слаборозовой окраски, устойчивой в течение 30 с.
Величину кислотного числа масла (К, мг КОН/г) вычисляют по формуле:
К = |
, |
(8) |
где V – объем раствора щёлочи, израсходованного на титрование, мл;
k – поправочный коэффициент к титру щёлочи;
5,61 – масса КОН в 1 мл раствора КОН 0,1 молярной концентрации, мг;
m – масса навески, г.
Полученные данные занести в сводную таблицу.
23
Контрольные вопросы:
1.Какие константы характеризуют физико-химические свойства и качество жиров?
2.В каких пределах изменяется йодное число жиров животного
ирастительного происхождения?
3.Какими свойствами обладают жиры с высоким йодным числом, для каких целей они могут использоваться?
24
ВОПРОСЫ ДЛЯ ТЕКУЩЕГО КОНТРОЛЯ, ТЕМЫ РЕФЕРАТОВ И ЭССЕ
Вопросы и задания к коллоквиуму
1.Что собой представляют липиды? Назовите основные группы данных соединений.
2.Перечислите функции липидов в растениях.
3.Назовите главные жирные кислоты растительных организмов.
4.Какие факторы определяют температуру плавления жира?
5.Приведите примеры твердых растительных жиров.
6.Назовите необычные жирные кислоты растительных организмов.
7.Чем обусловлен процесс прогоркания жиров?
8.Назовите основные гликолипиды растений и их функции.
9.В каких органеллах и за счёт каких процессов происходит синтез жирных кислот в растительном организме?
10.Назовите основные этапы биосинтеза липидов.
11.Какова биологическая роль процессов биодеградации липидов в расте-
нии?
12.Перечислите основные пути превращения жирных кислот.
13.Глиоксилатный цикл. Химизм процесса. Исходные и конечные про-
дукты.
14.Назовите гидрофобные соединения, защищающие поверхность растений. Процесс их синтеза и отличие по химическому строению.
Темы рефератов и эссе
1. Особенности липидного состава растительных организмов.
2.Анализ структуры и функции липидов тилакоидных мембран.
3.Метаболическая активность производных жирных кислот – ацетогенинов, оксилипинов, жирных спиртов.
4.Роль липидов в процессе передачи информации в клетке.
5.Типы биохимических модификаций, которые позволяют биологическим мембранам выполнять специализированные клеточные функции: транспорт ионов, макромолекулярный перенос, передача энергии и трансдукция сигнала.
6.Эволюционное разнообразие фосфолипидных структур клетки.
25
Лабораторная работа №4.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ВОДОРАСТВОРИМЫХ УГЛЕВОДОВ В ОВОЩАХ И ФРУКТАХ
Растворимые углеводы (сахара) являются неотъемлемым компонентом любой ткани растения. Количественный и качественный состав сахаров у разных растений может варьироваться в широких пределах (прил. 3). В корнеплодах сахарной свеклы накапливается 19-21% сахаров, представленных главным образом сахарозой. Ягоды винограда содержат 20-30% сахаров, состоящих почти исключительно из глюкозы и фруктозы. Много сахаров содержат персики, абрикосы, яблоки, груши, сливы, цитрусовые и ягодные культуры. У всех растений, особенно у ягодных культур (земляника, смородина, малина, вишня, хурма), относительное содержание моносахаридов и сахарозы подвержено значительным колебаниям. На сахаристость и соотношение различных сахаров в плодах оказывают влияние самые разнообразные факторы – увлажнение почвы, температура, количество вносимых минеральных удобрений, длина светового периода и др.
Большая часть сахаров находится в клеточном соке, и одним из приемов оценки образцов является анализ сока растения. Сахара легко растворяются в воде и на этом свойстве основано их выделение из растений и перевод в водную вытяжку.
Количественное определение сахаров проводят с помощью самых разнообразных методов, основанных на их физических и химических свойствах. Наиболее общий классический химический метод количественного определения сахаров, обладающих свободной альдегидной или кетонной группой, основан на способности этих функциональных групп восстанавливать в щелочной среде окисную медь в закись меди.
26
Принцип метода основан на способности растворимых углеводов извлекаться из растительного материала горячей дистиллированной водой. Полученную в растворе смесь простых углеводов (содержащих альдегидную группу) восстанавливает реактив Феллинга (смесь щелочного раствора сегнетовой соли и сернокислой меди 1:1). При этом моносахариды окисляются до соответствующих кислот, а окись меди восстанавливается до закиси меди и выпадает в осадок крас- но-бурого цвета. При этом количество осадка будет эквивалентно количеству углеводов в растворе [8].
Лабораторное оборудование и материалы: доски, но-
жи, измельчители растительных образцов, фарфоровые чашки на 25 мл, шпатели, весы лабораторные (±0,01 г), пробирки центрифужные на 50 мл, пипетки на 5 мл, стеклянные палочки, центрифуга, пробирки, штативы, автоматический дозатор, спектрофотометр, кюветы.
Объекты анализа: светлые фрукты (яблоки, груши, виноград) и овощи (чеснок, лук, кабачки, морковь и т.д.)
Ход анализа
1. Измельчить растительное сырье, после чего взять на лабораторных весах навеску мезги 0,5-2 г в фарфоровую чашку.
2.Количественно перенести навеску в центрифужную пробирку с помощью дистиллированной воды и довести общий объем до 30 мл.
3.Поставить пробирки на водяную баню, нагретую до 75-80оС на 15 мин. Раствор в пробирке периодически перемешивать.
4.Снять пробирку с водяной бани и охладить при помощи водопроводной воды до комнатной температуры.
5.Последовательно добавить 2 мл уксуснокислого свинца и 6 мл 10% раствора сульфата натрия.
27
8.Довести содержимое пробирки до объема 50 мл дистиллированной водой и перемешать.
9.Провести центрифугирование содержимого пробирки
втечение 10 мин при 3000 об/мин.
10.Взять пипеткой 5 мл вытяжки в пробирку объемом
15-20 мл.
11.Добавить пипеткой 5 мл реактива Феллинга, пере-
мешать.
12.Пробирку с раствором нагреть на водяной бане 10 мин. При нагревании происходит осветление раствора и выпадение в осадок красного цвета меди реактива Феллинга.
13.Пробирки охладить и центрифугировать 3 мин при 3000 об/мин.
14.Надосадочный раствор отобрать пипеткой и фотометрировать при λ = 630 нм в кюветах шириной 1 см на спектрофотометре.
Приготовление шкалы образцовых растворов. Для при-
готовления шкалы используют 6 мерных колб на 100 мл, которые последовательно нумеруют при помощи маркера и добавляют при помощи автоматического дозатора 1, 2, 5, 10, 15 и 20 мл образцового раствора глюкозы с концентрацией 6 мг/мл. Следующий шаг – добавление Н2Одист. в колбы до метки, чтобы общий объём раствора составил 100 мл. Перемешиваем. Из каждой колбы отбираем по 5 мл раствора в центрифужные пробирки и добавляем эквивалентное количество реактива Феллинга. Содержимое пробирки нагреваем на водяной бане 10 мин, охлаждаем и центрифугируем 3 мин при 3000 об/мин. Производим фотометрирование полученных растворов.
Для записи результатов и удобства проведения последующих расчётов можно использовать следующую форму
(табл. 4).
28
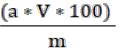
Таблица 4
Форма таблицы для записей результатов анализа
|
Кол-во раствора |
Концентрация |
Концентрация |
Оптическая |
|
№ |
глюкозы |
||||
глюкозы |
образцового раствора |
плотность |
|||
колбы |
в калибровочном |
||||
в колбе, мл |
глюкозы, мг/мл |
раствора (D) |
|||
|
растворе, мг/мл |
||||
|
|
|
|
||
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
|
Исследуемый раствор |
|
|
||
|
|
|
|
|
|
Количество глюкозы определяем с помощью калибровочного графика, построенного на основании данных таблицы. По оси Х откладываем концентрацию глюкозы в калибровочном растворе (мг/мл), а по оси Y – оптическую плотность раствора
(D). Зная оптическую плотность раствора исследуемого образца, по калибровочному графику находим содержание глюкозы в аналитической пробе.
Содержание водорастворимых сахаров (С, %) в составе выбранного продукта, с учётом объёма полученного экстракта и массы навески, рассчитывают по формуле:
С = |
, |
(9) |
где а – значение с графика, мг/мл;
V – общий объем полученного экстракта из навески, мл; 100 – пересчет в %;
m – масса навески сырья, мг
Контрольные вопросы:
1.Перечислите основные группы углеводов в составе растений
иих типичных представителей.
2.Какие функции выполняют водорастворимые сахара в составе растений?
3.Какие культуры отличаются высоким содержанием углеводов в своём составе? Каким образом это используется в рамках промышленного производства?
29
ВОПРОСЫ ДЛЯ ТЕКУЩЕГО КОНТРОЛЯ, ТЕМЫ РЕФЕРАТОВ И ЭССЕ
Вопросы и задания к коллоквиуму
1.Приведите примеры природных гексоз, каковы их функции в растении?
2.Распространение гептоз в составе растительных организмов.
3.Что собой представляют восстанавливающие сахара? Приведите примеры не восстанавливающих сахаров.
4.Какие реакции используются для количественного определения сахаров
врастении?
5.Какие производные моносахаридов известны, их биологические функ-
ции?
6.Назовите основные дисахариды растений и их функции.
7.В каких компартментах может происходить синтез сахарозы в растени-
ях?
8.Приведите примеры три-, тетра- и пентасахаров. Выполняемые ими функции в растительном организме.
9.Каковы функции полисахаридов в растениях?
10.Перечислите химические свойства запасных полисахаридов.
11.Какие компоненты входят в состав крахмала?
12.Назовите основные группы фруктозанов. Какие функции они выполняют в растении?
13.Перечислите пути и место синтеза запасных и структурных полисаха-
ридов.
14.Какие соединения являются донорами и акцепторами гликозильных остатков при биосинтезе полисахаридов?
Темы рефератов и эссе
1.Связь химической структуры и свойств моносахаридов.
2.Производные моносахаридов и их роль в жизни растений.
3.Взаимопревращение моносахаридов и их производных в растительном организме.
4.Запасные полисахариды растений – особенности строения и биосинтеза.
5.Многообразие структурных полисахаридов растений, взаимосвязь структуры и функции.
6.Методы количественного определения моно-, олиго- и полисахаридов в
растительном материале.
30
