
Химия сборник лабораторных работ
ФИО студента _____________________________________ группа __________
ЛАБОРАТОРНАЯ РАБОТА №7 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И ДИСПЕРСНЫЕ СИСТЕМЫ
Все биологические системы представляют собой гетерогенные системы, состоящие из двух или более фаз или мезофаз, которые отделены друг от друга поверхностью раздела, где свойства системы изменяются скачкообразно. Поэтому на поверхности раздела фаз наблюдаются различные поверхностные явления: поверхностное натяжение, сорбция, адгезия, смачивание, капиллярная конденсация.
Силы межмолекулярного взаимодействия молекул на поверхности раздела фаз выше, чем у молекул внутри фазы. Эти отличия в энергетическом состоянии всех молекул поверхностного слоя характеризуются свободной поверхностной энергией Gs.
Свободной поверхностной энергией называется термодинамическая функция, характеризующая энергию межмолекулярного взаимодействия частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз, она зависит от количества частиц на поверхности раздела фаз и удельной энергии межфазного взаимодействия: Gs = σ∙S.
Вмедико-биологической практике среди поверхностных явлений наибольшее значение имеет сорбция.
Сорбция – гетерогенный процесс самопроизвольного поглощения твердым телом или жидкостью веществ из окружающей среды. Процесс сорбции может сопровождаться диффузией вещества в глубь сорбента, такой вид сорбции называется абсорбцией. В других случаях сорбция сопровождается концентрированием поглощаемого вещества на поверхности сорбента, такой вид сорбции называется адсорбцией.
Взависимости от природы сил, действующих между адсорбентом и адсорбатом, различают физическую и химическую адсорбцию.
Физическую адсорбция обусловлена межмолекулярным взаимодействием за счет сил Ван-дер-Ваальса или водородной связи. Энергия этих взаимодействий небольшая и, поэтому, для физической адсорбции характерны: обратимость, неспецифичность, экзотермичность.
Химическая адсорбция (хемосорбция) происходит при взаимодействии адсорбента с адсорбатом с образованием прочной химической связи, в следствие чего хемосорбция практически необратима, специфична и локализована.
С кинетической точки зрения адсорбция является обратимым процессом, т.е. одновременно с адсорбцией происходит десорбция, когда адсорбированные молекулы вследствие кинетического движения уходят с поверхности адсорбента
вгазовую фазу или раствор. В начале процесса скорость адсорбции больше скорости десорбции. По мере насыщения поверхности адсорбента устанавливается состояние адсорбционного равновесия, которое характеризуется равенством скоростей адсорбции и десорбции. Концентрация вещества в газовой фазе или растворе, отвечающая состоянию равновесия называется равновесной. Адсорбционное равновесие подвижно и может быть смещено в ту или другую сторону в соответствии с принципом Ле-Шателье.
71
ФИО студента _____________________________________ группа __________
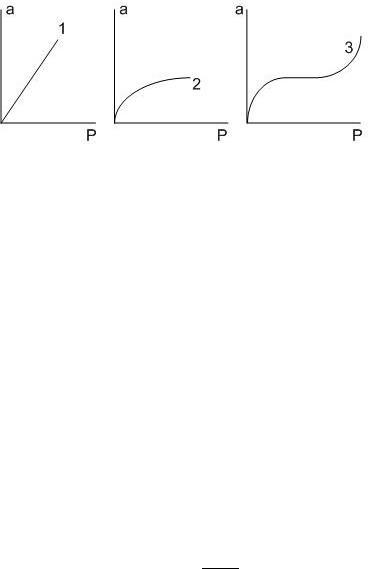
Количественно адсорбцию можно выражать в молях адсорбата на единицу площади поверхности адсорбента, моль/м2, или на единицу массы адсорбента, моль/г. Кривую зависимости величины адсорбции Г от равновесных концентрациq С или давления P адсорбата при постоянной Т называют изотермой адсорбции: Г = f(С) или Г = f(P) при Т = const (рис. 7.1).
Рис. 7.1. – Типы изотерм адсорбции: 1 – Генри; 2 – Ленгмюра; 3 – полимолекулярная адсорбция БЭТ
Наибольшее значение имеют изотерма мономолекулярной адсорбции Ленгмюра и изотерма полимолекулярной адсорбции Фрейндлиха. Эти изотермы описывают адсорбционные процессы, протекающие по различным механизмам.
При выводе уравнения изотермы адсорбции Ленгмюр исходил из возможности реализации на практике следующих предположений:
адсорбционные центры адсорбента являются однородными и равномерно распределены на его поверхности;
адсорбированная молекула занимает на поверхности адсорбента только один адсорбционный центр;
взаимодействие между адсорбированными молекулами в адсорбционном слое отсутствует;
процесс адсорбции завершается образованием мономолекулярного адсорбционного слоя, когда все адсорбционные центры заняты молекулами адсорбирующегося вещества.
Исходя из этих предположений, Ленгмюр на основе молекулярнокинетических представлений получил следующее уравнение изотермы адсорбции:
Г = Г∞ 1+ ,
где: Г предельная адсорбция, достигаемая при заполнении всех активных центров поверхности адсорбента; К – константа адсорбционного равновесия; С – равновесная концентрация.
Для нахождения констант Г и К в уравнении Ленгмюра его представляют
в линейной форме: |
|
|
|
|
|
|
1 |
= |
1 |
+ |
1 |
|
1 |
|
|
Г∞ К |
||||
Г |
|
Г∞ |
С |
|||
Строят график в координатах 1/Г = f(1/C), представляющий собой прямую линию, тангенс угла наклона которой равен 1/Г ·К, а отрезок, отсекаемый на оси ординат, равен 1/Г .
72
ФИО студента _____________________________________ группа __________
Экспериментальные изотермы не всегда описываются уравнением Ленгмюра. Возможные причины отклонений:
1)неоднородность поверхности;
2)зависимость константны адсорбционного равновесия от степени заполнения, часто – уменьшение константы адсорбции по мере увеличения степени заполнения;
3)ассоциация адсорбированных молекул на поверхности.
Сучетом этих факторов экспериментальные изотермы адсорбции не ограничиваются монослоем и вид получаемых зависимостей адсорбции от давления может иметь различный вид.
Уравнение Фрейндлиха – эмпирическое уравнение, которое хорошо описывает начальный криволинейный участок изотермы адсорбции. Например,
спомощью уравнения Фрейндлиха хорошо описываются изотермы типа 2, которые имеют отклонения от уравнения Ленгмюра:
Г= К·С1/n,
где: где К и n константы, K зависит от температуры, n>>1.
Для нахождения констант К и 1/n в уравнении Фрейндлиха его представляют в линейной форме:
lgГ = lgKc + 1/n·lgC
Строят график в координатах lgГ = f(lgC), представляющий собой прямую линию, тангенс угла наклона которой равен 1/n, а отрезок, отсекаемый на оси ординат, равен lgKc.
Дисперсной называют систему, в которой одно вещество распределено в среде другого, причем между частицами и дисперсионной средой есть граница раздела фаз. Дисперсные системы состоят из дисперсной фазы и дисперсионной среды.
Поскольку дисперсная фаза находится в виде отдельных небольших частиц, то дисперсные системы, в отличие от гетерогенных систем со сплошными фазами, называют микрогетерогенными, а коллоидно-дисперсные системы называют также ультрамикрогетерогенными, чтобы подчеркнуть, что в этих системах граница раздела фаз не может быть обнаружена в световом микроскопе. Коллоидное состояние является предельно высокодисперсным состоянием вещества.
Дисперсная система состоит как минимум из двух веществ, которые совершенно или практически не смешиваются друг с другом и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Фазы можно отделить друг от друга физическим способом (центрифугировать, экстрагировать и т. д.).
Многообразие дисперсных систем обусловлено тем, что образующие их фазы могут находиться в любом из трех агрегатных состояний.
Многие свойства золей, в частности, их устойчивость обусловлены возникновением на поверхности частиц двойного электрического слоя.
73

ФИО студента _____________________________________ группа __________
Если соприкасающиеся фазы содержат заряженные частицы (электроны или ионы) или полярные молекулы, то на границе раздела фаз возникает двойной электрический слой.
Образование двойного электрического слоя может произойти путем ионной адсорбции. Рассмотрим конкретный пример: возьмем избыток AgNO3 и добавим его в раствор KBr. При этом протекает реакция ионного обмена:
AgNO3 + KBr → AgBr + KNO3.
Образующиеся в результате реакции агрегаты AgBr адсорбируют на своей поверхности те ионы, которые способны достраивать кристаллическую решетку AgBr (правило Панета – Фаянса). В данном случае ионы Br- взяты в недостатке, поэтому агрегат AgBr адсорбирует ионы Ag+. Ионы Ag+, сообщившие поверхности этот заряд называются потенциалопределяющими ионами (ПОИ), так как эти ионы определяют знак заряда коллоидной частицы. К положительно заряженной поверхности образовавшегося ядра мицеллы притягиваются ионы противоположного знака – противоионы (ионы NO3-). Часть этих ионов, составляющая адсорбционный слой, прочно удерживается у поверхности ядра за счет электростатических и адсорбционных сил. Ядро вместе с адсорбционным слоем составляет коллоидную частицу. В данном примере она заряжена положительно (так же, как ПОИ). Наличие заряда у коллоидных
частиц приводит к их отталкиванию и обеспечивает устойчивость золя.
Остальные противоионы связаны с ядром только электростатическими силами. Эти противоионы образуют диффузный слой. В результате образуется золь, структурная единица дисперсной фазы которого называется мицеллой. Мицелла электронейтральна.
Структуру мицеллы можно записать следующим образом:
Здесь m – число формульных единиц AgBr, образующих агрегат; n – число ПОИ; (n–x) – число противоионов адсорбционного слоя; х – число противоионов диффузного слоя; «х+» – заряд коллоидной частицы.
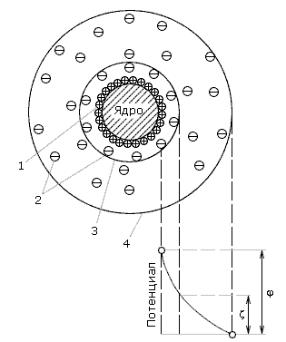
ПОИ создают вокруг ядра электрическое поле, которое по мере удаления от поверхности ядра ослабляется, так как заряд поверхности экранируется противоионами. Потенциал заряженной поверхности называют
термодинамическим потенциалом φ (рис. 7.2), его величина характеризует полный скачок потенциала между заряженной поверхностью и раствором. Противоионы адсорбционного слоя частично компенсируют заряд поверхности, поэтому потенциал электрического поля на границе адсорбционного и диффузного слоя меньше чем φ.
74
ФИО студента _____________________________________ группа __________
Противоионы диффузного слоя постепенно полностью компенсируют заряд поверхности, и на некотором расстоянии потенциал электрического поля, созданного ПОИ, становится равным нулю.
При движении мицелла разрывается на коллоидную частицу и противоионы диффузного слоя. Разрыв происходит по поверхности скольжения, которая расположена на границе адсорбционного и диффузного слоев. Потенциал на поверхности скольжения называется
электрокинетическим или ζ-потенциалом.
Рис. 7.2. – Падение потенциала в двойном электрическом слое: 1 – ПОИ; 2 – противоионы; 3 – адсорбционный слой противоионов;
4 – диффузный слой противоионов
Основные правила коагуляции электролитами:
1.Любые электролиты могут вызвать коагуляцию. Однако, заметное действие они оказывают при достижении определенной концентрации. Минимальная концентрация электролита, которая вызывает коагуляцию, называется порогом коагуляции – γ, ммоль/дм3.
2.Коагулирующим действием обладает лишь тот ион электролита, заряд которого противоположен заряду ПОИ, причем его коагулирующая способность VК = 1/γ тем сильнее, чем выше его заряд (правило Шульце – Гарди). Правило носит приближенный характер. Величины порогов коагуляции двухзарядных ионов примерно на порядок, а трехзарядных – на два порядка меньше порогов коагуляции однозарядных ионов.
75

ФИО студента _____________________________________ группа __________
Опыт №1. Изучение адсорбции уксусной кислоты на активированном угле в статических условиях
Величина адсорбции на твердых поверхностях измеряется по разности между начальной концентрацией вещества в растворе и концентрацией его при установлении адсорбционного равновесия – равновесной. Так как величина адсорбирующей поверхности обычно неизвестна, поэтому величину адсорбции относят к единице массы адсорбента.
С учетом сказанного, для определения констант в уравнениях Ленгмюра и Фрейндлиха выполните следующее:
1.В восемь конических колб отмерьте мерным цилиндром по 50 см3 раствора уксусной кислоты разных концентраций от 0,05 до 0,60 моль/дм3.
2.В каждую из них добавьте по 1 г активированного угля.
3.Для установления адсорбционного равновесия колбы периодически встряхивайте в течение 45-60 минут.
4.Отфильтруйте растворы в чистые колбы, используя фильтры.
5.Определите равновесную концентрацию кислоты. Для этого 10 см3 фильтрата каждой кислоты оттитруйте 0,1 н. раствором гидроксида натрия и по закону эквивалентов рассчитайте равновесную концентрацию уксусной кислоты:
С(СН3СООН)∙V(СН3СООН) = С(NaOH)∙Vщсред.(NaOH) 6. Результаты расчетов внесите в таблицу 7.1.
Таблица 7.1
Расчет равновесной концентрации уксусной кислоты
|
Исходная концентрация |
Расчет равновесной концентрации уксусной |
||||||
|
уксусной кислоты |
кислоты после адсорбции на активированном угле |
||||||
№ |
|
|
|
|
|
|
|
|
|
|
|
Объем щелочи, пошедший |
|
||||
|
С, |
C0, |
Vк, |
на титрование кислоты, см3 |
Сравн, |
|||
|
моль/дм3 |
моль/дм3 |
см3 |
V1щ |
V2щ |
V3щ |
Vщсред |
моль/дм3 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
1 |
0,05 |
|
10 |
|
|
|
|
|
2 |
0,10 |
|
10 |
|
|
|
|
|
3 |
0,15 |
|
10 |
|
|
|
|
|
4 |
0,20 |
|
10 |
|
|
|
|
|
5 |
0,30 |
|
10 |
|
|
|
|
|
6 |
0,40 |
|
10 |
|
|
|
|
|
7 |
0,50 |
|
10 |
|
|
|
|
|
8 |
0,60 |
|
10 |
|
|
|
|
|
7.По полученным данным рассчитайте величину адсорбции уксусной кислоты разной концентрации и значения lgC и lgГ для построения линейной формы уравнения Фрейндлиха, 1/С и 1/Г для построения линейной формы уравнения Ленгмюра (таблица 7.2).
76

ФИО студента _____________________________________ группа __________
Таблица 7.2 Расчет величины адсорбции и координат для построения
линейных форм уравнений Фрейндлиха и Ленгмюра
|
С0, |
Сравн, |
Г = |
0,05 (С0−Сравн) |
, |
Уравнение |
Уравнение |
||||
№ |
|
Фрейндлиха |
Ленгмюра |
||||||||
моль/дм3 |
моль/дм3 |
|
|
||||||||
|
|
моль/г |
lgC |
lgГ |
1 |
/С |
1 |
/Г |
|||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||
1 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
8.Постройте линейные формы уравнений Фрейндлиха и Ленгмюра и определите константы, входящие в данные уравнение Линейная форма уравнения Фрейндлиха
lgC
lgГ
Определение коэффициентов в уравнении Фрейндлиха
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
77

ФИО студента _____________________________________ группа __________
Линейная форма уравнения Ленгмюра
1/Г
1/С
Определение коэффициентов в уравнении Ленгмюра
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
9.Рассчитайте величины адсорбции по уравнению Фрейндлиха и Ленгмюра и постройте изотермы адсорбции в координатах Г = f(Сравн) по
экспериментальным данным и по уравнениям Фрейндлиха и Ленгмюра
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
78

ФИО студента _____________________________________ группа __________
Г
С
Сделайте вывод о том какое уравнение более точно описывает адсорбцию уксусной кислоты на активированном угле в статических условиях
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Опыт №2. Получение золя гидроксида железа (III) и определение его порога коагуляции
В коническую колбу объемом 250 см3 наливают 150 см3 дистиллированной воды и нагревают её до кипения на плитке. Не снимая колбы, плитку выключают, и небольшой струёй вливают в воду мерной пипеткой 5 см3 концентрированного хлорида железа (III). Получается золь гидроксида железа (III) интенсивного красно-коричневого цвета. Полученный золь охлаждают под краном до комнатной температуры, затем (при необходимости) фильтруют через увлажнённый складчатый фильтр. Золь должен казаться совершенно прозрачным в проходящем свете. Напишите уравнение протекающей реакции и строение мицеллы золя с указанием названия всех частиц и слоев:
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
79
ФИО студента _____________________________________ группа __________
Чтобы определить пороги коагуляции золей электролитами, готовят растворы электролитов с убывающей концентрацией. Для этого берут два ряда пробирок по шесть штук, заливают в определённую пробирку каждого ряда заданный объем воды, раствора электролита и золя (в соответствии с таблицей 7.3). Заполнение пробирок водой и золем производится из бюреток, а растворами электролитов – с помощью градуированных пипеток на 5 см3. После добавления золя содержимое пробирок перемешивают встряхиванием, записывают время начала опыта и оставляют на 30 минут.
Контрольный раствор готовят сливанием 5 см3 дистиллированной воды и 5 см3 золя. Коагуляцию отмечают, сопоставляя контрольную и исследуемую пробирку в проходящем свете. В таблице 7.3 отмечают наличие коагуляции знаком «плюс», отсутствие коагуляции – знаком «минус». Затем вычисляют порог коагуляции золя для каждого электролита-коагулятора, вызывающего коагуляцию 10 см3 золя:
Сп.к. = С•V•100 ммоль/дм3
где: Сп.к. – порог коагуляции золя заданным электролитом, ммоль/дм3; С – молярная концентрация раствора электролита, моль/дм3; V – минимальное число см3 электролита, достаточное для коагуляции 10 см3 золя; 100 – коэффициент пересчёта на 1 дм3 золя.
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Таблица №7.3 Коагуляция золя гидроксида железа (III) под влиянием электролитов
Ряд |
Коагулятор |
|
Сп.к., |
|
Номер пробирок |
|
|||
|
|
|
|
|
|
|
|
||
пробирок |
Электролит |
Ион |
ммоль/дм3 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
1 |
3,0M KCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
0,0005М K3[Fe(CN)6] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
дистиллированной воды |
|
|
0,0 |
1,0 |
2,0 |
3,0 |
4,0 |
4,5 |
Объем, |
|
|
|
|
|
|
|
|
|
раствора электролита |
|
|
5,0 |
4,0 |
3,0 |
2,0 |
1,0 |
0,5 |
|
см3 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
золя гидроксида железа (III) |
|
|
5,0 |
5,0 |
5,0 |
5,0 |
5,0 |
5,0 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
Опыт №3. Получение золя берлинской лазури и определение его порога коагуляции
В коническую колбу 250 см3 наливают 25 см3 дистиллированной воды и добавляют 0,2 см3 концентрированного раствора хлорида железа (III). Затем добавляют 2 см3 насыщенного раствора жёлтой кровяной соли K4[Fe(CN)6] и перемешивают. К образовавшемуся гелю берлинской лазури добавляют 150 см3 дистиллированной воды, встряхивают и (при необходимости) фильтруют через увлажненный складчатый фильтр. Золь должен казаться совершенно прозрачным в проходящем свете, иметь интенсивную синюю окраску. Напишите уравнение протекающей реакции и строение мицеллы золя с указанием названия всех частиц и слоев:
80
