- •Введение
- •1. Физические свойства и структура воды
- •Водородная связь
- •Влияние растворенных веществ на структуру воды
- •1.3. Ионизация воды
- •1.4. Ионное произведение воды; шкала рН
- •1.5. Гидрофобные взаимодействия
- •1.6. Состояние воды в тканях
- •1.7. Потребление и выделение воды
- •1.8. Регуляция водного обмена
- •2. Метаболизм макро- и микроэлементов в организме животных
- •2.1. Биологическая роль минеральных элементов
- •2.2. Поступление минеральных веществ в организм животного и выделение их
- •2.3. Метаболизм макроэлементов в организме животных Натрий
- •2.4. Метаболизм микроэлементов в организме животных
- •2.5. Регуляция обмена воды и минеральных веществ
- •Заключение
- •Оглавление
- •394087, Воронеж, ул. Мичурина, 1
1.4. Ионное произведение воды; шкала рН
Диссоциация воды представляет собой равновесный процесс:
Н20 Н++ ОН-.
Константа равновесия этого процесса равна
![]() ,
,
где в квадратных скобках указаны концентрации в молях на литр. Величина этой константы равновесия при любой заданной температуре может быть вычислена на основании данных по электропроводности чистой дистиллированной воды. Концентрация воды в чистой воде очень высока (она равна числу граммов Н20 в 1 л, деленному на ее молекулярный вес, т. е. 1000/18 = 55,5 М), а концентрация ионов Н+ и ОН- очень мала (1·10-7 М при 25 °С); столь слабая ионизация не может заметно изменить молярную концентрацию воды. Таким образом, выражение для константы равновесия может быть упрощено:
55,5·К еq = [Н+][ОН-]
и выражение 55,5·К еq может быть заменено на «обобщенную» константу Кw, называемую ионным произведением воды:
Кw = [Н+ ОН-].
Величина Кw при 25 °С равна 1,0·10-14. В кислом растворе концентрация ионов Н+ относительно велика, а концентрация ионов ОН- соответственно мала; в щелочном растворе имеет место обратная ситуация.
Величина Кw, или ионное произведение воды, служит основой для шкалы рН (табл.3).
Таблица 3
Шкала рН
Концентрация ионов Н+, М |
рН |
Концентрация ионов, ОН-, М |
1,0 |
0 |
10-14 |
0,1 |
1 |
10-13 |
0,01 |
2 |
10-12 |
0,001 |
3 |
10-11 |
0,0001 |
4 |
10-10 |
0,00001 |
5 |
10-9 |
10-6 |
6 |
10-8 |
10-7 |
7 |
10-7 |
10-8 |
8 |
10-6 |
10-9 |
9 |
10-5 |
10-10 |
10 |
10-4 |
10-11 |
11 |
0,001 |
10-12 |
12 |
0,01 |
10-13 |
13 |
0,1 |
10-14 |
14 |
1,0 |
Таблица 4
Величина рН некоторых жидкостей
Жидкость |
рН |
Морская вода |
7,0 – 7,5 |
Плазма крови |
7,4 |
Интерстициальная жидкость |
7,4 |
Внутриклеточная жидкость |
|
в мышце |
6,1 |
в печени |
6,9 |
Желудочный сок |
1,2 – 3,0 |
Сок поджелудочной железы |
7,8 – 8,0 |
Слюна |
6,35 – 6,85 |
Коровье молоко |
6,6 |
Моча |
5 – 8 |
Лимонный сок |
2,3 |
1.5. Гидрофобные взаимодействия
Вода способна также диспергировать многие соединения, содержащие неполярные, или гидрофобные, группы, причем образуются мицеллы молекулярных размеров при условии, что эти соединения содержат также сильно полярные группы. Этот тип «растворения» становится возможным вследствие образования водородных связей, возникающих не между молекулами растворенного вещества и молекулами растворителя, а только между молекулами растворителя. Соединения, содержащие как сильно гидрофобные, так и сильно полярные группы, называются амфипатическими.
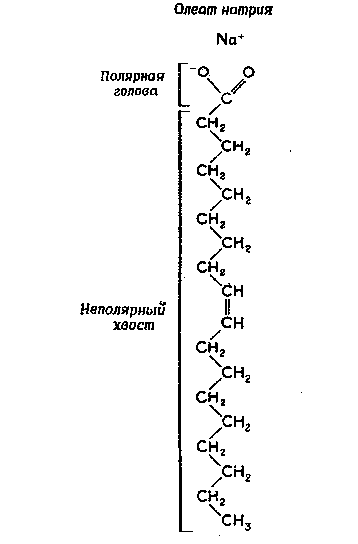
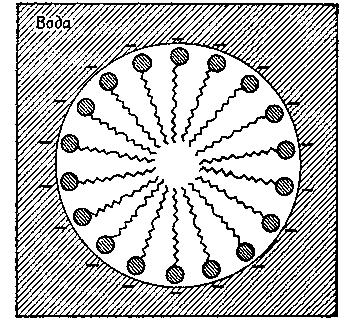
Самыми распространенными амфипатическими биомолекулами, склонными к образованию мицелл, являются жирные кислоты и полярные липиды. В качестве примера приведем олеиновую кислоту, которая представляет собой жирную кислоту с длинной цепью. Поскольку ее длинная углеводородная цепь не может раствориться в воде, олеат натрия (мыло) лишь в очень незначительной степени способен образовывать в воде истинные молекулярные растворы. Однако он легко диспергирует, образуя мицеллы, в которых отрицательно заряженные карбоксильные группы обращены к водной фазе, а неполярные, нерастворимые углеводородные цепи спрятаны внутри мицеллярной структуры (рис. 5). Такие мицеллы имеют суммарный отрицательный заряд и остаются суспендированными благодаря взаимному отталкиванию.
|
|
Рис.5. Мицелла олеата натрия |
|
Характерное расположение неполярных групп в молекулах, образующих мицеллы, обусловлено тенденцией молекул воды к достижению состояния максимальной неупорядоченности, или максимальной энтропии. В этом состоянии для воды характерно огромное число межмолекулярных взаимодействий за счет водородных связей. Для внедрения в воду какой-либо неполярной структуры, например углеводородной цепи, требуется затрата энергии, так как в этом случае окружающие молекулы воды оказываются вынужденными расположиться несколько более регулярно, чем в случае чистой воды, т.е. иметь меньшую энтропию. Иными словами, мицеллы образуются вследствие того, что молекулам воды больше «нравятся» другие молекулы воды, чем неполярные структуры.