- •Введение
- •1. Физические свойства и структура воды
- •Водородная связь
- •Влияние растворенных веществ на структуру воды
- •1.3. Ионизация воды
- •1.4. Ионное произведение воды; шкала рН
- •1.5. Гидрофобные взаимодействия
- •1.6. Состояние воды в тканях
- •1.7. Потребление и выделение воды
- •1.8. Регуляция водного обмена
- •2. Метаболизм макро- и микроэлементов в организме животных
- •2.1. Биологическая роль минеральных элементов
- •2.2. Поступление минеральных веществ в организм животного и выделение их
- •2.3. Метаболизм макроэлементов в организме животных Натрий
- •2.4. Метаболизм микроэлементов в организме животных
- •2.5. Регуляция обмена воды и минеральных веществ
- •Заключение
- •Оглавление
- •394087, Воронеж, ул. Мичурина, 1
1. Физические свойства и структура воды
По сравнению с другими жидкостями вода имеет необычно высокие температуры плавления и кипения, теплоту испарения, удельную теплоемкость, теплоту плавления, а также большое поверхностное натяжение. Эта особенность воды обусловлена тем, что силы притяжения между молекулами жидкой воды очень велики и соответственно велико их внутреннее сцепление.
Большая прочность связей между молекулами в жидкой воде обусловлена электрической полярностью молекул воды, которая, в свою очередь, есть результат специфического расположения электронов в атомах кислорода и водорода, составляющих молекулу воды.
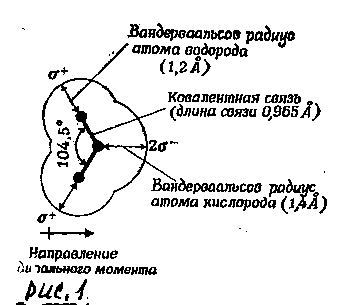
Характерное расположение электронов в молекуле воды придает электрическую асимметрию. Более электроотрицательный атом кислорода стремится притянуть электроны атомов водорода, оставляя водородные ядра обнаженными. В результате каждый из двух атомов водорода обладает частичным положительным зарядом (обозначаемым О+), а атом кислорода несет частичный отрицательный заряд (О-), локализованный в области необобществленных орбиталей.
Таким образом, молекула воды в целом хотя и не имеет суммарного заряда, представляет собой электрический диполь. Степень разделения положительного и отрицательного зарядов в полярных молекулах характеризуется диполъным моментом, мерой которого является способность молекулы ориентироваться в электрическом поле.
Водородная связь
Силы притяжения между молекулами воды определяются в основном полярной природой этих молекул, так как между частичным отрицательным зарядом атома кислорода одной молекулы воды и частичным положительным зарядом атома водорода соседней молекулы воды имеет место сильное электростатическое притяжение. Этот тип электростатического взаимодействия, включающий в себя незначительный ковалентный компонент, называют обычно водородной связью. Расположение электронов вокруг атома кислорода близко к тетраэдрическому, т. е. каждая молекула воды стремится cвязаться водородной связью с четырьмя соседними молекулами воды (рис.1).
|
Рис. 1. Водородная связь |
|
Рис. 2. Расположение водородных связей между молекулами воды во льду и пространственная решетка льда |