
- •ГЛАВА 1. ОБЩИЕ ПРИНЦИПЫ АНАЛИЗА
- •1.1. Предмет и задачи аналитической химии
- •1.2. Классификация и общая характеристика методов анализа
- •1.3. Аналитические реакции
- •1.4. Химические методы качественного анализа
- •Классификация катионов по кислотно-основному методу
- •ГЛАВА 2. ПРАКТИКА КАЧЕСТВЕННОГО АНАЛИЗА
- •Оформление лабораторных работ
- •2.1. Первая группа катионов
- •2.2. Вторая группа катионов
- •2.3. Третья группа катионов
- •2.4. Четвертая группа катионов
- •2.5. Пятая группа катионов
- •2.6. Шестая группа катионов
- •2.7. Анионы
- •2.8. Анализ солей
- •Библиографический список

19
|
|
|
|
|
Продолжение табл. 2.2 |
||||
1. |
2. |
3. |
|
|
|
4. |
|
|
|
|
K2Pb[Cu(NO2)6](Т) |
|
(NH4)2Pb[Cu(NO2)6](Т) |
||||||
Na2Pb[Cu(NO2)6] |
черный (кубические |
- |
черный (кубические кри- |
||||||
|
кристаллы) |
|
сталлы) |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
K[Sb(OH)6] |
- |
Na[Sb(OH)6](Т) |
HSbO3 (Т) |
|
|
|
|||
белый |
белый, аморфный |
||||||||
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
NaOH, KOH |
- |
- |
|
|
|
NH 3(г) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hg |
|
|
|
|
|
|
|
|
|
|
|
|
||
K2[HgJ4] + KOH |
- |
- |
|
O |
NH2 |
J (T) |
|||
|
|
Hg |
|
|
|
||||
|
|
|
|
|
|
|
|
||
|
|
|
красно-бурый аморфный |
||||||
|
|
|
|
|
|
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Чем отличается I аналитическая группа катионов от других групп кис- лотно-основной классификации?
2.Почему обнаружение катиона К+ гидротартратом натрия необходимо проводить в нейтральной среде?
3.Можно ли катион К+ осадить практически полностью винной кислотой?
4.Можно ли обнаружить катион К+ в присутствии катиона NH4+?
5.Можно ли обнаружить катион Na+ в присутствии катиона NH4+?
6.Какая из реакций обнаружения катиона NH4+ является специфической?
7.Почему при обнаружении катиона NH4+ щелочами необходимо нагревание и смачивание индикаторной бумаги?
8.Какие реактивы используют для обнаружения катиона К+?
2.2. Вторая группа катионов
Общая характеристика катионов II аналитической группы
Вторую аналитическую группу составляют катионы Ag+, Pb2+, Hg22+. Элементы, соответствующие этим катионам, находятся в разных группах периодической системы Д. И. Менделеева. Ag+ и Hg22+ - катионы d – эле-
ментов имеют электронную формулу внешнего энергетического уровня соответственно 4s24p24d10 (Ag+) и 5s25p65d10 (Hg+), т. е. устойчивый 18-
электронный внешний энергетический уровень. Pb2+ - катион p-элемента, электронная формула внешнего энергетического уровня 6s2, предыдущий 5-й уровень имеет 18 электронов.
Эти катионы образуют нерастворимые в воде хлориды, поэтому групповым реактивом II группы является хлороводородная кислота HCl. Рас-
20
творимость хлоридов различна. При стандартной температуре 298 К PAgCl =
1,3  10-5 моль/дм3, P = 4
10-5 моль/дм3, P = 4  10-2 моль/дм3, PHg2Cl2 = 6,9
10-2 моль/дм3, PHg2Cl2 = 6,9  10-7 моль/дм3.
10-7 моль/дм3.
Растворимость PbCl2 наибольшая. Она значительно увеличивается при повышении температуры и при 373 К достигает 1,2  10-1 моль/дм3. Это свойство хлорида свинца дает возможность отделять PbCl2 от AgCl и Hg2Cl2.
10-1 моль/дм3. Это свойство хлорида свинца дает возможность отделять PbCl2 от AgCl и Hg2Cl2.
Большая растворимость PbCl2 не позволяет практически полностью осадить катионы Pb2+ из раствора при действии HCl. Поэтому при анализе смеси катионов нескольких групп ион Pb2+ осаждается серной кислотой и частично попадает в III группу.
Большинство солей катионов II группы нерастворимы в воде. Растворимы лишь нитраты этих катионов и ацетаты серебра и свинца.
Катионы Ag+, Pb2+, Hg22+ бесцветны, поэтому большинство их соединений не окрашено. Однако поляризующее действие этих ионов и их способность поляризоваться приводит в ряде случаев к образованию окрашенных продуктов реакции из бесцветных ионов (PbS, PbJ2, Hg2J2, AgBr, AgJ и
др.).
Как и все катионы d-элементов Ag+ и Hg22+ при действии щелочей дают неустойчивые гидроксиды, которые разлагаются с образованием оксидов Ag2O и Hg2O. Катиону Pb2+ соответствует гидроксид Pb(OH)2, проявляющий амфотерные свойства, что используют для определения и растворения различных соединений свинца.
Катионы II группы подвергаются гидролизу, водные растворы этих солей имеют кислую реакцию. Эти катионы способны изменять степень окисления, вступая в окислительно-восстановительные реакции. Так, Pb2+ окисляется до Pb4+, а Hg22+ до Hg2+, Hg22+ восстанавливается до Hg.
Лабораторная работа
Действие группового реактива на катионы II группы
Групповой реактив – 2М раствор HCl – дает с катионами Ag+, Pb2+, Hg22+ осадки хлоридов белого цвета:
Ag+ + Cl- =AgCl (T) , Pb2+ + 2Cl- = PbCl2 (T) , Hg22+ + 2Cl- = Hg2Cl2 (T) .
Следует избегать использование концентрированной кислоты, так как могут образоваться растворимые комплексные соединения:
AgCl + 2HCl = H2 [AgCl3] , PbCl2 + HCl = H[PbCl3].
Реакции катиона серебра Ag+
1. HCl и растворимые хлориды осаждают ион серебра в виде белого аморфного осадка AgCl. Хлорид серебра чернеет на свету вследствие разложения и выделения металлического серебра. Осадок нерастворим в
21
сильных кислотах, но растворяется в избытке раствора аммиака с образованием бесцветного комплексного соединения хлорида диамминсеребра
[Ag(NH3)2]Cl:
AgCl (T) + 2NH3 = [Ag(NH3)2]Cl .
Этот комплекс разрушается под действием азотной кислоты с выделением осадка AgCl и при действии KJ с образованием желтого осадка AgJ.
[Ag(NH3)2]Cl + 2HNO3 = AgCl (T) + 2NH4NO3, [Ag(NH3)2]Cl + KJ + H2O = AgJ (T) + 2NH4OH + KCl.
2. Иодид калия KJ и бромид калия KBr образуют с катионом Ag+
желтый осадок иодида серебра AgJ и бледно-желтый осадок бромида сере-
бра AgBr:
AgNO3 + KJ = AgJ (T) + KNO3, AgNO3 + KBr = AgBr (T) + KNO3,
Осадки не растворимы в HNO3.
Осадок AgBr частично растворим, а AgJ практически нерастворим в растворе аммиака. Все галогениды серебра растворимы в тиосульфате натрия Na2S2O3 с образованием комплексного соединения тиосульфатоаргентат (I) натрия Na3[Ag(S2O3)2]:
AgJ + 2Na2S2O3 = Na3 [Ag(S2O3) 2] + NaJ.
Опыт. В две пробирки поместить по 2 – 3 капли раствора нитрата серебра и добавить в одну пробирку – 1-2 капли раствора KJ, в другую – раствора KBr. Наблюдать выпадение осадков. Проверить на растворимость в
NH4ОH и Na2S2O3.
3. Хромат калия K2CrO4 выделяет из растворов солей серебра кир- пично-красный осадок хромата серебра Ag2CrO4, растворимый в азотной кислоте и растворе аммиака, нерастворимый в уксусной кислоте:
2AgNO3 + K2CrO4 = Ag2CrO4 (T) + 2KNO3, Ag2CrO4 + HNO3 = 2AgNO3 + H2CrO4,
Ag2CrO4 + 4NH4OH = [Ag(NH3)2]2CrO4 + 2H2O.
Опыт. В две пробирки поместить по 2 – 3 капли AgNO3, добавить 1 – 2 капли K2CrO4. Проверить растворимость образующихся осадков в NH4OH
и HNO3.
Условия проведения реакции – нейтральная или слабокислая среда. Реакции мешают Pb2+, Ba2+, Hg22+ и другие ионы, взаимодействующие с
K2CrO4.
Реакции катиона свинца Pb2+
1. Иодид калия KJ образует с солями свинца осадок иодида свинца PbJ2 желтого цвета, растворимый в горячей воде, и выпадающий при охлаждении в виде золотистых чешуек (реакция «золотого дождя»). Осадок растворим в избытке реактива с образованием бесцветного комплексного тетраиодоплюмбат (II) - иона:
Pb(NO3)2 + 2KJ = PbJ2 (T) + 2KNO3,
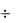
22
PbJ2 + 2KJ = K2[PbJ4],
PbJ2 + 2J- = [PbJ4]2-.
Опыт. К 1-2 каплям раствора Pb(NO3)2 прибавить 1-2 капли раствора КJ. К полученному осадку прибавить несколько капель воды, 2 М раствор CH3COOH и нагревать на водяной бане в течение 1–2 минут до растворения осадка. При резком охлаждении раствора под струей холодной воды наблюдать образование блестящих золотистых кристаллов.
Условия проведения реакции – слабокислая среда, рН = 3 5; реактив нельзя брать в избытке во избежание растворения осадка. Реакция является специфической на ион Pb2+.
2. Хромат калия K2CrO4 и дихромат калия K2Cr2O7 образуют с растворами солей свинца желтый осадок PbCrO4 :
Pb(NO3)2 + K2CrO4 = PbCrO4 (T) + 2KNO3,
Pb(NO3)2 + K2Cr2O7 + H2O = PbCrO4 (T) + 2HNO3 + 2KNO3.
Осадок растворим в минеральной кислоте и нерастворим в уксусной кислоте. При действии щелочи осадок растворяется с образованием плюм- бит-ионов:
PbCrO4 (T) + 4NaOH = Na2PbO2 + Na2CrO4 + 2H2O, PbCrO4 + 2OH- = PbO22- + 2H2O.
Опыт. В пробирку поместить 5-6 капель соли свинца и такой же объем раствора K2CrO4. Исследовать растворимость осадка в 2М растворах HCl,
CH3COOH и NaOH.
Условие проведения реакции - среда должна быть нейтральной или слабокислой. Реакции мешают ионы Ba2+, Hg2+, Ag+ и другие, образующие осадки с K2CrO4.
3.HCl и растворимые хлориды в кислой среде осаждают из раство-
ров солей свинца белый осадок PbCl2, растворимый в горячей воде, при охлаждении вновь выпадает в виде игл.
4.Гидроксиды КОН и NaOH образуют с катионом Pb2+ белый осадок, растворимый как в кислотах, так и в концентрированных растворах щелочей:
Pb(NO3)2 + 2NaOH = Pb(OH)2 (T) + 2NaNO3, Pb(OH)2 (T) + 2NaOH = Na2PbO2 + 2H2O.
5. H2SO4 и растворимые сульфаты осаждают катионы Pb2+ в виде белого осадка PbSO4, растворимого при нагревании в избытке щелочи:
PbSO4 (T) + 4 KOH = K2PbO2 + K2SO4 + 2H2O.
Реакции катиона диртути Hg22+
Растворы солей ртути (I) при диссоциации образуют сложные катионы диртути [Hg2]2+, в которых ртуть имеет степень окисления +1, так как два положительных заряда приходятся в этом ионе на два атома ртути. Все соли ртути ядовиты.
23
1. HCl и растворимые хлориды образуют с Hg22+ осадок хлорида дитути Hg2Cl2 белого цвета (каломель). Hg2Cl2 чернеет на свету вследствие разложения с выделением металлической ртути:
Hg2Cl2 = HgCl2 + Hg (T).
При взаимодействии с раствором аммиака Hg2Cl2 образует хлорид димеркураммония [Hg2NH2]Cl, который разлагается на [HgNH2]Cl и металлическую ртуть, вследствие чего осадок чернеет:
Hg2Cl2 (T) + 2NH3 = [Hg2NH2]Cl (T) + NH4Cl, [Hg2NH2]Cl (T) = [HgNH2]Cl (T) + Hg (T).
Эта реакция может быть использована в качестве дробной при обнаружении Hg22+ в смеси ионов.
Опыт. В пробирку поместить 3-4 капли соли Hg2(NO3)2, прибавить 2-3 капли 2М HCl. К образовавшемуся белому осадку Hg2Cl2 добавить несколько капель раствора аммиака до образования черного осадка.
2. Восстановители (SnCl2, Cu) легко восстанавливают ионы диртути (2+), образуя осадок черного цвета (элементная ртуть);
Hg2(NO3)2 + SnCl2 = Hg2Cl2 (T) + Sn(NO3)2, Hg2Cl2 + SnCl2 = 2Hg + SnCl4,
Hg(NO3)2 + Cu = Hg + Cu (NO3)2.
Опыт. К 3-4 каплям раствор соли Hg2(NO3)2 прилить столько же раствора SnCl2. Наблюдать постепенное почернение осадка.
Опыт. На медную пластинку нанести 1-2 капли раствора соли Hg2(NO3)2 и каплю раствора HNO3. Через 2-3 минуты раствор удалить, пластинку протереть кусочком фильтрованной бумаги. Наблюдать блестящий слой амальгамы.
3. Щелочи (NaOH, KOH) с ионами диртути (2+) образуют черный
осадок Hg2O:
Hg22+ + 2OH- = Hg2O (T) + H2O.
4. KJ осаждает из растворов солей диртути (2+) осадок Hg2J2 грязно-
зеленого цвета:
Hg22+ + 2J- = Hg2J2 (T).
Осадок растворим в избытке реактива с образованием тетраиодомеркурат (II) - иона и черного осадка металлической ртути:
Hg2J2 (T) + 2J- = [HgJ4]2- + Hg (T).
Опыт. В пробирку поместить 3-4 капли соли диртути (2+) прибавить 1 каплю раствора KJ, а затем его избыток. В начале наблюдают выпадение осадка грязно-зеленого цвета, затем – черного осадка Hg.
5. K2CrO4 осаждает кирпично-красный осадок Hg2CrO4, растворимый в
азотной кислоте:
Hg22+ + CrO42- = Hg2CrO4 (T).
Опыт. В пробирку налить 3-4 капли раствора соли диртути (2+), прибавить 1-2 капли раствора K2CrO4. Фиксировать цвет осадка и испытать его растворимость в растворе HNO3.
