
- •Введение
- •1. Спектральные и оптические методы анализа
- •1.1. Эмиссионный спектральный анализ. Фотометрия пламени
- •Контрольные вопросы
- •1.2. Молекулярно-абсорбционный анализ
- •Контрольные вопросы
- •1.3. Дифференциальная фотометрия
- •Контрольные вопросы
- •1.4. Фотометрическое титрование
- •Контрольные вопросы
- •1.5. Кинетический метод анализа
- •Контрольные вопросы
- •1.6. Фотометрия светорассеивающих систем
- •Контрольные вопросы
- •1.7. Люминесцентный анализ
- •Контрольные вопросы
- •1.8. Рефрактометрический метод анализа
- •Контрольные вопросы
- •1.9. Метрологические характеристики и статистическая обработка результатов анализа
- •2. Электрохимические методы анализа
- •2.1. Электрогравиметрия
- •Контрольные вопросы
- •2.2. Потенциометрия
- •Контрольные вопросы
- •2.3. Кондуктометрия
- •Контрольные вопросы
- •2.4. Полярографический анализ
- •Контрольные вопросы
- •2.5. Амперометрическое титрование
- •Контрольные вопросы
- •3. Хроматографические методы
- •3.1. Характеристика основных конструктивных узлов (блоков) хроматографа
- •3.2. Принцип работы газового хроматографа на примере chrom 5
- •3.3. Генератор водорода. Устройство и принцип работы
- •3.4. Методика выполнения работы Отбор пробы
- •Подготовка хроматографов к выполнению измерения
- •Выполнение измерений
- •Вычисление результатов анализа
- •3.5. Методы расчета хроматограмм
- •3.6. Методы расчета концентраций
- •Контрольные вопросы
- •4. Титриметрические методы анализа
- •Правила титрования
- •4.1. Кислотно-основное титрование в водном растворе
- •Контрольные вопросы
- •4.2. Осадительное титрование
- •Контрольные вопросы
- •4.3. Методы комплексообразования. Комплексонометрическое титрование
- •Контрольные вопросы
- •4.4. Окислительно-восстановительное титрование
- •Контрольные вопросы
- •Заключение
- •Библиографический список
- •Оглавление
- •394026 Воронеж, Московский просп., 14
2. Электрохимические методы анализа
|
2.1. Электрогравиметрия
Электрогравиметрия относится к старейшим электроаналитическим методам, широко используемым для определения ионов металлов. В настоящее время ее применяют прежде всего для электровыделения металлов из сложных смесей. Анализ основан на электролизе растворов, содержащих соли переходных металлов и осаждении высокочистых металлов на катоде.
В кулонометрических методах основой для прямого или косвенного количественного определения веществ является общее количество электричества Q, израсходованное на электролиз.
Количественные соотношения электролиза установлены Фарадеем (1827). Согласно его закону, масса прореагировавшего на электроде вещества пропорциональна затраченному количеству электричества:
m = k · Q = k · I · t,
где Q – количество электричества, Кл; k – электрохимический эквивалент, г/Кл; I – сила тока, А; t – продолжительность электролиза, с.
Электрохимический эквивалент рассчитывают из соотношения
k = М / n·F,
где М – молярная масса окислителя или восстановителя, n – число электронов, участвующих в полуреакции на данном электроде; F -постоянная Фарадея (96485 Кл/моль).
Принципиальная схема прибора для электровыделения приведена на рис. 12. Для улучшения методики используют потенциостат, позволяющий измерять потенциал катода относительно электрода сравнения. Процесс электролиза можно вести при контролируемом токе или контролируемом потенциале. В качестве катода используют платиновую сетку или фольгу. Металлы, образующий амальгамы можно осаждать на ртутных электродах.
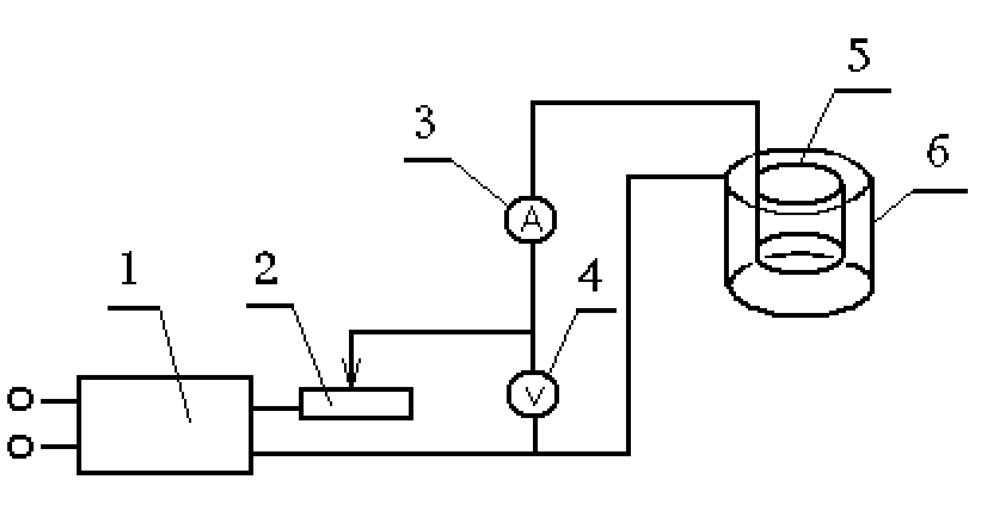
Рис. 12. Принципиальная схема прибора для электрогравиметрии: 2 – выпрямитель; 2 – реостат; 3 – амперметр; 4 – вольтметр; 5 – катод; 6 – анод
Электролиз с контролируемым током. В процессе электролиза химическая реакция протекает в направлении, противоположном самопроизвольному, при наложении на ячейку постоянного напряжения от внешнего источника. Ячейка состоит из двух электродов, контактирующих с раствором. Общее напряжение, наложенное на ячейку, распределяется следующим образом:
Еприл = Еа - Ек + i · R ,
где Еа – потенциал анода; Ек – потенциал катода; i – ток; R – сопротивление.
При электролизе водных растворов необходимо учитывать возможность окисления и восстановления молекул Н2О, условия устойчивости которой наглядно представляет диаграмма Пурбэ (рис. 13.).

Рис. 13. Диаграмма потенциал – рН для воды
Для процесса на катоде (платиновый электрод)
1 = – 0,059рН.
Этому уравнению на диаграмме соответствует линия (1). Для окисления воды на аноде – прямая (2)
2 = 1,23 – 0,059pH.
При значениях между линиями (1) и (2) вода устойчива.
Потенциал каждого электрода рассматривается как сумма равновесного потенциала обратимой реакции и перенапряжения. Равновесный потенциал зависит от стандартного потенциала электрохимической полуреакции, протекающей на электроде, и активностей соответствующих веществ у поверхности электрода.
Рассмотрим следующую обратимую полуреакцию:
Ox + nē RedТВ,
где Ox (окисленная форма) и Red (восстановленная форма).
Скорость электродной реакции зависит от приложенного потенциала, а соотношение концентраций Оx и Red можновыразить уравнением Нернста:

В процессе электролиза, т. е. в процессе осаждения металла, потенциал электрода падает при снижении концентрации COX катиона металла в растворе.
Полноту протекания электролиза можно предсказать, исходя из приложенного потенциала и уравнения Нернста. Если считать, что в начале концентрация Оx равна C0; Е0 – стандартный электродный потенциал, а х – доля Ох, восстановленного до Red, при потенциале электрода Е, то при равновесии число молей Ох составляет С0(1-х).

Например, при степени протекания электролиза 99,99 % (х = 0,9999) потенциал рабочего электрода становится на 236/n мВ отрицательнее, чем Е0. На основании приведенных расчетов можно найти теоретическую разность стандартных потенциалов, необходимую для определения одного иона в присутствии другого. Она составляет 240 мВ (25 С) для однозарядных ионов и 120 мВ для двухзарядных.
Электролиз с контролируемым потенциалом. В процессе электролиза при контролируемом потенциале катода, когда восстанавливается одно вещество, ток лимитируется конвекционной диффузией. Поэтому ток пропорционален концентрации восстанавливающихся частиц и, следовательно, экспоненциально убывает во времени:

где Ct – концентрация в момент времени t; C0 – концентрация до электролиза; It и I0 – соответствующие токи.
Коэффициент k зависит от площади катода, интенсивности перемешивания и объема раствора. Например, в одном из опытов для выделения меди рассчитана величина k = 0,15 мин-1. Отсюда можно рассчитать, что выделение 99 % меди заканчивается за 13 мин, а 99,9 % – за 20 мин. Типичная зависимость величины тока от времени приведена на рис. 14.

Рис. 14. Кривая “ток – время” для процесса выделения меди из анализируемого раствора
Выход по току. На практике масса образовавшегося или прореагировавшего на электроде вещества всегда меньше теоретически рассчитанной по закону Фарадея, поскольку неизбежны потери электричества, связанные с нагреванием электролизера и протеканием параллельных реакций. В практических расчетах вводят поправку, которая называется коэффициентом выхода по току
= mфакт/mтеор.
Таким образом,
m = k I t.
В электрогравиметрии не требуется, чтобы выход по току был равен 100 %, но в кулонометрическом анализе это обязательное условие.
Важным условием электрогравиметрического анализа является плотность тока. Для ее обоснования исследуют поляризационные кривые (зависимости потенциала электрода от плотности тока) для всех конкурирующих на электроде процессов. Выбираются условия селективного и полного выделения из раствора анализируемого металла при хорошем качестве получаемого на электроде осадка.
