
- •Часть 2
- •Лабораторная работа №1 Влияние температуры на состав газовой смеси в металлургических агрегатах для выплавки чугуна
- •1. Общие сведения
- •2. Методика измерения и аппаратура
- •3. Порядок выполнения работы
- •Лабораторная работа №2 Электропроводность шлаковых расплавов
- •1. Общие сведения
- •2. Методика измерения и аппаратура
- •3. Порядок выполнения работы
- •Лабораторная работа №3 Влияние раскисления и модифицирования стали на состав, форму и расположение неметаллических включений в отливках
- •1. Общие положения
- •2. Техника безопасности при выполнении работы
- •3. Порядок выполнения работы
- •4. Содержание и оформление отчета
- •Лабораторная работа №4 Влияние скорости охлаждения на структуру чугуна, методы контроля и оценки структуры
- •1. Общие сведения
- •2. Оборудование, инструмент и материалы
- •3. Порядок проведения работы
- •4. Результаты наблюдений и их обработка
- •5. Содержание отчета
- •Лабораторная работа № 5 Изготовление футеровки тигельной индукционной печи
- •3. Порядок выполнения работы
- •4. Содержание и оформление отчета о работе
- •Лабораторная работа №6 Плавка стали в открытой тигельной индукционной печи
- •1. Общие сведения
- •4. Содержание и оформление отчёта
- •Хронометраж плавки
- •Часть 2
- •394026 Воронеж, Московский просп.,14
ФГБОУ ВПО "Воронежский государственный технический университет"
Кафедра материаловедения и физики металлов
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к проведению лабораторных работ и выполнению самостоятельной работы по дисциплине
“Производство отливок из чугуна и стали”
для студентов специальности 150104 “Литейное производство
черных и цветных металлов” и направления 150400.62 «Металлургия», профиля «Технология литейных процессов»
очной формы обучения
Часть 2

Воронеж 2013
Составитель канд. техн. наук Л.С. Печенкина
УДК 621.74
Методические указания к проведению лабораторных работ и выполнению самостоятельной работы по дисциплине «Производство отливок из чугуна и стали» для студентов специальности 150104 «Литейное производство черных и цветных металлов» и направления 150400.62 «Металлургия», профиля «Технология литейных процессов» очной формы обучения. Ч. 2 / ФГБОУ ВПО "Воронежский государственный технический университет"; сост. Л.С. Печенкина. Воронеж, 2013. 73 c.
В методических указаниях приведены описания лабораторных работ, отражающих основные группы процессов, протекающих в металлургических агрегатах, при плавке чугуна и стали, раскислении, модифицировании. Приведены краткие теоретические сведения и контрольные вопросы; даны объем, порядок выполнения работ, указания по составлению отчетов.
Табл. 15. Ил. 14. Библиогр.: 7 назв.
Рецензент канд. физ.-мат. наук, доц. А.А. Лукин
Ответственный за выпуск зав. кафедрой д-р физ.-мат. наук, проф. А.Т. Косилов
Издаётся по решению редакционно-издательского совета Воронежского государственного технического университета
©ФГБОУ ВПО "Воронежский государственный
технический университет", 2013
Лабораторная работа №1 Влияние температуры на состав газовой смеси в металлургических агрегатах для выплавки чугуна
Цель работы. Для реакции газификации, протекающей в лабораторной трубчатой печи при постоянном давлении Р газовой смеси определить содержание в ней окиси углерода, выяснить влияние температуры на состав газовой смеси и сравнить его с равновесной.
1. Общие сведения
Во многих металлургических агрегатах, в том числе в доменной печи, при наличии твердого углерода и углекислого газа протекает реакция газификации
С(тв)+СО2(газ) 2СО(газ), (1)
Для которой
![]() 298
170 кДж/моль >0
298
170 кДж/моль >0
Реакция (1) представляет большой интерес для металлургии, т.к. она дает ценный продукт – окись углерода, являющуюся ценным топливом и эффективным реагентом – восстановителем металлов из окислов.
Двухкомпонентная двухфазная система (1) имеет 4 переменных параметра T, P, РСО2, РСО и в состоянии равновесия обладает степенями свободы, т.е является бивариантной . Поэтому должно существовать 2 уравнения, связывающие переменные параметры, определяющие состояния равновесия системы
Р=РСО2 +РСО, (2)
![]() =
Кр = (Т),
(3)
=
Кр = (Т),
(3)
где Р – общее давление газовой смеси; РСО2 и РСО – равновесные парциальные давления углекислого газа и окиси углерода; Кр – константа равновесия реакции (1).
Из соотношений (2) и (3) следует, что равновесный состав газовой смеси ( СО+СО2 ) является функцией температуры Т и общего давления Р, что вытекает из решения системы уравнений (2) – (3) при заданных значениях Т и Р:
РСО = –
![]() +
+
![]() ;
(4)
;
(4)
РСО2 = Р +
–
![]() .
(5)
.
(5)
Для точного расчета КР как функции Т можно воспользоваться следующими данными:
Н298=41080 кал (6)
СР, графит = 1,1+4,8·10-3Т-1,2·10-6Т2 , (7)
СР, СО2 =7,0+7,1·10-3Т-1,86·10-6Т2 , (8)
СР, СО =6,5·10-3Т. (9)
Тогда
Н=40034+4,9Т-4,95·10-3Т2+1,02·10-6Т3, (10)
G0=40034-4,9ТlnТ+4,95·10-3Т2-0,51·10-6Т3+I (11)
Константу интегрирования I вычисляют по абсолютным значениям энтропии
S0298=2S0co-S0co2-S0гр=42,11 кал/град.моль, (12)
откуда
G0298=Н0298-298S0298=28530 кал/моль. (13)
Подстановка этого значения G0 в уравнение (11) дает I,
После чего из соотношения
G0= – RTlnКР (14)
получаем зависимость КР от Т:
lgКР = –
![]() +
2,475 lgT – 1,082·10-3 Т+
+
2,475 lgT – 1,082·10-3 Т+
+0,111·10-6 Т2 + 2,67 . (15)
Упрощенный расчет приводит к более простому соотношению
lgКР = -
![]() +
9,11 . (16)
+
9,11 . (16)
В табл. 1 приведены значения lgКр реакции (1) для некоторых значений температуры. Из таблицы следует что в интервале температуры Т = 600 0С величина Кр может изменяться в миллионы раз.
Т.к. %СО2 + %СО = 100, то равновесный состав бинарной газовой смеси в системе (1) можно характеризовать процентным содержанием лишь одного газового компонента. Чаще всего равновесие характеризуют содержанием газа-продукта СО, которое дает представление о полноте протекания процесса.
Таблица 1
Константа равновесия реакции газификации как функция температуры
t, oC |
lgKp по уравнениям |
|
точному (15) |
приблизительному (16) |
|
400 500 600 700 800 900 1000 1100 |
-4,006 -2,259 -0,949 +0,115 +1,007 +1,702 +2,302 +2,773 |
-4,14 -2,44 -1,11 -0,07 +0,81 +1,51 +2,11 +2,63 |
Из соотношений (2) и (3) или (4) и (5) следует, что равновесный процент СО является функцией температуры и давления, что можно проиллюстрировать данными, приведенными в табл.2.
Таблица 2
Равновесный процент окиси углерода в системе (1) как функция температуры и давления
t,0C |
Р, ат. |
|
0,1 |
10 |
|
600 800 1000 |
59 98,9 99,95 |
8,5 57,1 95,4 |
Т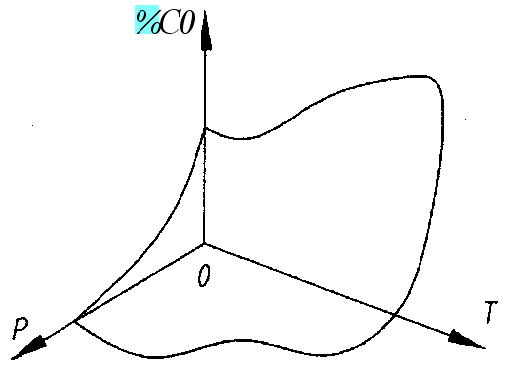 аким
образом, графическая интерпретация
равновесия (1) может быть представлена
в координатах РСО -Т - Р , и
совокупность равновесных значений % СО
в этой системе координат образует в
трехмерном пространстве поверхность
(рис.1).
аким
образом, графическая интерпретация
равновесия (1) может быть представлена
в координатах РСО -Т - Р , и
совокупность равновесных значений % СО
в этой системе координат образует в
трехмерном пространстве поверхность
(рис.1).
Рис. 1
Равновесный процент окиси углерода в системе С-СО2-СО как функция температуры Т и давления Р (аксонометрическая проекция)
Практически удобнее пользоваться двумерными графиками, которые представляют собой изобарические сечения поверхности % СО = (Т, Р).
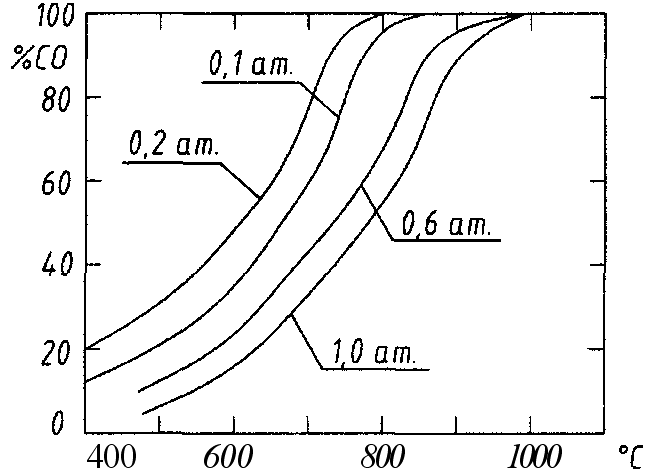
На рис. 2 представлены изобары реакции (1), а на рис. 3 -изотермы.
Каждая из кривых на рис.2 характеризует условия равновесного сосуществования реагентов, образующих рассматриваемую систему. Другими словами, если фигуративная точка,
Рис.2
изображающая состояние системы, располагается на кривой, то система находится в состоянии равновесия. При ином ее положении могут происходить процессы, приводящие систему в равновесное состояние.
Для определения направления этих процессов можно воспользоваться уравнением изотермы реакции (1)
G = RT ·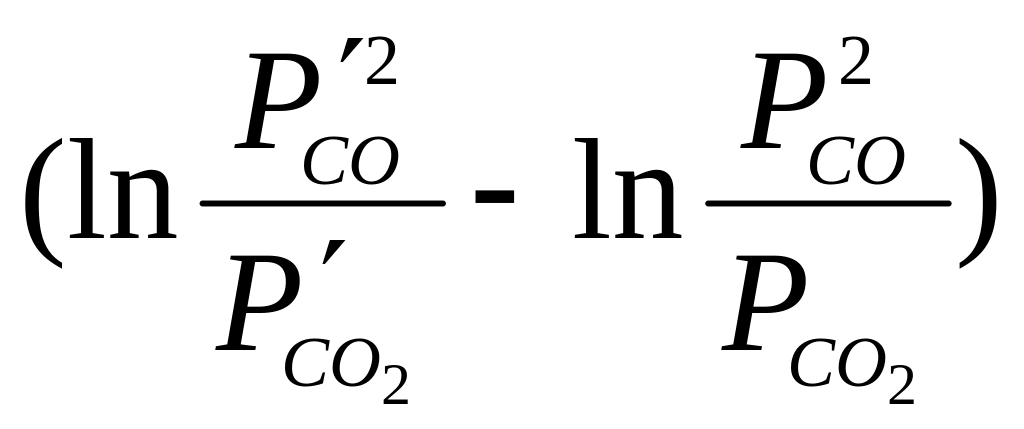 ,
(17)
,
(17)
где G – изменение свободной энергии Гиббса; Р/со2 и Р/со – неравновесные, а Рсо2 и Рсо – равновесные давления газообразных компонентов.
Если фигуративная точка расположена выше изобары, то Р/co > Рсо, а Р/со2 <Рсо2 и G > 0, то есть в системе возможен лишь распад окиси углерода. Следовательно, область, расположенная над изобарой, отвечает условиям устойчивого существования графита.
Переход в область, лежащую под изобарой, приводит к соотношению G<0, что открывает возможность газификации углерода.
Аналогичное рассуждение можно применить и к изотермам; выше этих линий идет распад СО, и графит термодинамически устойчив, а ниже – газификация углерода.

Рис. 3. Изотермы реакции С+СО2 = 2СО
В металлургических агрегатах, в том числе и в доменной печи, смесь СО и СО2, как правило не равновесна, и большой практический интерес представляет собой выяснение степени отклонения состава бинарной смеси от равновесного.
В данной лабораторной работе используется химический газоанализатор, однако в условиях современного производства используются газоанализаторы самых разных типов. Классифицировать эти приборы можно следующим образом:
1. Приборы, основанные на физических методах анализа, включающих вспомогательные химические реакции.
 При
помощи таких газоанализаторов, называемых
объёмно-манометрическими или
химическими, определяют изменение
объёма или давления газовой смеси в
результате химических реакций её
отдельных компонентов. Рис.
4. Хим. газоанализатор ГХ-100
При
помощи таких газоанализаторов, называемых
объёмно-манометрическими или
химическими, определяют изменение
объёма или давления газовой смеси в
результате химических реакций её
отдельных компонентов. Рис.
4. Хим. газоанализатор ГХ-100
2. Приборы, основанные на физических методах анализа, включающих вспомогательные физико-химические процессы.
Термохимические, основанные на измерении теплового эффекта реакции каталитического окисления (горения) газа, применяют главным образом для определения концентраций горючих газов (например, опасных концентраций окиси углерода в воздухе). Электрохимические позволяют определять концентрацию газа в смеси по значению электрической проводимости раствора, поглотившего этот газ. Фотоколориметрические, основанные на изменении цвета определённых веществ при их реакции с анализируемым компонентом газовой смеси, применяют главным образом для измерения микроконцентраций токсичных примесей в газовых смесях — сероводорода, окислов азота и др. Хроматографические наиболее широко используют для анализа смесей газообразных углеводородов.
3. Приборы, основанные на чисто физических методах анализа.
Термокондуктометрические, основанные на измерении теплопроводности газов, позволяют анализировать двухкомпонентные смеси (или многокомпонентные при условии изменения концентрации только одного компонента).
При помощи денсиметрических газоанализаторов, основанных на измерении плотности газовой смеси, определяют главным образом содержание углекислого газа, плотность которого в 1,5 раза превышает плотность чистого воздуха. Магнитные газоанализаторы применяют главным образом для определения концентрации кислорода, обладающего большой магнитной восприимчивостью. Оптические газоанализаторы основаны на измерении оптической плотности, спектров поглощения или спектров испускания газовой смеси. При помощи ультрафиолетовых газоанализаторов определяют содержание в газовых смесях галогенов, паров ртути, некоторых органических соединений.
Все приборы газового анализа также могут быть классифицированы:
по функциональным возможностям (индикаторы, течеискатели, сигнализаторы, газоанализаторы
по конструктивному исполнению (стационарные, переносные, портативные);
по количеству измеряемых компонентов (однокомпонентные и многокомпонентные);
по количеству каналов измерения (одноканальные и многоканальные);
по назначению (для обеспечения безопасности работ, для контроля технологических процессов, для контроля промышленных выбросов, для контроля выхлопных газов автомобилей, для экологического контроля).
Однако приобретение предприятием газоанализатора зависит от условий производства, целей и задач использования газоанализаторов в этих условиях, а так же экономической целесообразности.
