- •Растворы
- •100 г раствора – 4 г NaBr 1000г раствора – 40 г
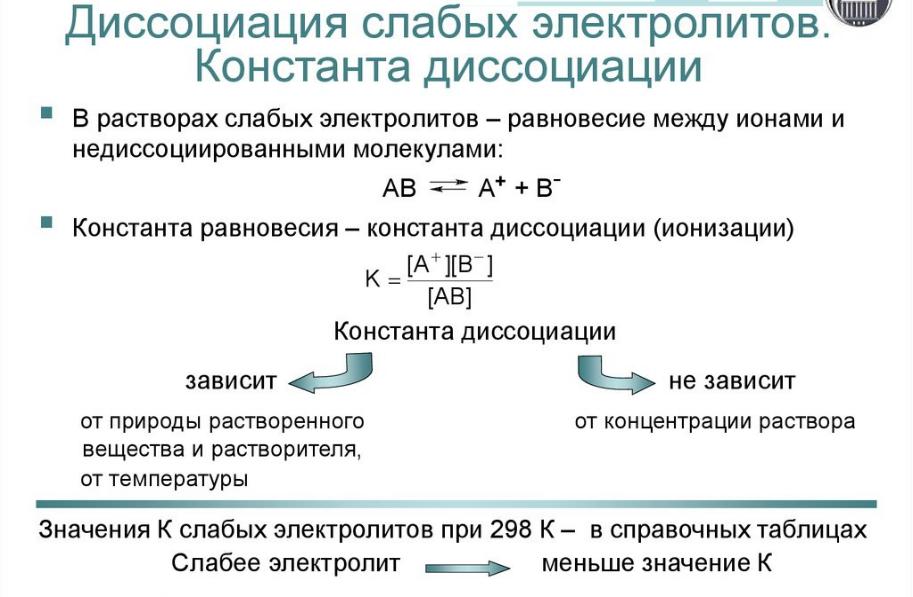
- •Молярная концентрация эквивалента.
- •Количество вещества эквивалента равно отношению массы вещества Х к молярной массе эквивалента этого
- •Рассчитать мольные доли глюкозы С6H12O6 и воды в растворе с массовой долей глюкозы
- •.Расcчитать молярность и моляльность 15-% раствора серной кислоты (плотность 1,1 г/см3)
- •Задание
- •Растворы электролитов и неэлектролитов
- •Вещества
- •Почему растворы электролитов проводят электрический ток?
- •Строение молекулы воды
- •Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде
- •Последовательность процессов, происходящих при электролитической диссоциации:
- •Уравнения диссоциации
- •Электролиты
- •Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд),
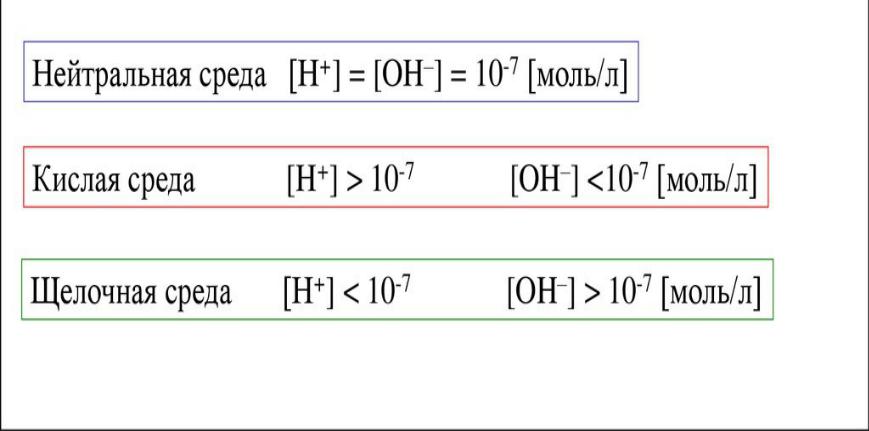
- •Водородный показатель, рН среды, кислотность среды
- •Индикаторы
- •Принцип
- •Среди физиологических жидкостей организма наиболее кислым является желудочный сок, фактически он представляет собой
Последовательность процессов, происходящих при электролитической диссоциации:
 Ориентация молекул – диполей воды около ионов;
Ориентация молекул – диполей воды около ионов;
 Гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла;
Гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла;
 Диссоциация (распад) кристалла электролита на гидратированные ионы
Диссоциация (распад) кристалла электролита на гидратированные ионы

Уравнения диссоциации
NaCl = Na+ + Cl-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
AlCl3 = Al3++ 3Cl-
Na3PO4 = 3Na+ + PO43-
Sr(OH)2 = Sr2+ + 2OH-

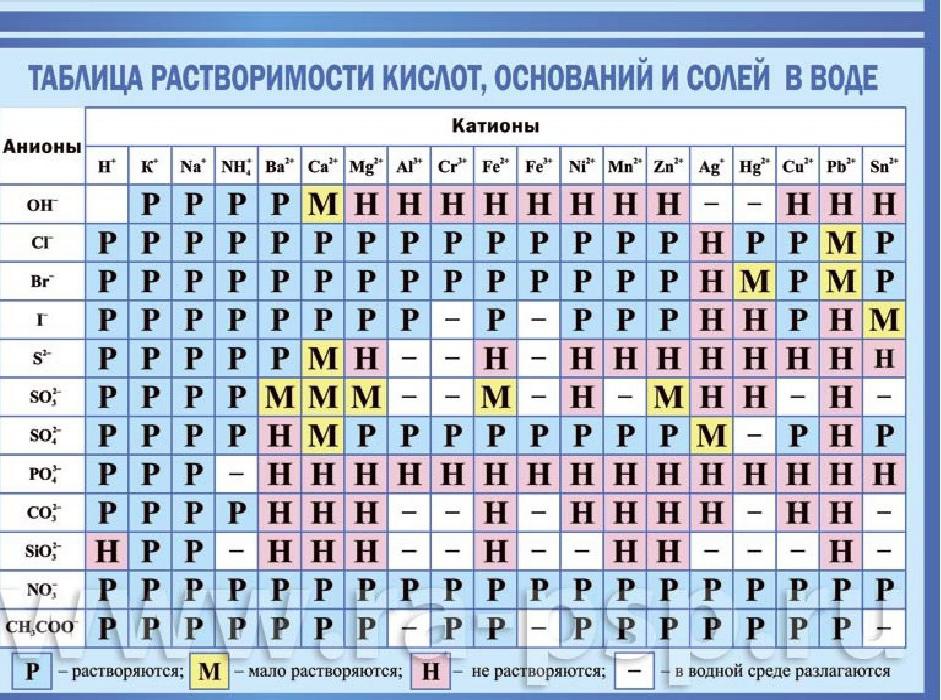
Электролиты
Сильные  все растворимые соли;
все растворимые соли;  сильные кислоты
сильные кислоты
H2SO4, H2SeO4, H2TeO4, HCl, HBr, HI, HNO3, HMnO4,
HReO4, HClO4  все щелочи
все щелочи
NaOH, KOH, LiOH, CsOH и растворившаяся часть малорастворимых оснований группы IIА – Вa(OH)2, Ca(OH)2, Sr(OH)2
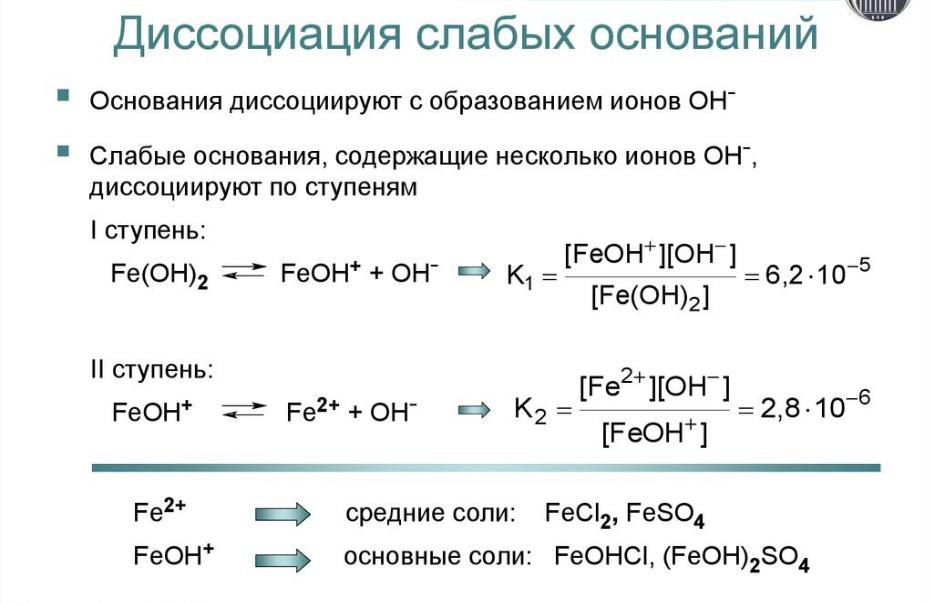
Слабые
 слабые кислоты
слабые кислоты
H2S, H2CO3, HNO2, HF, H3PO4 и т.д.
 водный раствор аммиакаNH3*H2O (NH4OH = NH4+ + OH-)
водный раствор аммиакаNH3*H2O (NH4OH = NH4+ + OH-)
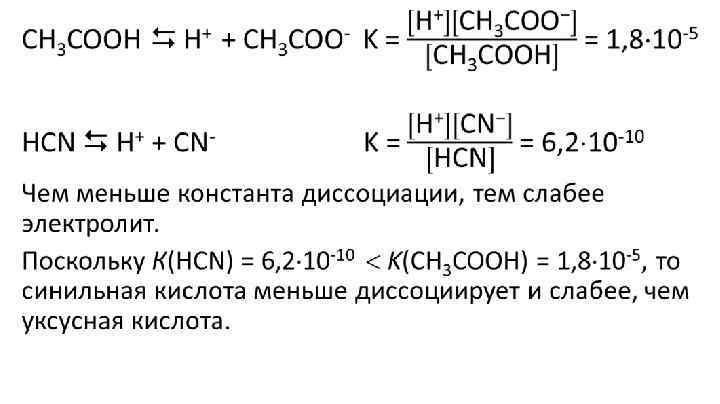
 органические вещества, например CH3COOH = CH3COO- + H+
органические вещества, например CH3COOH = CH3COO- + H+


Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд),
к общему числу растворенных частиц (Nр)
Nд
ά =
Nр
ά – степень диссоциации
Nд - число частиц, распавшихся на ионы Nр - общее число растворенных частиц