
- •Глава 1.1 Предмет курса. Основные понятия. Классификация дисперсных систем. Методы получения дисперсных систем
- •Глава 1.2 Молекулярно-кинетические свойства дисперсных систем
- •Тема 1.2.1.Броуновское движение
- •Тема 1.2.2. Диффузия
- •Тема 1.2.3. Осмотическое давление
- •Глава 1.3 Оптические свойства и методы исследования дисперсных систем
- •Тема 2.1.1. Термодинамическая характеристика дисперсных систем. Термодинамический метод избыточных величин Гиббса и метод «слоя конечной толщины
- •Тема 2.1.2. Поверхностное натяжение. Методы измерения поверхностного натяжения. Зависимость поверхностного натяжения от температуры и концентрации. Уравнение Шишковского
- •Тема 2.1.3. Уравнение Гиббса-Гельмгольца для поверхностной энергии. Полная поверхностная энергия
- •Глава 2.2 Адсорбция
- •Тема 2.2.2. Фундаментальное уравнение Гиббса. Определение Гиббсовской адсорбции.
- •Тема 2.2.3. Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. Пав. Эффект Ребиндера. Правило Дюкло-Траубе
- •Глава 2.3 Адсорбционные равновесия
- •Тема 2.3.3. Адсорбция на границе «твердое тело – жидкость». Молекулярная адсорбция. Правило выравнивания полярностей Ребиндера
- •Глава 2.4 Адгезия. Когезия. Смачивание и растекание жидкости
- •Тема 2.4.1. Понятие когезии и адгезии. Смачивание и растекание. Работа адгезии и когезии. Уравнение Дюпре. Краевой угол смачивания. Закон Юнга. Гидрофобные и гидрофильные поверхности
- •Тема 2.4.2. Коэффициент растекания по Гаркинсу. Условие растекания и смачивания. Эффект Марангони. Правило Антонова
- •Глава 2.5 Адсорбция ионов на кристалле. Электрокинетические явления
- •Тема 2.5.1. Образование и строение дэс. Электрокинетический потенциал. Правила написания мицелл
- •Тема 2.5.2. Обменная адсорбция. Иониты. Уравнение Никольского
- •Тема 2.5.3. Электрокинетические явления. Электрофорез. Электроосмос. Расчет -потенциала по скорости электрофореза и электроосмоса. Понятие поверхностной проводимости
- •Электроосмос - направленное перемещение жидкости в пористом теле под действием приложенной разности потенциалов (рис. 2.5.3.6).
- •Глава 3.1 Стабилизация и коагуляция дисперсных систем
- •Тема 3.1.1. Виды устойчивости дисперсных систем. Лиофобные и лиофильные золи
- •Правила коагуляции:
- •Тема 3.1.3. Теория длфо
- •Тема 3.1.4. Виды коагуляции: концентрационная и нейтрализационная. Коагуляция смесями электролитов. Явление «неправильные ряды». Механизм и кинетика коагуляции
- •При коагуляции смесью электролитов различают два типа процессов:
- •Тема 3.1.5. Седиментация и диффузия. Гипсометрический закон. Седиментационно-диффузионное равновесие. Скорость седиментации
Раздел 1. |
СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ |
Глава 1.1 Предмет курса. Основные понятия. Классификация дисперсных систем. Методы получения дисперсных систем
Предмет курса «Поверхностные явления в дисперсных системах» (коллоидной химии) - изучение дисперсных систем и явлений, происходящих на поверхности раздела фаз.
Д исперсной
называют систему, в которой одно вещество
распределено в среде другого, причем
между частицами и дисперсионной средой
есть граница раздела фаз. Дисперсные
системы состоят из дисперсной фазы и
дисперсионной среды (рис. 1.1.1.1).
исперсной
называют систему, в которой одно вещество
распределено в среде другого, причем
между частицами и дисперсионной средой
есть граница раздела фаз. Дисперсные
системы состоят из дисперсной фазы и
дисперсионной среды (рис. 1.1.1.1).
Дисперсная фаза - это частицы, распределенные в среде. Ее признаки: дисперсность и прерывистость.
Д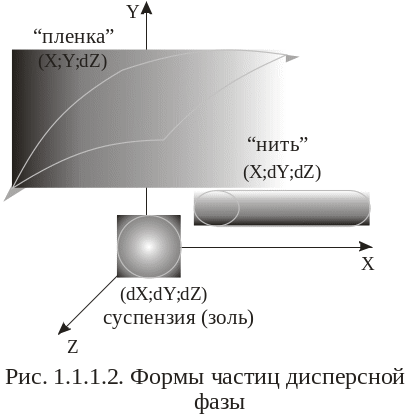 исперсионная
среда -
материальная среда, в которой находится
дисперсная фаза. Ее признак - непрерывность.
исперсионная
среда -
материальная среда, в которой находится
дисперсная фаза. Ее признак - непрерывность.
Поверхность раздела фаз характеризуется раздробленностью и гетерогенностью. Раздробленность характеризуется:
1) минимальным размером частицы a, [см; м] по трем осям. В зависимости от размеров частиц они имеют свои исторические названия (рис. 1.1.1.2); а также приведенным (эквивалентным, эффективным) радиусом - радиусом воображаемых идеально сферических частиц, обладающих той же массой и оседающих с той же скоростью, что и частицы дисперсной системы.
2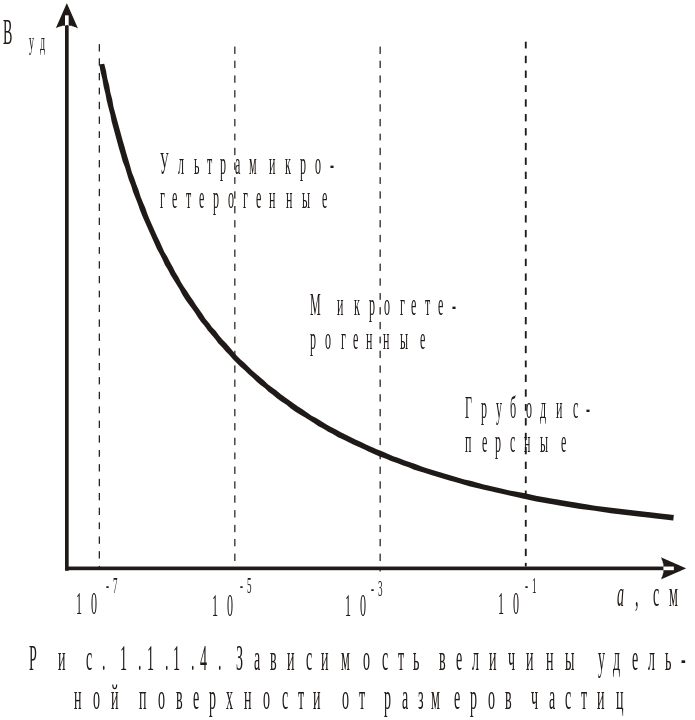 )
степенью дисперсности
)
степенью дисперсности
![]() ,
[см-1;
м-1]
,
[см-1;
м-1]
где В - суммарная межфазная поверхность или поверхность всех частиц дисперсной фазы;
V - объем частиц дисперсной фазы.
3) дисперсностью - величиной, обратной минимальному размеру а:
![]() [
[![]() ;
;![]() ];
];
4)удельной поверхностью
![]() ,
[м2/кг;
см2/г];
,
[м2/кг;
см2/г];
![]()
где m - масса частиц дисперсной фазы.
4)
кривизной
поверхности
![]() .
.
Для
частицы неправильной формы ![]() ,
,
где r1 и r2 - радиусы окружностей при прохождении через поверхность и нормаль к ней в данной точке двух перпендикулярных плоскостей.
Классификация дисперсных систем осуществляется по нескольким признакам (рис. 1.1.1.3).

По дисперсности различают:
а) грубодисперсные системы, для них D < 103 [1/см] (рис. 1.1.1.3);
б) микрогетерогенные системы, для них D = 103 - 105 [1/см];
в) ультрамикрогетерогенные системы, для них D = 105 - 107 [1/см].
По агрегатному состоянию дисперсной фазы и дисперсионной среды. Эта классификация была предложена Оствальдом (см. табл. 1.1.1.1).
По структуре дисперсные системы различают:
свободные дисперсные системы, когда частицы обеих составляющих системы могут свободно перемещаться друг относительно друга (золь);
связанные дисперсные системы, когда одна из составляющих системы представляет собой структурированную систему, т.е. частицы фазы жестко связаны между собой (студень, композиты).
Таблица 1.1.1.1
Классификация по агрегатному состоянию фаз
Агрегатное состояние дисперсной фазы |
Агрегатное состояние дисперсион-ной среды |
Условное обозначе-ние фаза/среда |
Название системы |
Примеры |
г |
г |
г/г ж/г тв/г |
Аэрозоли |
атмосфера Земли |
ж |
г |
туман, слоистые облака |
||
тв |
г |
дымы, пыли, перистые облака |
||
г |
ж |
г/ж |
Газовые эму-льсии, пены |
газированная вода, мыльная и пивная пены |
ж |
ж |
ж/ж |
Эмульсии |
молоко, масло сливочное, кремы и т.д. |
тв |
ж |
тв/ж |
Лиозоли, суспензии |
лиофобные коллоидные растворы, суспензии, пасты, краски и т.д. |
г |
тв |
г/тв |
Твердые пены |
пемза, пенопласт, активированный уголь, хлеб, пенобетон и т.д. |
ж |
тв |
ж/тв |
Твердые эмульсии |
вода в парафине, минералы с жидкими включениями, пористые тела в жидкости |
тв |
тв |
тв/тв |
Твердые золи |
сталь, чугун, цветные стекла, драгоценные камни |
По межфазному взаимодействию - лиофильные и лиофобные системы (предложено Г. Фрейндлихом). Классификация пригодна только для систем с жидкой дисперсионной средой.
Лиофильные системы – в них дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться – растворы коллоидных ПАВ, растворы ВМС. Эта группа характеризуется малым значением поверхностного натяжения на границе раздела фаз.
Лиофобные системы – в них дисперсная фаза не способна взаимодействовать с дисперсионной средой и растворяться в ней.
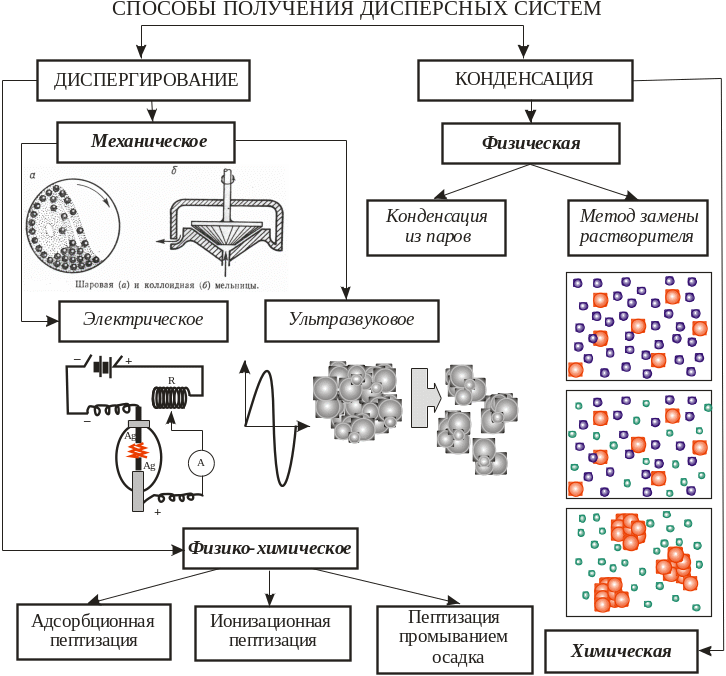
Способы диспергирования заключаются в раздроблении тела до частиц дисперсных размеров.
Дробление осуществляется в шаровых и коллоидных мельницах. Более высокой дисперсности достигают ультразвуковым диспергированием, действие которого связано с кавитацией – образованием и закрытием полостей в жидкости, вызывающих ударные волны и разрушающих материал.
Для получения диспергированием гидрозолей металлов используют метод Бредига – образование вольтовой дуги между электродами из диспергируемого металла, помещенными в воду. Органозоли различных металлов получают более общим способом Сведберга, используя колебательный заряд высокого напряжения.
Физико-химическое дробление (пептизация) представляет собой распад материала на более мелкие агрегаты под влиянием дисперсионной среды с образованием на частицах двойного электрического слоя.
Способы конденсации заключаются в укрупнении частиц, атомов, молекул до частиц дисперсных размеров (химическая реакция с образованием осадка).
Физическая конденсация из паров наблюдается при изменеии параметров системы (температуры, давления и пр.), возникает новая фаза, система становится гетерогенной.
Физическая конденсация методом замены растворителя осуществляется при условии, когда изменение параметров системы вызывает превышение химического потенциала компонента в дисперсионной среде над равновесным химическим потенциалом, что приводит к образованию в системе новой фазы. В отличие от конденсации из паров, в данном методе используется изменение дисперсионной среды. В насыщенный истинный раствор вещества добавляют растворитель, в котором это вещество нерастворимо. Образуется пересыщенный раствор вещества в двух растворителях, где вещество агрегируется с образованием частиц новой дисперсной фазы.
При химической конденсации вещество новой фазы образуется в результате химической реакции. Образование новой фазы протекает в две стадии:
образование зародышей частиц со скоростью v1;
рост зародышей со скоростью v2.
Каждая из стадий включает два процесса:
возникновение центров кристаллизации сз
![]()
где ![]() – работа образования зародышей;
– работа образования зародышей;
B – константа;
R – универсальная газовая постоянная;
T – температура, К.
доставка вещества в центр кристаллизации со скоростью u
![]()
где Е – энергия активации процесса транспорта;
С – константа.
Общая скорость образования центров конденсации (зародышей) v1
![]() ,
,
где k1 – константа.
Линейная скорость роста зародышей v2
![]() ,
,
где L – энергия активации;
C, D – некоторые постоянные;
![]() - межфазное натяжение на границах
двумерного зародыша. [1]
- межфазное натяжение на границах
двумерного зародыша. [1]
