- •Лекции «Молекулярная Фотоника»
- •1. Свойства света
- •Единицы
- •2. Количественная мера поглощения света
- •Прозрачка 1
- •Поглощение света (теория) Молекулярная система
- •Типы орбиталей в молекулах
- •Образование молекулярных орбиталей формальдегида
- •Прозрачка 12 Форма молекулярных орбиталей формальдегида
- •Сокращенное обозначение электронной конфигурации. Этилен.
- •Формальдегид
- •Электронно-колебательный спектр поглощения
- •Прозрачка 18
Прозрачка 1









 Iпад
образец
Iпад
образец

отверстие
Iотр

ФЭУ
Iпогл = Iпад - Iотр
Закон Б-Л-Б не применим, т.к. неизвестна толщина поглощающего слоя.
Уравнение Кубелко-Мунке
Поглощение света (теория) Молекулярная система
Молекула подобно атому может находиться в различных энергетических состояниях Е1, Е2, Е3 и т.д. Устойчивое состояние соответствует минимальной энергии, Е1. Переход из состояния с Е1 в состояния с Е2, Е3 и т.д. происходит при подводе энергии Е. Состояния с Е2, Е3 и т.д. являются возбужденными и неустойчивыми.
Молекулы обладает энергией, которая включает в себя энергию ядер (ядерная энергия), электронов (электронная энергия), колебаний ядер (колебательная энергия), вращения молекулы (вращательная энергия) и энергию поступательного движения (кинетическая энергия – не квантуется). В результате подвода к молекуле энергии в виде, например, кванта УФ-света энергия молекулы возрастает на Е. При этом вообще говоря возрастает электронная, колебательная и вращательная энергии на соответствующие величины Еэлект и т.п.
Е = Еэлект + Екол + Евращ
Если молекула может находиться в определенных энергетических состояниях Е1, Е2 и т.п., то условием поглощения света является
Е2 - Е1 = h = h co/
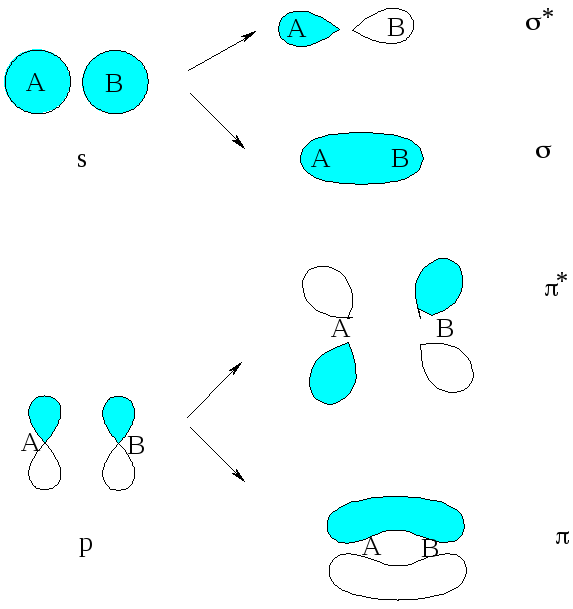
Если известны значения Е1, Е2 и т.п., то можно рассчитать и . Значения электронной энергии молекулы определяется значением энергии электронов. Как рассчитать энергию электронов? Уравнение Шредингера. Волновая функция (МО). Одноэлектронная (Хюккель) МО. МО = ЛКАО
Связывающие и разрыхляющие МО.
связ = a а + b b
разр = a а - b b
где а и b - АО электронов, участвующих в образовании связи.
Е(связ) < (E( а) + E( b)); Е(разр) > (E( а) + E( b))

Из s АО получают МО (связ и *разр), а из р АО получают МО (связ и *разр).
 *разр
*разр
АО(s) + AO (s)
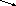 связ
связ
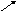 *разр
*разр
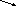 АО (р) + АО (р)
АО (р) + АО (р)
связ
Типы орбиталей в молекулах
АО - часто расположенная глубоко по энергии и не принимающая
участие в образовании хим. связи
МО связ ( , ) - получается из р и s АО
МО разр (*, *)
Не связывающая орбиталь (n) - получается из p AO; расположена высоко по энергии, не принимает участие в образовании хим. связи из-за плохого перекрытия орбиталей.
Форма орбиталей в молекулах
 n
n
Расположение орбиталей по энергии и
заполнение орбиталей электронами (принцип Паули)
Е
СМО
МО
разр
(*,
*)
 НСМО
НСМО
0


 АО (n)
АО (n)
ВЗМО

 ЗМО
МО
связ
(,
)
ЗМО
МО
связ
(,
)

 AО
AО
Электронная конфигурация основного состояния молекулы
этилена
H ( 1s1 ) (одна s- орбиталь)
C ( 1s2, 2s1, 2p3 ) sp2 -гибридизация (одна р- и три гибридизо-
ванных орбитали)
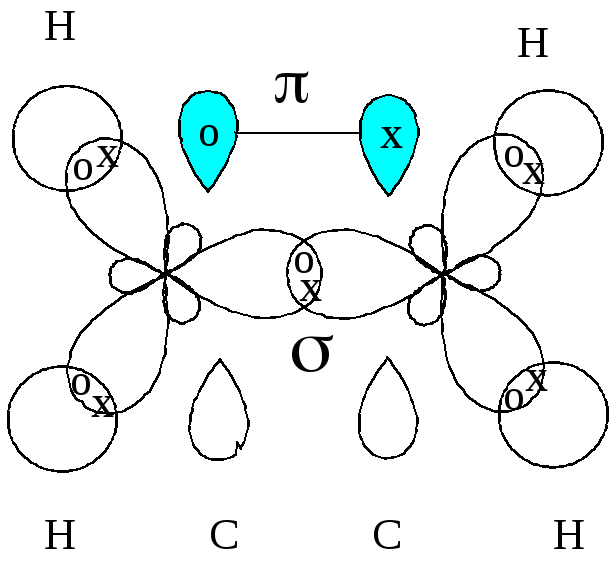
(1sc)2, (1sс’)2, (CH)2, (’CH)2, (’’CH)2, (’’’CH)2, (CС)2, (CС)2, (*CС)0, (*CС)0, (*CH)0, (*’CH)0, (*’’CH)0, (*’’’CH)0
Электронная конфигурация основного состояния молекулы
формальдегида
H ( 1s1 ) (одна s- орбиталь)
C ( 1s2, 2s1, 2p3 ) sp2 -гибридизация (одна р- и три гибридизо-
ванных орбитали)
рх ру рz
O ( 1s2, 2s2, 2p4 ) (одна s- и три р-орбитали)
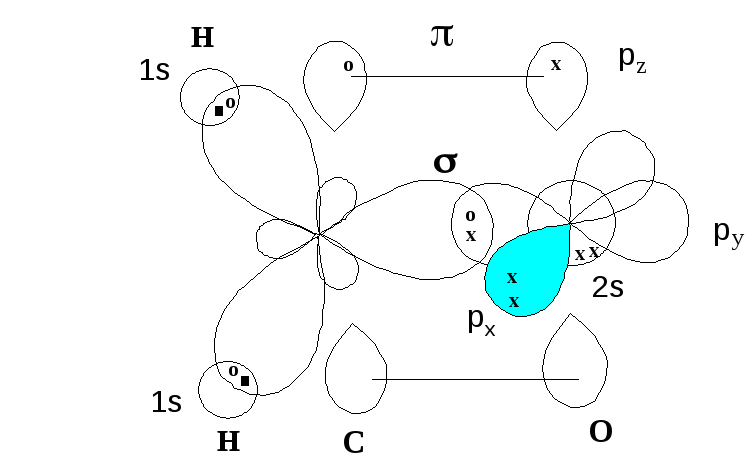
(1sc)2, (1so)2, (2so)2, (CH)2, (’CH)2, (CO)2, (CO)2,(nO)2,
(*CO)0, (*CO)0, (*CH)0, (’*CH)0