
- •«Дальневосточный федеральный университет»
- •Оглавление
- •Аннотация учебно-методического комплекса дисциплины «Химия»
- •«Дальневосточный федеральный университет»
- •Школа естественных наук двфу
- •Рабочая программа учебной дисциплины (рпуд)
- •180100.62 – Кораблестроение, океанотехника и системотехника объектов морской инфраструктуры Форма подготовки (очная)
- •Оборотная сторона титульного листа рпуд
- •Введение
- •1. Цели освоения дисциплины
- •2. Место дисциплины в структуре ооп бакалавриата
- •3. Начальные требования к освоению дисциплины
- •3А. Компетенции обучающегося, формируемые в результате освоения дисциплины
- •4. Структура и содержание дисциплины
- •Краткое содержание лекционного курса
- •1. Строение вещества
- •2. Химическая термодинамика, энергетика процесса, кинетика и химическое равновесие
- •3. Жидкие системы – растворы
- •4. Окислительно-восстановительные процессы
- •5. Конструкционные материалы
- •5. Образовательные технологии
- •Самостоятельной работы студента (срс)
- •6. Учебно-методическое и информационное обеспечение дисциплины
- •1. Основная литература:
- •2. Дополнительная литература:
- •3. Справочная литература:
- •7. Материально-техническое обеспечение и электронные средства обучения, иллюстрационный материал, специализированное и лабораторное оборудование
- •8. Текущий и итоговый контроль
- •Перечень типовых экзаменационных вопросов
- •9. Рейтинговая оценка по дисциплине
- •«Дальневосточный федеральный университет»
- •Тема 2. Основные понятия и законы химии
- •Раздел 2. Строение атома и химическая связь (6 часов)
- •Тема 1. Строение атома, периодический закон д.И. Менделеева
- •Тема 2. Химическая связь
- •Раздел 1 Межмолекулярное взаимодействие (6 часов)
- •Тема 1. Межмолекулярное взаимодействие
- •Тема 2. Агрегатные состояния вещества
- •Раздел 1. Химическая термодинамика (18 часов)
- •Тема 1. I и II закон термодинамики
- •Раздел 2. Химическая кинетика (18 часов)
- •Тема 1. Кинетика химических процессов и химическое равновесие
- •Раздел 1. Общие сведения о растворах (12 часов)
- •Тема 1. Физико-химические свойства растворов
- •Выводы по теме:
- •1. Растоворы – сложные системы, состоящие из растворителя, растворенных веществ и продуктов их взаимодействия.
- •Тема 2. Растворы электролитов
- •Выводы по теме:
- •Раздел 2. Дисперсные системы (8 часов)
- •Тема 1. Коллоидные растворы
- •Раздел 1. Окислительно–восстановительные процессы (6 часов)
- •Тема 1. Окислительно–восстановительные реакции
- •Раздел 2. Гетерогенные окислительно-востановительные процессы (12 часов)
- •Тема 1. I род электродных процессов. Электродные процессы и электродвижущие силы в гальванических элементах.
- •Тема 2. Электролиз
- •Тема 3. Коррозия и защита металлов
- •Раздел 1. Высокомолекулярные соединения (8 часов)
- •Тема 1. Полимерные материалы
- •1. Основная литература:
- •2. Дополнительная литература:
- •3. Справочная литература:
- •«Дальневосточный федеральный университет»
- •Школа естественных наук материалы лабораторных занятий
- •180100.62 – Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
- •Лабораторная работа №1 Определение молярной массы эквивалента металла
- •Экспериментальная часть
- •Лабораторная работа №2 Комплексные соединения
- •Экспериментальная часть
- •Лабораторная работа №3 Определение теплового эффекта реакции нейтрализации
- •Экспериментальная часть
- •Лабораторная работа №4 Химическая кинетика
- •Экспериментальная часть
- •Лабораторная работа №5 Гидролиз солей
- •Экспериментальная часть
- •Лабораторная работа № 6 Коллоидные растворы
- •Экспериментальная часть
- •Лабораторная работа № 7 Электрохимические процессы
- •Экспериментальная часть
- •Лабораторная работа № 8 Коррозия металлов
- •Экспериментальная часть
- •Опыт 4. Ингибиторная защита металла от коррозии в кислой среде
- •Лабораторная работа № 9 Общие свойства металлов
- •Экспериментальная часть
- •«Дальневосточный федеральный университет»
- •2.Закон эквивалентов
- •Элементы химической термодинамики
- •Химическая кинетика
- •Модуль 4. Растворы Способы выражения состава растворов
- •Равновесия в растворах электролитов
- •Коллигативные свойства растворов
- •Модуль 5. Основы электрохимии
- •1. Основная литература:
- •2. Дополнительная литература:
- •3. Справочная литература:
- •«Дальневосточный федеральный университет»
- •II. Строение атома. Периодическая система
- •III. Химическая связь
- •IV. Химическая термодинамика
- •V. Химическая кинетика и равновесие
- •VI. Растворы неэлектролитов
- •VII. Растворы электролитов
- •VIII. Ионообменные реакции
- •3. Какие пары ионов могут быть использованы при составлении молекулярного уравнения, которому отвечает ионное уравнение
- •IX. Дисперсные системы и поверхностные явления
- •X. Окислительно-восстановительные процессы
- •XI. Электрохимические процессы
- •XII. Коррозия
- •«Дальневосточный федеральный университет»
- •2. Дополнительная литература:
- •3. Справочная литература:
- •«Дальневосточный федеральный университет»
- •Школа естественных наук глоссарий
- •180100.62 – Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
- •«Дальневосточный федеральный университет»
- •Константы диссоциации слабых оснований
- •Стандартные окислительно-восстановительные потенциалы некоторых систем в водных растворах при 25 с
- •Потенциалы металлов
- •Произведение растворимости веществ в воде
- •Термодинамические константы некоторых веществ и ионов
Элементы химической термодинамики
Знать:
1.Основные термодинамические функции: теплоту, работу, внутреннюю энергию, энтальпию, энтропию, изобарно-изотермический и изохорно-изотермический потенциалы;
2. Виды термодинамических процессов;
3. Сущность первого закона термодинамики, его математическое выражение и применение к различным процессам;
4. Причины возникновения тепловых эффектов, сущность закона Гесса и следствий из него, тепловые эффекты различных процессов;
5. Сущность и математические выражения второго закона термодинамики;
6. Сущность энтропии и ее статистическую природу;
7. Критерии самопроизвольного протекания процессов в различных системах;
8. Уравнение изотермы химической реакции и возможность его использования;
9. Уравнение изобары химической реакции и его применение.
Уметь рассчитывать:
1. Тепловые эффекты реакций при стандартных условиях;
2. Изменение энтропии в результате химической реакции;
3. Изменение свободной энергии Гиббса при заданной температуре;
4. Константу химического равновесия при заданной температуре.
Состояние системы характеризуется ее физическими и химическими свойствами (объем, давление, температура, химический состав и т.д.). Свойства, выбранные в качестве независимых переменных, называются параметрами состояния. Величина, определяемая этими параметрами, однозначно характеризующая систему и независящая от пути ее перехода из одного состояния в другое, называется функцией состояния.
Термодинамическими функциями состоянияявляются:
внутренняя энергия Uхарактеризует общий запас энергии в системе, исключая кинетическую энергию системы как целого и ее потенциальную энергию в поле внешних силΔU=Uкон–Uисх> 0 внутренняя энергия системы возрастает;
энтальпия Нхарактеризует общее теплосодержание системы или тепловой эффект химической реакции при постоянном давлении
ΔН > 0 тепло поглощается, эндотермическая реакция;
ΔН < 0 тепло выделяется, экзотермическая реакция;
энтропия Sхарактеризует степень беспорядочности частиц в системе
ΔS> 0 степень беспорядка возрастает;
ΔS< 0cтепень беспорядка уменьшается;
свободная энергия Гиббса Gили изобарно-изотермический потенциал характеризует часть энергии, идущую на совершение полезной работы при постоянных давлении и температуре
ΔG> 0 энергия поглощается, эндоэргоническая реакция;
ΔG< 0 энергия выделяется, экзоэргоническая реакция;
свободная энергия Гельмгольца Fили изохорно-изотермический потенциал характеризует часть энергии, идущую на совершение полезной работы при постоянных объеме и температуре.
ΔF> 0 энергия поглощается,ΔF< 0 энергия выделяется.
В соответствии с законом Гесса:
ΔGреакции= Σ(νΔG![]() )продуктов
– Σ(νΔG
)продуктов
– Σ(νΔG![]() )исходных
веществ
)исходных
веществ
ΔHреакции= Σ(νΔH![]() )продуктов
– Σ(νΔH
)продуктов
– Σ(νΔH![]() )исходных
веществ
)исходных
веществ
ΔSреакции= Σ(νS![]() )продуктов
– Σ(ν S
)продуктов
– Σ(ν S![]() )исходных
веществ.
)исходных
веществ.
Объединенный термодинамический закон
ΔGреакции=ΔHреакции-TΔSреакции.
Если пренебречь
зависимостями ΔH0иΔS0от температуры,
то для термодинамических расчетов
применяют уравнениеΔG![]() =ΔH
=ΔH![]() -TΔS
-TΔS![]() .
.
Если ΔG< 0, то такой процесс термодинамически возможен. Чем более отрицательноΔG, тем в большей степени реакция протекает в направлении образования продуктов реакции.
Если ΔG> 0, то процесс приводит к увеличению энергии Гиббса и такая реакция термодинамически невозможна.
Если ΔG= 0, то начальные условия в системе соответствуют равновесию.
Критериями самопроизвольного протекания процессовявляются
1. в изолированной системе ΔS> 0;
2. в закрытой и открытой системах ΔG< 0 (для изобарно-изотермических процессов);
3. в закрытой и открытой системах ΔF< 0 ( для изохорно-изотермических процессов).
Пример 1. Сколько теплоты выделится при сжигании 920 г этанола? Запишите термохимическое уравнение данной реакции.
Решение:Процесс горения этанола можно представить
следующим уравнениемC2H5OH
(ж)+ 3O2 (г)= 2CO2
(г)+ 3H2O(г).
По первому следствию из закона ГессаΔH![]() реакции=2ΔH
реакции=2ΔH![]() CO
CO![]() +
3ΔH
+
3ΔH![]() H
H![]() O-ΔH
O-ΔH![]() С
С![]() H
H![]() OH- 3ΔH
OH- 3ΔH![]() O
O![]() .
.
Используя справочные данные, находим тепловой эффект горения 1 моль этанола C2H5OH.
ΔH![]() реакции= 2(-393,5) + 3(-285,8) – (-277,6) – 0
= - 1366,8 кДж
реакции= 2(-393,5) + 3(-285,8) – (-277,6) – 0
= - 1366,8 кДж
Находим количество вещества C2H5OHв 920 г:
n(C2H5OH)
=
![]() =
=
![]() =
20 моль.
=
20 моль.
Следовательно,
количество теплоты, выделяющееся при
сжигании 20 моль этанола, будет равно Qp= -ΔH![]() реакции n(C2H5OH)
= 1366,8∙20 = 27336 кДж = 27,34 МДж. Термохимическое
уравнение можно записать следующим
образомC2H5OH
(ж)+ 3O2 (г)= 2CO2
(г)+ 3H2O(г),ΔH
реакции n(C2H5OH)
= 1366,8∙20 = 27336 кДж = 27,34 МДж. Термохимическое
уравнение можно записать следующим
образомC2H5OH
(ж)+ 3O2 (г)= 2CO2
(г)+ 3H2O(г),ΔH![]() реакции= -1366,8 кДж.
реакции= -1366,8 кДж.
Ответ:выделится 27,34 МДж тепла.
Пример 2. С помощью термодинамических расчетов на примере реакций
SnO2 (к)+Sn(к)= 2SnO(к)иPbO2(к)+Pb(к)= 2PbO(к)ответьте на вопрос об устойчивых степенях окисления олова и свинца в закрытой системе при температуре 300 К.
Решение: РассчитаемΔG![]() первой и второй реакции по уравнению ΔG
первой и второй реакции по уравнению ΔG![]() =ΔH
=ΔH![]() -TΔS
-TΔS![]() .
.
Для первой реакции:
1) ΔH![]() реакции=2ΔH
реакции=2ΔH![]() SnO-ΔH
SnO-ΔH![]() SnO
SnO![]() -ΔH
-ΔH![]() Sn
Sn
ΔH![]() реакции= 2(-286) - (-581) – 0 = 9 кДж >
0 – тепло поглощается, эндотермическая
реакция;
реакции= 2(-286) - (-581) – 0 = 9 кДж >
0 – тепло поглощается, эндотермическая
реакция;
2) ΔS![]() реакции = 2S
реакции = 2S![]() - S
- S![]() -
S
-
S![]()
ΔS![]() реакции=2∙56,5 – 52,3 – 51,6 = 9,1Дж/К =
0,0091кДж/К.
реакции=2∙56,5 – 52,3 – 51,6 = 9,1Дж/К =
0,0091кДж/К.
Степень беспорядка в системе возрастает, данная реакция будет протекать самопроизвольно в изолированной системе при стандартных условиях.
ΔG![]() =
9 кДж – 300 К∙ 0,0091 кДж/К = 6,27 кДж > 0 –
энергия поглощается в ходе реакции; в
закрытых и открытых системах
термодинамически возможна обратная
реакция, т.е. в указанных условиях более
устойчив оксид олова (IV)SnO2.
=
9 кДж – 300 К∙ 0,0091 кДж/К = 6,27 кДж > 0 –
энергия поглощается в ходе реакции; в
закрытых и открытых системах
термодинамически возможна обратная
реакция, т.е. в указанных условиях более
устойчив оксид олова (IV)SnO2.
Для второй реакции расчеты проводятся по такой же схеме:
1) ΔH![]() реакции=2ΔH
реакции=2ΔH![]() PbO-ΔH
PbO-ΔH![]() PbO
PbO![]() -ΔH
-ΔH![]() Pb
Pb
ΔH![]() реакции=2(- 219) – (- 277) – 0 = -161кДж <
0 – тепло выделяется, экзотермическая
реакция;
реакции=2(- 219) – (- 277) – 0 = -161кДж <
0 – тепло выделяется, экзотермическая
реакция;
2) ΔS![]() реакции = 2S
реакции = 2S![]() - S
- S![]() -
S
-
S![]()
ΔS![]() реакции=2∙66 – 72 – 65 = - 5 Дж/К = -
0,005 кДж/К – степень беспорядка в системе
уменьшается, в изолированной системе
данная реакция самопроизвольно протекать
не будет.
реакции=2∙66 – 72 – 65 = - 5 Дж/К = -
0,005 кДж/К – степень беспорядка в системе
уменьшается, в изолированной системе
данная реакция самопроизвольно протекать
не будет.
ΔG![]() =
- 161 кДж – 300К(-0,005кДж/К) = - 159,5 кДж < 0 –
энергия выделяется, в закрытых и открытых
системах термодинамически возможен
прямой процесс, т.е. в указанных условиях
более устойчив оксид свинца (II)PbO.
=
- 161 кДж – 300К(-0,005кДж/К) = - 159,5 кДж < 0 –
энергия выделяется, в закрытых и открытых
системах термодинамически возможен
прямой процесс, т.е. в указанных условиях
более устойчив оксид свинца (II)PbO.
Ответ:в указанных условиях устойчивой степенью окисления для олова является степень окисления +4, для свинца – +2.
Пример 3.
Константы равновесия К![]() реакции
2SO2 (г)+O2
(г)= 2SO3 (г)при
727 и 9270С равны соответственно 3,34
и 0,079. Рассчитайте стандартную энергию
Гиббса ΔG
реакции
2SO2 (г)+O2
(г)= 2SO3 (г)при
727 и 9270С равны соответственно 3,34
и 0,079. Рассчитайте стандартную энергию
Гиббса ΔG![]() и определите направление самопроизвольного
протекания реакции при указанных
температурах, а также средний тепловой
эффект (стандартную энтальпию) процесса
в приведенном температурном интервале.
и определите направление самопроизвольного
протекания реакции при указанных
температурах, а также средний тепловой
эффект (стандартную энтальпию) процесса
в приведенном температурном интервале.
Решение:
В абсолютной шкале температуры 727 и
9270С соответственно равны 1000 и
1200 К. ВеличинуΔG![]() рассчитаем по стандартному уравнению
”изотермы” химической реакцииΔG
рассчитаем по стандартному уравнению
”изотермы” химической реакцииΔG![]() =
-RTlnК
=
-RTlnК![]() ;
;
ΔG![]() =
-8,314 ∙1000ln3,34 = - 10026 Дж/моль
= - 10,026 кДж/моль;
=
-8,314 ∙1000ln3,34 = - 10026 Дж/моль
= - 10,026 кДж/моль;
ΔG![]() = -8,314 1200ln0,079 = 25324 Дж/моль
= 25,3 кДж/моль.
= -8,314 1200ln0,079 = 25324 Дж/моль
= 25,3 кДж/моль.
Таким образом, при
1000 К реакция протекает в прямом направлении
(ΔG![]() <
0), при 1200 К – в обратном направлении
(ΔG
<
0), при 1200 К – в обратном направлении
(ΔG![]() >
0).
>
0).
Величину
![]() ΔH
ΔH![]() определим
по уравнению изобары Вант Гоффа в
интегральном видеln
определим
по уравнению изобары Вант Гоффа в
интегральном видеln![]() =
=
![]() (
(![]() −
−
![]() ).
Выражаем из уравненияΔH
).
Выражаем из уравненияΔH![]() =
= =
= =
- 186779,6 Дж/моль = - 186,8 кДж/моль.
=
- 186779,6 Дж/моль = - 186,8 кДж/моль.
Для удобства расчетов обычно принимают Т2> Т1.
Ответ: ΔG![]() = - 10 кДж/моль – в прямом направлении
протекает реакция,ΔG
= - 10 кДж/моль – в прямом направлении
протекает реакция,ΔG![]() =
25,3 кДж/моль – в обратном направлении
протекает реакция, реакция экзотермическаяΔH
=
25,3 кДж/моль – в обратном направлении
протекает реакция, реакция экзотермическаяΔH![]() = - 186,8 кДж/моль.
= - 186,8 кДж/моль.
Пример 4. Рассчитать энергию Гиббса химической реакции синтеза аммиака
![]() N2
(г)+
N2
(г)+
![]() H2
(г)=NH3 (г)при
298К и относительных парциальных давлениях
РН
H2
(г)=NH3 (г)при
298К и относительных парциальных давлениях
РН![]() =
100, РN
=
100, РN![]() =
100 иPNH
=
100 иPNH![]() =1.ΔG
=1.ΔG![]() NH
NH![]() =
- 16,66 кДж/моль.
=
- 16,66 кДж/моль.
Решение:
Используем уравнение “изотермы”
химической реакции в нестандартных
условияхΔG298=ΔG![]() +RTln
+RTln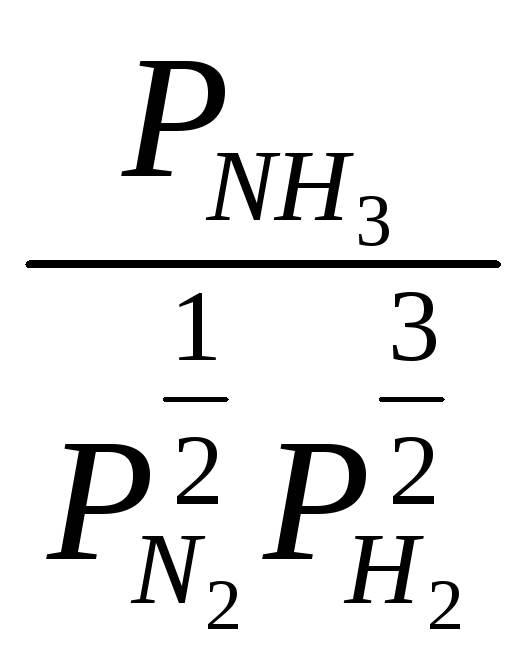
ΔG298= - 16,66 + 8,314∙10-3∙298К∙ 2,3∙lg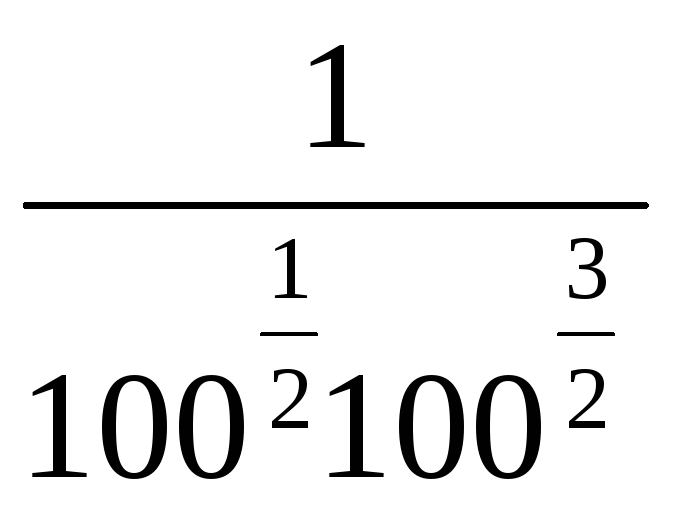 =
-16,66 +5,698∙lg
=
-16,66 +5,698∙lg![]() =
- 16,66 + 5,698 ∙lg10-4=
-16,66 + 5,698∙ (-4) = -16,66 – 22,792 = - 39,452 кДж/моль.
=
- 16,66 + 5,698 ∙lg10-4=
-16,66 + 5,698∙ (-4) = -16,66 – 22,792 = - 39,452 кДж/моль.
ΔG298 < 0, реакция идет самопроизвольно в прямом направлении в указанных условиях.
Ответ:ΔG298= - 39,452 кДж/моль
Контрольные вопросы:
1. Какие из следующих термодинамических функций относятся к функциям состояния: теплота, энтропия, свободная энергия Гиббса, работа расширения газа, энтальпия, изохорно-изотермический потенциал?
2. Какой смысл имеют знаки ’’плюс” или ”минус” перед термодинамическими функциями: теплотой, энтальпией, свободной энергией Гиббса?
3. Какие выводы можно сделать о конкретной химической реакции, если изменение следующих термодинамических функций отрицательно: а) энтальпии; б) энтропии; в) свободной энергии Гиббса?
4. В каком случае для оценки теплового эффекта реакции используется: а) первое следствие закона Гесса; б) второе следствие закона Гесса?
5. Как связаны между собой тепловой эффект и изменение энтальпии процесса? Укажите знак ΔHдля экзо- и эндотермической реакции.
6. Подтвердите физический смысл энтропии математическими формулами и примерами.
7. Каким образом производят расчет свободной энергии Гиббса: а) по величинам свободных энергий образования веществ; б) по энтальпийному и энтропийному факторам; в) по величине электродвижущей силы процесса; г) по константе химического равновесия при заданной температуре?
8. Почему введены три критерия направления самопроизвольных процессов ΔS,ΔG,ΔF?
Задания для самостоятельного решения:
Для предложенной реакции ответьте на следующие вопросы:
1) экзо- или эндотермической является данная реакция; определите тепловой эффект образования 1 кг любого из продуктов реакции;
2) как меняется степень беспорядка в ходе реакции;
3) возможна ли данная реакция в изолированной системе при стандартных условиях;
4) возможна ли данная реакция в открытой системе при 250С и 1000 К. При какой температуре выделяется больше энергии;
5) какой фактор (энтропийный или энтальпийный) способствует протеканию процесса;
6) запишите выражения кинетической и термодинамической Кравновесия, покажите взаимосвязь между ними;
7) рассчитайте числовое значение Кравновесияпри температуре 250С и 1000 К. При какой температуре полнота протекания реакции выше;
8) укажите оптимальные условия протекания реакции, используя принцип Ле Шателье (условия, при которых равновесие смещается в прямом направлении).
Не забудьте уравнять предложенную реакцию.
|
1 |
|
Fe2O3 (т) + H2 (г) = FeO (т) + H2O (г) |
| ||||||||||||||||||
|
∆H0обр , кДж/моль |
-822,2 |
0 |
-264,9 |
-241,8 |
| ||||||||||||||||
|
S0 , Дж/моль∙К |
87 |
131 |
61 |
189 |
| ||||||||||||||||
|
2 |
|
CaC2 (т) + H2O (ж) = Ca(OH)2 (т) + C2H2 (г) |
| ||||||||||||||||||
|
∆H0обр , кДж/моль |
-59,83 |
-285,8 |
-985,1 |
226,75 |
| ||||||||||||||||
|
S0, Дж/моль∙К |
69,96 |
69,95 |
83,39 |
200,82 |
| ||||||||||||||||
|
3 |
|
NH3 (г) + Cl2 (г) = N2 (г) + HCl (г) |
| ||||||||||||||||||
|
∆G0обр, кДж/моль |
-16,48 |
0 |
0 |
-95,3 |
| ||||||||||||||||
|
S0 , Дж/моль∙К |
192,66 |
222,98 |
191,5 |
186,79 |
| ||||||||||||||||
|
4 |
|
CH4 (г) + O2 (г) = CO2 (г) + H2O (г) |
| ||||||||||||||||||
|
∆H0обр, кДж/моль |
-74,85 |
0 |
-393,5 |
-241,8 |
| ||||||||||||||||
|
S0 , Дж/моль∙К |
186,24 |
205 |
213,66 |
188,72 |
| ||||||||||||||||
|
5 |
|
SO2 (г) + H2S (г) = S (т) + H2O (ж) |
| ||||||||||||||||||
|
∆G0обр, кДж/моль |
-300,2 |
-33,5 |
0 |
-237,2 |
| ||||||||||||||||
|
∆H0обр, кДж/моль |
-296,9 |
-20,6 |
0 |
-285,8 |
| ||||||||||||||||
|
6 |
|
C2H2 (г) + O2 (г) = CO2 (г) + H2O (г) |
| ||||||||||||||||||
|
∆G0обр, кДж/моль |
209,2 |
0 |
-394,4 |
-228,6 |
| ||||||||||||||||
|
∆H0обр, кДж/моль |
226,75 |
0 |
-393,5 |
-241,8 |
| ||||||||||||||||
|
7 |
|
NO2 (г) = NO (г) + O2 (г) |
| ||||||||||||||||||
|
∆H0обр, кДж/моль |
34,19 |
91,26 |
0 |
|
| ||||||||||||||||
|
S0 , Дж/моль∙К |
240,06 |
210,64 |
205 |
|
| ||||||||||||||||
|
8 |
|
Fe2O3 (т) + CO (г) = Fe (т) + CO2 (г) |
| ||||||||||||||||||
|
∆H0обр, кДж/моль |
-822,1 |
-110,5 |
0 |
-393,5 |
| ||||||||||||||||
|
S0 , Дж/моль∙К |
87,45 |
197,55 |
27,15 |
213,66 |
| ||||||||||||||||
|
9 |
|
PbS (т) + O2 (г) = PbO (т) + SO2 (г) |
| ||||||||||||||||||
|
∆H0обр, кДж/моль |
-100,4 |
0 |
-219,3 |
-296,9 |
| ||||||||||||||||
|
∆G0обр, кДж/моль |
-98,77 |
0 |
-189,1 |
-300,2 |
| ||||||||||||||||
|
10 |
|
KClO3 (т) = KCl (т)+ O2 (г) |
| ||||||||||||||||||
|
∆H0обр, кДж/моль |
-391,2 |
-436,7 |
0 |
| |||||||||||||||||
|
S0 , Дж/моль∙К |
142,97 |
82,55 |
205 |
|
| ||||||||||||||||
|
11 |
|
FeS2 (т) + O2 (г) = Fe2O3 (т) + SO2 (г) |
| ||||||||||||||||||
|
∆G0обр, кДж/моль |
-166,1 |
0 |
-740,3 |
-300,2 |
| ||||||||||||||||
|
S0 , Дж/моль∙К |
52,93 |
205 |
87,45 |
248,07 |
| ||||||||||||||||
|
12 |
|
C2H2 (г) + H2 (г) = C2H6 (г) |
| ||||||||||||||||||
|
∆H0обр, кДж/моль |
226,75 |
0 |
-84,67 |
|
| ||||||||||||||||
|
S0 , Дж/моль∙К |
200,8 |
130,5 |
229,5 |
|
| ||||||||||||||||
|
13 |
|
CO2 (г) + NH3 (г) = CO(NH2)2 (т) + H2O (г) |
| ||||||||||||||||||
|
∆H0обр, кДж/моль |
-393,5 |
-45,94 |
-333,7 |
-241,8 |
| ||||||||||||||||
|
S0 , Дж/моль∙К |
213,66 |
192,66 |
104,6 |
188,72 |
| ||||||||||||||||
|
14 |
|
SiO2 (г) + NaOH (ж) = Na2SiO3 (т) + H2O (ж) |
| ||||||||||||||||||
|
∆G0обр, кДж/моль |
-850,7 |
-419,5 |
-1468 |
-237,2 |
| ||||||||||||||||
|
S0 , Дж/моль∙К |
46,86 |
64,43 |
113,76 |
69,95 |
| ||||||||||||||||
|
15 |
|
C2H5OH (ж) + O2 (г) = CO2 (г) + H2O (г) |
| ||||||||||||||||||
|
∆H0обр, кДж/моль |
-276,98 |
0 |
-393,5 |
-241,8 |
| ||||||||||||||||
|
S0 , Дж/моль∙К |
160,7 |
205 |
213,7 |
188,7 |
| ||||||||||||||||
