
- •Дисциплина: Общая и неорганическая химия
- •1 Моль вещества э(эквивалента) - содержит 6,02*1023э(эквивалентов)
- •Объединенный газовый закон
- •Уравнение Клайперона-Менделеева
- •Закон Дальтона
- •3.Окислительно-восстановительные реакции. Степень окисления. Окислители, восстановители. Типы окислительно-восстановительных реакций
- •Основные положения теории о-в процессов:
- •Окислительно-восстановительные свойства элементов
- •Виды окислительно-восстановительных реакций
- •4. Растворы. Насыщенные и ненасыщенные растворы. Способы выражения содержания растворенного вещества в растворе (массовая и мольная доли; молярная, эквивалентная, моляльная концентрации; титр)
- •Способы выражения концентрации растворов
- •Теории растворов
- •5.Гидролиз растворов солей. Степень гидролиза и факторы, влияющие на нее. Типичные случаи гидролиза (показать на примерах).
- •Соль слабого основания и сильной кислоты (nh4no3, ZnCl2, Al2(so4)3)
- •6.Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
- •Электролиз расплавов
- •Электролиз водных растворов
- •Законы электролиза
- •Выход по току
- •Координационная теория Вернера (1893 г.)
- •Номенклатура комплексных соединений
- •8. Строение атома. Квантовые числа. Принципы наименьшей энергии. Правило Клечковского, принцип Паули, правило Хунда. Составление электронных формул.
- •Строение атома по Бору (1913):
- •9.Периодический закон и система д.И. Менделеева
- •Структуры периодической системы:
- •Периодическая система и электронная структура атома
- •10. Типы химической связи (ковалентная , ионная, металлическая, водородная)
- •11. Химия элементов и их соединений I группа пс. Водород: особенности электронной структуры, изотопы. Получение и применение водорода и щелочных металлов. Получение и применение меди, серебра, золота.
- •Водород
- •Получение
- •Химические свойства водорода
- •Применение
- •Щелочные металлы
- •Медь, серебро и золото
- •Способы получения металлов d-элементов I группы:
- •Применение
- •12. II группа пс. Амфотерность бериллия и его соединений. Общая характеристика подгруппы d- элементов.
- •Соединения Ве и Mg
- •Щелочноземельные металлы
- •Цинк, кадмий и ртуть
- •13. Жесткость воды и способы ее устранения.
- •16. V группа пс. Особенности химической связи в молекуле азота. Важнейшие соединения азота (аммиак, оксиды азота, азотная и азотистая кислота и их соли). Взаимодействие азотистой кислоты с Ме и неМе.
- •17. Элементы 6 группы пс. Кислород: оксиды, пероксиды. Строение и свойства озона. Сера: оксиды, кислоты, соединения серы с Ме и неМе.
- •18. Свойства серной кислоты. Особенности взаимодействия разбавленной и концентрированной серной кислоты с Ме и неМе.
- •20. Элементы VII группы пс. Химические свойства галогенов: степени окисления, галогенводороды, соединения с кислородом, кислоты, содержащие хлор и их соли.
- •22. VIII группа пс. Подгруппа d- элементов: триоды элементов и их химические свойства. Оксиды, гидроксиды и комплексные соединения этих элементов.
6.Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Электролиз — совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении электрического тока через расплав или раствор электролита.
Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
На катоде, происходит процесс восстановления (принятие электронов). На аноде идет процесс окисления (отдача электронов).
Электролиз расплавов
|
1) Расплав NaCl (t=850ºC)
|
2) Расплав KOH
|
Электролиз водных растворов
На процессе электролиза в водных растворах влияние оказывают продукты диссоциации воды

Катодный процесс
Поведение катионов металлов при электролизе зависит от расположения металла в ряду активности, возможны 3 случая:
а) катионы металлов (от Li+ по Al3+) не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды;
б) катионы металлов (от Sn2+ по Au+) полностью восстанавливаются на катоде;
в) катионы металлы средней части ряда от (Al3+ до Sn2+) восстанавливаются на катоде одновременно с молекулами воды.
Вода на катоде (-)
А) кислая среда рН<7

Б) нейтральная и щелочная рН>=7

Анодный процесс
Аноды могут быть растворимые (активные) и нерастворимые (инертные).
Активные аноды изготавливают металлов (из меди, серебра, железа), они сами растворяются, т.е. окисляются при электролизе.
Инертные аноды из угля, графита, платины, они не окисляются, т.е. не растворяются при электролизе, а служат для передачи электродов во внешнюю цепь. На инертном аноде происходит окисление анионов раствора или молекул воды. При этом анионы бес кислородных кислот легко окисляются, а вместо кислородосодержащих анионов окисляется вода.
|
Cl-, Br-, I-, S2- окисляются сами
|
NO3-, SO42-, PO43-, CO32- окисляются молекулы воды
|
Вода на аноде (+)
А) щелочная среда рН>7

Б) нейтральная и кислая среда

Законы электролиза
Количественная характеристика процессов электролиза определяется законами Фарадея.
Первый закон Фарадея
Масса вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду, прошедшему через электролит.
Второй закон Фарадея
При постоянном количестве прошедшего электричества массы образующихся на электродах веществ пропорциональны их эквивалентным массам:

Для выделения 1 эквивалента вещества нужно пропустить через электролизер 1 Фарадей количества электричества:
1F=96500 Кл/моль=26,8г/А*ч
В обобщенном виде законы Фарадея записывают:
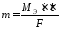

где m - масса в-ва образуемого на электроде (в г); Мэ – эквивалентная масса; i – сила тока (в А);
τ – время электролиза; q – количество электричества
Электрохимический эквивалент КЭ – число, показывающее какая масса вещества выделится на электродах при прохождении 1 Кл электричества

Выход по току
Показателем эффективности электролиза является выход по току – отношение массы фактически полученного при электролизе полезного продукта к его массе отвечающей законам Фарадея:

7.Комплексные соединения. Состав и строение комплексных соединений: комплексообразователь, лиганды, комплексный ион, координационное число, внутренняя и внешняя сфера. Номенклатура комплексных соединений.
При взаимодействии молекул часто образуются более сложные соединения, соединения высшего порядка.

Одни из них диссоциируют на все составляющие ионы, и называются двойными солями (1), другие на сложные (комплексные ионы), и называются комплексными или координационными соединениями (2).

К комплексным соединениям относятся такие вещества, которые содержат группу, способных к независимому существованию атомов или молекул (лигандов), координированных в определенном порядке, вокруг центрального атома, называемого комплексообразователем.




