
Nasonova_V.A.,_Bunchuk_N.V._Лекции по клинической ревматологии_(Medicina,2001)-1
.pdfЛекция 2
ДОСТИЖЕНИЯ И ПЕРСПЕКТИВЫ В ИДЕНТИФИКАЦИИ ГЕНОВ ПРЕДРАСПОЛОЖЕННОСТИ К РЕВМАТИЧЕСКИМ ЗАБОЛЕВАНИЯМ
Д-р мед. наук В.А. Мякоткин (Институт ревматологии
РАМН)
Этиология большинства ревматических заболеваний (РЗ), широко распространенных среди населения, и в настоящее время остается не вполне ясной, что обусловливает широкий поиск как средовых, такяи генетических факторов, ответственных за их этиологию.
В Институте ревматологии систематические исследования структуры наследственной предрасположенности РЗ проводятся в течениеяпоследних 25 лет с использованием генеалогического, близнецового, попу- ляционно-генетического, иммуногенетического и молекулярногенетического методов исследования.
Проведенные нами исследования, также как и работы зарубежных авторов [1], показали, что вклад генетических факторов в детерминацию РЗ превалирует над вкладом средовых факторов. Этояоткрывает перспективы поиска генов предрасположенности к ревматическим заболеваниям с использованием методологии «обратной генетики». Стратегия «обратной генетики» применительно кя поиску генов предрасположенности на первом этапе подразумеваетяих локализацию на конкретном участке конкретной хромосомы (т.е. картирование) с помощью анализа сцепления с генетическими маркерами, хромосомная локализация которых уже известна. Анализя сцепления представляет собой проверку совместного или независимого наследования заболевания и генетических маркеров в семьях. Чем ближе на хромосоме расположены ген предрасположенности кя заболеванию и гены генетических маркеров, тем чаще они наследуются совместно в родословных, что позволяет с помощью показателей частоты рекомбинации между ними определить хромосомную локализацию гена чувствительности. Количественным показателемя сцепления является логарифм соотношения шансов за и против егоя наличия в обследованной семье — лод-балл. Суммарная величина лодбаллов для выборки семей, равная +3,0 и более (что соответствует веро-
20

ятности р=0,001 и менее), свидетельствует о наличии сцепления, тогда как величина —2,0 и менее — о его отсутствии.
Для выявления гена предрасположенности с помощью анализая сцепления используются в основном два подхода: а) отбираютсяя геныкандидаты на роль главного гена и исследуется их полиморфизм в информативных семьях с последующим подсчетом лод-баллов, причем отрицательное значение этого показателя (—2,0 и менее) позволяет однозначно исключить ген-кандидат из претендентов ная роль главного гена; б) подбираются полиморфные, достаточно информативные (с высоким уровнем гетерозиготности) ДНК-маркерыя (от 15 и более на хромосому), проводится тестирование семей с последующим анализом сцепления между заболеванием и всеми использованными маркерами. Полученные в результате такого анализая значения лод-баллов помогают определить сегмент хромосомы, вя котором может быть локализован ген предрасположенности к заболеванию.
Таким образом, методология «обратной генетики» открываетявозможности для поиска генов предрасположенности, не имея предварительной информации о их количестве, функции и значимости вя этиопатогенезе заболевания.
В рамках вышеизложенной методологии в последние годы быля проведен широкий поиск генов чувствительности к ряду РЗ. Так, Shiozawa и соавт. (1997) на семьях с повторными случаями РАяпроскринировали все хромосомы, использовав для этой цели 358 полиморфных ДНКмаркера. В результате проведенной работы методом анализа сцепления были выделены два перспективных для поиска генов чувствительности к РА участка на Х-хромосоме, в которых локализованы ген рецептора фактора некроза опухолей и генялиганда CD40, являющихся, по мнению авторов, генами-кандидатами предрасположенности к PA. F.Cornelis и соавт. (1997), использовав сходную методологию, выявили два критических хромосомныхя участка, маркеры которых сцеплены с РА и могут содержать геныячувствительности к заболеванию. Один из этих участков располагается на Х-хромосоме (локализация соответствует данным японских авторов), тогда как другой расположен в том же самом сегменте 3-й хромосомы, где и ген IDDM9, являющийся одним из генов, детерминирующих чувствительность к инсулинзависимому диабету. По данным авторов, вклад этого гена в детерминацию заболеванияясоставляет около
27%.
Нами проведен анализ сцепления в двух, трех и четырех поколениях сорока семей с повторными и множественными случаями РА с рядом генов-кандидатов, в число которых входили HLA локусы (6-яяхромо- сома), гены -цепей коллагена I и II типов (COLIA2 и COLIIA1, 7-я и 12- я хромосомы соответственно), гены (3 (TCRB — 7-я хромосома), 2 8-
21
цепей (TCRA и TCRD — 14-я хромосома) Т-клеточногоя рецептора, а также с маркерами D18S63 и D18S452, которые былиявыбраны в связи с имеющимися в литературе данными о повышеннойячастоте РА среди носителей делеции в коротком плече 18-й хромосомы, где и локализованы эти маркеры. Для всех исследованных маркеров (табл. 2.1), кроме маркеров TCRD, были получены отрицательные значения лод-баллов, что позволяет отвергнуть по крайней мерея тесное сцепление с вышеперечисленными генами и исключить их изячисла генов чувствительности к РА. Для анализа сцепления РА сяTCRD в качестве маркера был использован 6-аллельный динуклеотидный GT повтор с высоким уровнем гетерозиготности (0,74), локализованный в 3-м интроне этого гена. Для анализа сцепления с данным маркером оказались пригодными 14 семей (149 человек, из нихя35 больных РА). Максимальный лод-балл был равен +1,68 при RF=0,0 у обоих полов. Подобное значение лод-балла не может рассматриваться в качестве строгого доказательства наличия сцепления, однакояявляется достаточно серьезным указанием на его вероятность, особенно при анализе сцепления гена с неполной пенетрантностью. Для подтверждения полученных оценок возможной сцепленности TCRD геная с главным геном РА был использован другой ДНК-маркер — ПДРФ, связанный с точковой изменчивостью TCRD гена в положении NT 256 и выявляемый рестриктазой ВатН I. Однако этот маркер менее информативен для анализа сцепления (гетерозиготность, по данным литературы, равна 0,32), что существенно повышает требования к точности оценок частот его аллелей, в связи с чем были обследованы 36 здоровых лиц из московской популяции. Полученные оценки аллельных частот практически не отличались от таковых в среднеевропейских популяциях. Анализ сцепления был проведен на 15 информативных по данному маркеру семьях (167 человек, 37 больных РА). Максимальный лод-балл составил +0,6 при частоте рекомбинации, равной 0,08 для обоих полов. Результаты изучения аллельных ассоциаций маркерного GT повтора и РА выявили статистически значимоея увеличение частоты носительства редкого аллеля Е1 среди больныхяРА с системными проявлениями по сравнению со здоровыми лицами. Показатель относительного риска (ОР) составил 3,9. Мы также изучили распределение аллельных вариантов динуклеотидного GT повтора среди больных системной склеродермией, анкилозирующимяспондилоартритом и в контрольной группе здоровых индивидуумов. Среди больных ССД отмечались повышенная частота аллеля Е2 (ОР=3,22) и сниженная частота аллеля Е1 (ОР=0,3). Распределениеяаллельных вариантов GT повтора у больных анкилозирующим спондилоартритом статистически значимо не отличалось от такового вя контрольной группе.
22
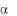
Таблица 2.1. Результаты тестирования генов-кандидатов предраспо-
ложенности к РА
|
Гены- |
|
Хромосомная |
|
Маркеры генов-кандидатов |
|
Лод-баллы |
|
кандидаты |
|
локализация |
|
|
||
|
|
|
|
|
|
||
|
HLA |
|
6р21 |
|
Антигены HLA |
|
-2,11 |
|
COLIA2 |
|
7q21— q22 |
|
Rsal ПДРФ |
|
-2,32 |
|
COLIIA1 |
|
12q!4 |
|
VNTR |
|
-2,40 |
|
TCRB |
|
7q35 |
|
VNTR |
|
-3,81 |
|
TCRA |
|
14qll |
|
VNTR |
|
+0,94 |
|
TCRD |
|
14qll |
|
VNTR |
|
+ 1,68 |
|
|
|
|
|
BamHI ПДРФ |
|
+0,60 |
|
Короткое пле- |
|
|
|
|
|
|
|
|
18pter-pll |
|
D18S63 |
|
-3,12 |
|
|
чо |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18-хромосомы |
|
18qll? |
|
D18S452 |
|
-0,72 |
|
|
|
|
|
|
|
|
VNTR — вариабельный тандемный нуклеотидный повтор. ПДРФ — полиморфизм длины рестриктных фрагментов. Rsal, BamHI — рестриктазы.
Сопоставимые с нашими данные были представлены Hall и соавт. [4]. Ими было получено также положительное значение лод-баллов (+0,65) для одного из маркеров TCRA локуса, расположенного в том же самом сегменте (ql 1) 14-й хромосомы, что и изученный нами локус TCRD. Помимо этого, Cornells и соавт. (1996) изучили ДНК полиморфизм V6, V7, V8 и V10 TCRA генов, кодирующих синтез вариабельного участка -полипептидной цепи Т-клеточного рецептора. Было выявлено увеличение частоты аллеля 2(+) V8 гена у больных РА. Значимость этой ассоциации была подтверждена на 2 других независимых европеоидных выборках. В совокупности эти результаты позволяют рассматривать хромосомный сегментя qll 14-й хромосомы как перспективный для дальнейшего поискаягена предрасположенности к РА. Интересно отметить, что в этом жеяхромосомном сегменте локализованы ген серинэстеразы 1, ассоциированный с цитотоксичностью Т-лимфоцитов (GZMB), ген матричной металлопротеиназы 14 (ММН14), ген транскрипционного фактора ингибитора каппа легких цепей В-лимфоцитов (NFkBI), локализованный в 14q 12 хромосомном сегменте, определенная значимостьякоторых в этиопатогенезе РА подтверждена последними исследованиями зарубежных авторов.
23

Другой возможный вариант трактовки полученных результатов: сами гены 5-полипептидной цепи Т-клеточного рецептора (TCRD) являются одними из генов предрасположенности к РА. В связи с этимяпредставляют интерес некоторые особенности у/5 Т-клеточного иммунитета, приведенные ниже [3].
1./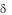 Т-лимфоциты в отличие от /
Т-лимфоциты в отличие от /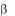 Т-лимфоцитов негативны пояCD4 и CD8, но так же, как и В-лимфоциты, позитивны по CD3. Однако CD3 сегмент 5-цепи более вариабельный, чем у иммуноглобулиновых цепей В-клеток.
Т-лимфоцитов негативны пояCD4 и CD8, но так же, как и В-лимфоциты, позитивны по CD3. Однако CD3 сегмент 5-цепи более вариабельный, чем у иммуноглобулиновых цепей В-клеток.
2.Повышенное содержание / Т-клеток отмечено: а) при микобактериальных инфекциях (лепра, туберкулез), листериозе, стрептококковой и стафилококковой инфекциях и др.; б) при инфицированиия вирусом Эпштейна—Барр, ВИЧ; в) при паразитарных инфекциях (лейшманиозе, шистосомозе).
Т-клеток отмечено: а) при микобактериальных инфекциях (лепра, туберкулез), листериозе, стрептококковой и стафилококковой инфекциях и др.; б) при инфицированиия вирусом Эпштейна—Барр, ВИЧ; в) при паразитарных инфекциях (лейшманиозе, шистосомозе).
3.Пул / Т-клеток подразделяется на две субпопуляции — V 1 (негативные по CD45 RO) и V 2 (позитивные по CD45 RO). Количество V 1 Т-клеток уменьшается с возрастом, тогда как количествоя V 2 Т- клеток увеличивается с возрастом. Блокада CD45 RO антигенной детерминанты моноклональный антителом предотвращает развитие аллергического энцефаломиелита в эксперименте.
Т-клеток подразделяется на две субпопуляции — V 1 (негативные по CD45 RO) и V 2 (позитивные по CD45 RO). Количество V 1 Т-клеток уменьшается с возрастом, тогда как количествоя V 2 Т- клеток увеличивается с возрастом. Блокада CD45 RO антигенной детерминанты моноклональный антителом предотвращает развитие аллергического энцефаломиелита в эксперименте.
4.V 1 Т-клетки распознают эндогенные антигены и белки теплового шока (Hsp). Показано, что микобактериальные Hsp являютсяясупер-
антигеном для V 1 клеток. Отмечена положительная динамикая у больных ЮРА при использовании в лечении белков теплового шока.
5.Показано, что в синовиальной жидкости больных РА во многоя раз повышено содержание V 1 Т-клеток. Отмечена аккумуляция V 1 Т- клеток при неспецифическом язвенном колите, аутоиммунном полигландулярном синдроме I типа. Повышенное содержание V 2 Т-клеток отме-
чено при рассеянном склерозе, атоническом дерматите. Увеличение кон- центрации /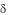 Т-клеток было выявлено у больных синдромом Дауна, у которых значительно чаще встречаются аутоиммунные заболевания, лейкемия и отмечается повышенная чувствительность к бактериальным и вирусным инфекциям.
Т-клеток было выявлено у больных синдромом Дауна, у которых значительно чаще встречаются аутоиммунные заболевания, лейкемия и отмечается повышенная чувствительность к бактериальным и вирусным инфекциям.
6.Иммунный ответ к эндогенным антигенам / Т-клеток не ингибируется (в отличие от /
Т-клеток не ингибируется (в отличие от / Т-клеток) антителами против специфичностей I и II классов главного комплекса гистосовместимости. Эндогенные лиганды, индуцирующие аутореактивность V 1 клеток, остаются до конца не выясненными. Предполагают, что ими в первую очередь являются белки теплового шока. Аутореактивность реализуетсяятолько в присутствии лигандов к витронектиновому рецептору (VNR), относящемуся к
Т-клеток) антителами против специфичностей I и II классов главного комплекса гистосовместимости. Эндогенные лиганды, индуцирующие аутореактивность V 1 клеток, остаются до конца не выясненными. Предполагают, что ими в первую очередь являются белки теплового шока. Аутореактивность реализуетсяятолько в присутствии лигандов к витронектиновому рецептору (VNR), относящемуся к
24

группе мембранных рецепторов, включающих в себяярецептор фибронектина (FNR), Ilb/IIIa рецептор тромбоцитов и др.
7./ Т-клетки-киллеры экспрессируют Fc RIIIa рецепторы. Показано, что полиморфизм Fc RIIIa гена по двум отличающимся другя от друга сайтам ассоциирован с чувствительностью к СКВ.
Т-клетки-киллеры экспрессируют Fc RIIIa рецепторы. Показано, что полиморфизм Fc RIIIa гена по двум отличающимся другя от друга сайтам ассоциирован с чувствительностью к СКВ.
8./ Т-клетки обладают функцией надзора над опухолевыми клетками, они распознают клетки лимфомы Burkitt, трансформированныея вирусом Эпштейна—Барр В-клетки, клетки лимфатической лейкемиия и др. как в острой стадии, так и в стадии ремиссии.
Т-клетки обладают функцией надзора над опухолевыми клетками, они распознают клетки лимфомы Burkitt, трансформированныея вирусом Эпштейна—Барр В-клетки, клетки лимфатической лейкемиия и др. как в острой стадии, так и в стадии ремиссии.
Несколько отличный подход, базирующийся на данных об определенной гомологии структурных генов человека и мыши, был использован F.Tan и соавт. (1997) для выявления генов чувствительности кя ССД. Ранее на инбредной линии мышей был выявлен на 15-й хромосоме участок, на котором идентифицирован ген фибриллина-1 (FBN-1), ответственный за детерминацию синдрома плотной кожи (tsk), моделирующего отдельные клинические проявления ССД у человека. Затем с помощью ряда ДНК-маркеров был изучен аналогичный мышиному сегмент 15-й хромосомы человека на популяции американскихя индейцев Чоктау с высокой распространенностью ССД. Было показано, что ген чувствительности к ССД локализован на участке размером в 2 сантиморганиды 15-й хромосомы, содержащем порядка 40 генов, и что носительство определенных маркерных гаплотипов (39% у больных против 7,8% у здоровых) увеличивает риск развития ССДяв 7,5 раз.
Аналогичная методология была использована для идентификациия генов чувствительности к СКВ. Критический хромосомный участок, несущий ген или гены чувствительности к модельной СКВ, сначалая был выявлен и локализован на 1-й хромосоме у инбредных линийя мышей.
Затем вся |
1-я хромосома была прицельно протестирована уя человека. |
Так, Tsao |
и соавт., использовав ДНК-маркеры и методя анализа сцепле- |
ния, показали, что один из генов предрасположенности к СКВ локализован на участке протяженностью в 5 сантиморганид в сегменте q41—42 1-й хромосомы. Следует подчеркнуть, чтоярезультаты получены на семьях, относящихся к различным расам, — европеоидам, азиатам, афроамериканцам, что подчеркивает универсальность действия этого гена предрасположенности в детерминациия СКВ. Вклад этого гена в формирование подверженности к СКВ пояпредварительной оценке составляет около
20%. В исследованияхяG.Kearns и соавт. (1997) и K.Moser и соавт. (1997),
проведенных ная независимых выборках пораженных пар сибсов с использованиемяаналогичной методологии, была подтверждена локализация гена предрасположенности к СКВ в сегменте q41—42 1-й хромосомы, а такжеявыявлены два других сегмента этой же хромосомы — q21 и q31— 32, в которых могут быть локализованы гены чувствительности к СКВ.
25

Интересно отметить, что в сегменте q21—q23 1-й хромосомы локализованы гены экспрессирующихся на В-лимфоцитах Fc-рецепторов, полиморфизм которых ассоциирован с чувствительностью к СКВ. Так, Y.W.Song и соавт. (1997), J.T.Salmon и соавт. (1997) было показано, что Н/Н гомозиготы по 131-му аллелю Fc RIIa рецептора имеют вя 3 раза меньшую вероятность заболевания СКВ. J.Wu и соавт. (1997) был изучен полиморфизм другого гена семейства Fc-рецепторов — Fc RIIIa. Было показано, что V/V гомозиготные носители аллеля 176 этого гена имеют в 2 раза меньший риск заболеть СКВ без нефрита. Вероятность заболеть СКВ с развитием нефрита, для V/V гомозигот вя6 раз меньше, чем для носителей других генотипов этого гена. R.Mehrian и соавт. (1997) при изучении у больных СКВ ДНК полиморфизма гена интерлейкина-10 (IL10), локализованного в q31—32 сегменте 1-й хромосомы и bcl-2 гена, локализованного в q21 сегментея18-й хромосомы и ингибирующего апоптоз (запрограммированнуюя смерть клетки), показали, что носительство аллеля 193 bcl 2-го гена ияаллеля 127 IL-10 гена в раздельности умеренно повышает риск возникновения СКВ, тогда как их совместное наследование в 40 разяповышает риск развития этого заболевания.
Следует отметить, что на 1-й хромосоме также картирован ген Fas протеина (CD95), который в норме экспрессируется на мембране лимфоцитов и индуцирует апоптоз. Показано [5], что гены апоптоза обладают критическим регуляторный эффектом на иммунную систему. Инактивация или снижение регуляторной функции одного или болееяиз этих генов может в части случаев вызывать аутоиммунное заболевание. Эти критические иммунорегуляторные гены получили название «аутогенов» по аналогии с онкогенами, классом нормальных клеточных генов, которые при утрате их функций обусловливают возникновение рака. В настоящее время в ревматологии активно изучаетсяя полиморфизм некоторых генов апоптоза, таких как Fas, bcl-2, p53, c-fos, c-myc. Дефект апоптоза, связанный с аутоиммунитетом и обусловленный bcl-2 геном, был выявлен у мышей линии NOD, у которыхя развивается не только диабет I типа, но и поражение слюнных желез, сходное с таковым при болезни Шегрена. В ряде исследований былояпоказано, что ген р53 суперэкспрессирован в синовии больных РА; вя синовии и фибробластах больных РА выявлены соматические мутации р53 гена, которые обусловливают его аномальную функцию и какя следствие — образование паннуса и костной деструкции. МутациияFas-гена и как следствие этого аномальный синтез Fas-протеина выявлены в ряде исследований при СКВ и РА.
Интересный пример взаимодействия средовых и генетических факторов, связанный с нарушением функции аутогена, был найден у мышей инбредной линии lpr, для которых характерно развитие системныхя
26

аутоиммунных и лимфопролиферативный нарушений. Эти мыши являются носителями мутантного lpr аллеля Fas-гена, кодирующего синтезя Fas-протеина. У гомозиготных по мутантному аллелю мышей отсутствует экспрессия Fas-протеина, что приводит к дефекту апоптоза, кямассивной аккумуляции лимфоцитов и развитию аутоиммунного заболевания. Молекулярный анализ дефектного Fas-гена показал, что геня разорван вследствие встраивания в его кодирующую последовательность ретровирусного мобильного генетического элемента, известногоякак ЕТn. Таким образом, эта находка является первым примером более общего механизма, посредством которого ретровирусы и связанныея с ними эндогенные последовательности могут нарушать иммуннуюя функцию за счет изменения экспрессии аутогенов, одним из потенциальных результатов которой может быть аутоиммунное заболевание.
Другой генетический механизм нарушения иммунной функции, присущий ретровирусам, заключается в трансактивации иммунорегуляторных генов [2]. Геномы всех ретровирусов человека обладаютяспособностью кодировать синтез протеинов, которые воздействуют ная LTRпромотеры вируса и стимулируют транскрипцию. Эти регуляторы носят название «трансактивирущие транскрипционные активаторы tat и tax» (tat у ВИЧ-1 и tax у HTLV-1 — вируса 1 Т-клеточнойялейкемии человека). Хотя главная функция этих трансактиваторов — усиление транскрипции вирусного генома, выявлено, что эти протеины могут также усиливать транскрипцию определенных генов инфицированной клетки хозяина, одновременно репрессируя экспрессиюядругих клеточных генов. Так, было показано, что трансактивация ся помощью ВИЧ-1-tat или HTLV-1-tax протеинов индуцирует активность части генов, таких как ИЛ-2, ИЛ-2 рецептор, гранулоцитомакрофагальный колониестимулирующий фактор, ИЛ-3, ИЛ-6, трансформирующий фактор роста -1, продукты синтеза которых принимаютя участие в воспалительных реакциях. Недавние исследования ная трансгенных мышах подтвердили правомочность модели ретровирусной индукции воспалительных заболеваний с помощью механизмовятрансактивации. Группой исследователей на трансгенных по HTLV-I гену была смоделирована болезнь, тождественная синдрому Шегрена. Другой группой исследователей были получены две линии, трансгенные по большому участку генома HTLV-1, содержащего env (envelope protein) и tax-гены. У этих мышей с высокой частотой отмечалось поражение суставов с образованием паннуса и эрозий, гистологически сходное с РА.
Помимо методологии сцепления, для выявления генов предрасположенности к РЗ широко используется и традиционный метод ассоциаций. Классический пример плодотворности этого подхода — идентификация антигенов и гаплотипов риска системы HLA для всех рев-
27

матических заболеваний, причем методами молекулярной генетикия проводится изучение как самих генов (преимущественно II класса), так и их антигенов, что позволило сформулировать гипотезу «общегояэпитопа». В то же время тот факт, что большинство носителей антигенов и гаплотипов риска не заболевают ревматическими болезнями, свидетельствует о наличии других генов чувствительности, не связанных с системой HLA. Поэтому в последние годы в качестве генов-кандидатов предрасположенности к РЗ изучается полиморфизм других генов, продукты которых играют значимую роль в этиопатогене-зе заболеваний, — генов интерлейкинов, факторов некроза опухолейя и их рецепторов, металлопротеиназ, коллагенов, факторов роста иямногих других. Так, T.Hohler и соавт. (1997) при изучении полиморфизма промоторной части гена фактора некроза опухолей (ФНО ) показали, что мутация в положении 238 у больных псориатическойя артропатией встречается в 32% случаев по сравнению с 7% в контроле (показатель риска OR=6,2). В то же время исследования полиморфизма ФНО у больных РА подобной ассоциации не выявили. S.John и соавт. (1997) с помощью ДНК-маркеров на пораженных парах сибсов изучили связь РА с генами интерферонов (ИФ , ИФ , ИФ ), интерлейкинов (ИЛ-1 , ИЛ-I , ИЛ-2, ИЛ-6) и рецепторов интерлейкинов (ИЛ-IR, ИЛ-5R, ИЛ-8R). Более частое по сравнению соя случайным совместное наследование общих аллелей среди пораженных пар отмечалось для ИФ , ИЛ-5R и ИЛ-2, что свидетельствует оязначимости аллельного полиморфизма этих генов в этиопатогенезе РА, особенно гена ИЛ-2.
у больных РА подобной ассоциации не выявили. S.John и соавт. (1997) с помощью ДНК-маркеров на пораженных парах сибсов изучили связь РА с генами интерферонов (ИФ , ИФ , ИФ ), интерлейкинов (ИЛ-1 , ИЛ-I , ИЛ-2, ИЛ-6) и рецепторов интерлейкинов (ИЛ-IR, ИЛ-5R, ИЛ-8R). Более частое по сравнению соя случайным совместное наследование общих аллелей среди пораженных пар отмечалось для ИФ , ИЛ-5R и ИЛ-2, что свидетельствует оязначимости аллельного полиморфизма этих генов в этиопатогенезе РА, особенно гена ИЛ-2.
Другим, активно развиваемым в последнее время направлениемя исследований в ревматологии является изучение полиморфизма регуляторных факторов, оказывающих влияние на экспрессию структурных генов. К ним относятся системы гомеобоксов — повторяющихсяяпоследовательностей ДНК, кодирующих синтез тканеспецифическихя белков, которые способны связывать определенные участки ДНК, выполняя таким образом регуляторные и координирующие функции, а также транскрипционные факторы (вспомогательные белки, облегчающие РНКполимеразам прохождение основных этапов транскрипции, а также обеспечивающие тканеспецифическую экспрессию структурных генов путем взаимодействия с их промотерами).
К числу транскрипционных факторов, изучаемых при ревматических заболеваниях, относятся АР-1 (взаимодействующий с промотерами генов коллагена IV типа и стромелизина ), сКРОХ (взаимодействующий с геном коллагена А1), IRF-1 (интерферон и NO-синтетазу регулирующий фактор), NF-kB и др. Семейство транскрипционных факторов NF-kB вовлечено в регуляцию выработки многих молекул иммунной системы, включая молекулы адгезии, ИЛ, ПГ, ФНО и др. Наяос-
28
новании проведенных исследований было показано, что экспрессияя NFkB повышена в клетках синовии больных РА и псориатическогояартрита, что обусловливает повышенную выработку цитокинов ияклеточную пролиферацию, т.е. NF-kB, являются одной из ключевыхямолекул в регуляции иммунного ответа. Интересно отметить, что ингибиторы этих транскрипционных факторов (например, IkBa и др.) уменьшают воспаление и клеточную пролиферацию, поэтому NF-kB рассматривается как мишень для генотерапии аутоиммунных, в томячисле и ревматических заболеваний. Значимость полученных в последние годы результатов по идентификации генов чувствительностия к РЗ можно проиллюстрировать следующим примером: за рубежом вя клиническую практику активно внедряются методы лечения, использующие принципы генотерапии, например лечение РА растворимымярецептором ФНО, рекомбинантный рецептором ИЛ-1, пептидамияТ-клеточных рецепторов и др. [6].
В заключение следует отметить, что в результате реализации международного проекта «Геном человека» к 2002 г. планируется картировать (т.е. локализовать на хромосомах) все 80 000 структурныхягенов человека, что существенно упростит поиск генов чувствительности болезней с наследственным предрасположением, в том числе ияревматических, так как не будет требовать проведения трудоемкихя семейных исследований. Прорыва в идентификации генов предрасположенности к ревматическим заболеваниям следует ожидать в ближайшие годы, хотя и в настоящий момент полученные в этом направлении результаты достаточно впечатляющие.
СПИСОК ЛИТЕРАТУРЫ
1.Беневоленская Л.И. Ревматические болезни. — В кн.: Наследственная патология человека / Под ред. Ю.Е.Вельтищева, Н.П. Бочкова. — М., 1992.— С. 60—66.
2.Behar S.M., Porcelli S.A. Mechanisms of autoimmune disease induction. The role of the immune response to microbial pathogens // Arthr. Rheum. — 1995. _ Vol. 38, N 4. — P. 458—476.
3.Haas W., Pereira P., Tonegawa S. Gamma/Delta cells // Ann. Rev. Immunol. — 1993. — Vol. 11. — P. 637—685.
4.Hall F.C., Brown M.A., Weeks D.E. et al. II A Linkage study across the
Тcell receptor A and Т cell receptor В loci in families with rheumatoid arthritis // Arthr. Rheum. — 1997. — Vol. 40, N 10. — P. 1798—1802.
29
