
- •1. Вступление.
- •I. По этиологии:
- •II. В зависимости от пути инфицирования:
- •III. По клиническому течению:
- •1. Вступление.
- •I. По этиологии:
- •II. В зависимости от пути инфицирования:
- •III. По клиническому течению:
- •I. По этиологии:
- •II. В зависимости от пути инфицирования:
- •III. По клиническому течению:
- •I. По этиологии:
- •II. В зависимости от пути инфицирования:
- •III. По клиническому течению:
- •I. По этиологии:
- •II. В зависимости от пути инфицирования:
- •III. По клиническому течению:
- •Гормонпродуцирующие:
- •Герминогенные:
1. Вступление.
2. Теории возникновения опухолей.
3. Детская онкология: статистика.
4. Доброкачественные опухоли у детей.
5. Злокачественные опухоли у детей.
6. Принципы терапии в детской онкологии.
Вступление
Несмотря на существующее мнение о редкости новообразований у детей, опухоли у них встречаются достаточно часто. Получение достоверных статистических данных о детской онкозаболеваемости порой бывает затруднительным из-за отсутствия во многих регионах не только специализированных детских онкологических и гематологических отделений, но и поликлинических приемов.
Детская онкология выделилась как самостоятельная дисциплина в 1948 году, когда Фарбер и соавторы сообщили о возможности достижения временной ремиссии у детей с острым лимфобластным лейкозом при лечении антагонистом фолиевой кислоты – аминоптерином. Это сообщение является самым ранним свидетельством того, что химиотерапия может эффективной в лечении злокачественных опухолей у детей. Другой большой шаг вперед был сделан в 1956 году, когда в лечении солидной опухоли – хориокарциномы – был использован метотрексат. Комбинации нескольких химиотерапевтических препаратов стали использовать в лечении болезни Ходжкина и острого лимфобластного лейкоза в 60-е годы, что, в конечном счете, привело к использованию данного метода лечения при опухолях детского возраста.
Теории возникновения опухолей
Для объяснения происхождения опухолей у детей используются теории, которые приняты в общей онкологии. Но имеются и гипотезы, характерные для детской онкологии.
Существует теория Конгейма, согласно которой опухоли происходят из персистирующих эмбриональных зачатков, возникших из-за нарушения эмбриогенеза. Во время внутриутробного развития плода происходит смещение эмбриональных зачатков тканей. Не использованные при строительстве организма, эти эктопированные клетки могут длительное время не проявлять себя. При присоединении внутренних и внешних раздражителей эти зачатки могут дать опухолевый рост.
Согласно теории Фишер-Вазельса, наибольшее значение отводится условиям, при которых ткань в течение длительного срока получает мощные физиологические или патологические импульсы к росту. Они могут возникать вследствие повторной гибели или регенерации тканей (частое воздействие рентгеновских лучей), либо под влиянием быстрого роста тканей в определенные возрастные периоды.
Высказывается мысль о вирусной природе рака у детей. Так, вирусная теория используется для объяснения развития лимфомы Беркитта, лейкозов, лимфогранулематоза.
Согласно теории иммунологического контроля, у практически здорового человека заложена возможность злокачественного превращения клеток, которая сдерживается защитными силами организма. У детей с «поломками» иммунной системы чаще возникают злокачественные опухоли.
Наиболее интересная для детской онкологии теория происхождения опухолей связана с трансплацентарным бластомогенезом. Большинство новообразований у детей возникает путем прохождения канцерогенных веществ через плаценту. Через нее проходят почти все лекарственные препараты, применяемые в акушерской практике. Есть работы, основанные на большом статистическом материале, указывающие на трансплацентарное воздействие табака, алкоголя на потомство. Трансплацентарно действуют некоторые препараты (пестициды), применяемые в сельском хозяйстве.
Несколько слов о причинах возникновения опухолей у детей:
1. Эктопия эмбриональных клеток. Типичным примером такой опухоли является опухоль Вильмса (нефробластома). Причина ее возникновения – остаточная ткань метанефргенной бластемы (основного тканевого компонента эмбриональной почки).
2. О роли гормональных влияний свидетельствует различная частота встречаемости некоторых опухолей у мальчиков и девочек. Например, у лиц мужского пола злокачественные неходжкинские лимфомы встречаются более чем в 6 раз чаще, чем у девочек. С другой стороны, у девочек достоверно чаще встречаются тератомы и гемангиомы.
3. Наиболее яркими примерами генетической предрасположенности являются наследственно-семейные формы ретинобластомы, хондроматоза, полипоза кишечника.
4. Определенное влияние на возникновение опухолевых процессов у детей могут оказывать воздействия внешней среды (ионизирующие излучения, канцерогены, вирусы и т.д.). Подобные закономерности отмечены при гемобластозах, остеогенных саркомах и опухолях печени.
Детская онкология: статистика
Детская онкология существенно отличается от онкологии взрослых. С одной стороны удельный вес истинных эпителиальных (раковых) опухолей невелик и составляет лишь около 3-4% случаев злокачественных новообразований, а подавляющее большинство – саркоматозные. С другой, присущие взрослым больным локализации злокачественных процессов (легкие, желудочно-кишечный тракт, молочные железы, гениталии) не типичны для детского возраста (органы кроветворения, ЦНС, забрюшинное пространство, кости, кожа).
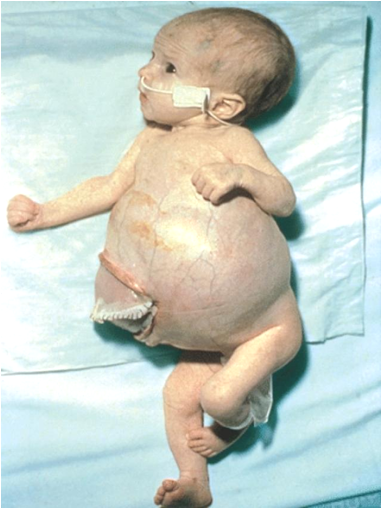
Все «настоящие» опухоли у детей являются врожденными: нейробластома, нефробластома, гепатобластома, ретинобластома. Другие опухоли детского возраста – рак, остеогенная саркома, гемобластозы – это приобретенные опухоли. Они являются нетипичными для детского возраста, чаще наблюдаются у взрослых.
По нашим данным в общем массиве детей с различными новообразованиями доброкачественный их характер отмечен в 88% наблюдений, у остальных пациентов опухоли были злокачественными (12,0%).
В структуре доброкачественных опухолей и опухолеподобных образований более половины (51,0%) приходится на сосудистые опухоли: гемангиомы (46,6%), лимфангиомы (3,7%) и доброкачественные гемангиоэндотелиомы (0,9%). Другие опухоли и опухолеподобные образования встречаются значительно реже. Сюда можно отнести продуктивные лимфадениты (7,6%), невусы (6,6%), гигромы (5,0%), фибромы (4,9%), полипы прямой (сигмовидной) кишки (4,2%), липомы (4,0%), дермоидные и эпидермоидные кисты (3,2%).
Среди случаев злокачественных новообразований у детей в динамике годовые показатели детской онкозаболеваемости возросли от 9,6 до 13,0 на 100 тыс. детского населения. Среди солидных образований чаще встречались нейробластомы, нефробластомы, опухоли костей. Общая онкозаболеваемость (с учетом информации о нейрохирургических и офтальмологических онкобольных) среди детей нашего региона достигает 14,0-15,0 случаев на 100 тыс. детского населения.
По данным исследовательской группы злокачественных новообразований у детей на долю лейкозов и лимфом приходится 48%, а опухолей ЦНС – 21% случаев заболеваний. Статистика Роберта Миллера и соавторов отличается не значительно: среди всех злокачественных новообразований у американских детей лейкозы составляют 31,4% случаев заболеваний, опухоли ЦНС - 17,6%, лимфомы - 12,4%, опухоли симпатической нервной системы - 8,1%, мягкотканные саркомы - 7,1%, опухоли почек - 6,4%, злокачественные опухоли костей - 5,0%, карциномы и другие злокачественные эпителиальные новообразования (меланомы в т.ч.) - 4,0%.
Доброкачественные опухоли у детей. Гемангиомы
Гемангиомы – это доброкачественные опухоли, исходящие из сосудов и имеющие дизонтогенетические происхождение. Рост их начинается в эмбриональном периоде и заканчивается через несколько месяцев или лет после рождения ребенка. Характеризуются наклонностью к быстрому инфильтративному росту. С рождения наблюдается около 90%, реже - в течение первых месяцев жизни. Девочки болеют в 2-3 раза чаще.


Классификация гемангиом:
1. Простые (капиллярные), располагающиеся собственно в коже.
2. Кавернозные (пещеристые), состоящие из отдельных полостей, выстланных эндотелием и разделенных соединительно-тканными перегородками.
3. Комбинированные – представляют из себя комбинацию простых и кавернозных образований.
4. Смешанные гемангиомы происходят из сосудистой системы и других тканей: ангиофиброма, гемлимфангиома, ангионеврома.
5. Ветвистые или рацемозные – характеризуются утолщением собственной оболочки и исходят, как правило, из магистральных кровеносных сосудов с атипичной клеточной структурой.
Характерным диагностическим симптомом гемангиом является следующее: при надавливании они бледнеют. Распознавание поверхностных гемангиом не представляет трудностей: характерным является наличие у ребенка красных (синюшно-красных) опухолевидных образований на коже. Более чем у 70% пациентов опухоль единичная. Гемангиомы внутренних локализаций встречаются относительно редко (около 1,9% случаев).
Труднее диагностировать сосудистые образования, расположенные подкожно. Они напоминают липому, фиброму, лимфангиому; диагноз уточняется во время удаления и гистологического исследования опухоли. Гемангиомы подлежат лечению по установлению диагноза.
Осложнения гемангиом весьма разнообразны. Это, прежде всего:
- нарушение трофики конечностей;
- изъязвление;
- инфицирование;
- кровотечение.
Гемангиомы обнаруживаются сразу же после рождения ребенка, отличаются интенсивно бурным ростом (рост опухоли, как правило, значительно опережает рост ребенка).
В лечении гемангиом используются различные методы или их комбинации:
- консервативная терапия (β-адреноблокаторы, кортикостероиды, цитостатики):
- хирургическая терапия (наиболее радикальный и в большинстве случаев безрецидивный метод лечения этой патологии):
оперативное удаление;
электрокоагуляция (чаще используется только при небольших простых гемангиомах);
криотерапия – неплохая альтернатива электрокоагуляции;
склерозирующая терапия – это введение в ткань опухоли веществ, вызывающих склероз и запустевание сосудов опухоли. Чаще всего это спиртовой раствор 30-50% концентрации или суспензии гормональных препаратов;
эмболизация питающих сосудов;
- комбинированное лечение – применение нескольких методов при лечении одного пациента.
Гемангиомы у детей не озлокачествляются.
Доброкачественные опухоли у детей. Лимфангиома
Лимфангиома – это врожденная доброкачественная опухоль из лимфатических сосудов. Наблюдается значительно реже гемангиомы. Излюбленные локализации: шея, подмышечная впадина, лицо, дно полости рта и язык. 85% этих новообразований диагностируются в возрасте до года.

Классификация:
1. Простая – слегка возвышается над поверхностью кожи, границы нечеткие, пальпация безболезненна.
2. Пещеристая (кавернозная) – поражение кожи, мышц, межмышечных пространств. Имеет множество полостей, выстланных эндотелием, а между ними соединительные тяжи с мышечными волокнами и жировыми клетками.
3. Кистозная – наиболее часто встречающаяся форма. Опухоль локализуются вблизи крупных сосудистых пучков, поэтому типичными наружными локализациями для нее являются боковая поверхность шеи, подмышечная область, внутренняя поверхность плеча, передневнутренняя поверхность бедра. Для внутренних локализаций характерно поражение брыжейки кишечника и средостения.
4. Системная – проявляется поражением одной или двух конечностей на всем протяжении с прорастанием всех тканей, вплоть до надкостницы. Кожа изменена.
Осложнениями лимфангиом являются сдавление жизненно важных органов, а при присоединении инфекции и нагноении – сепсис.
Оперативное лечение наиболее эффективно.
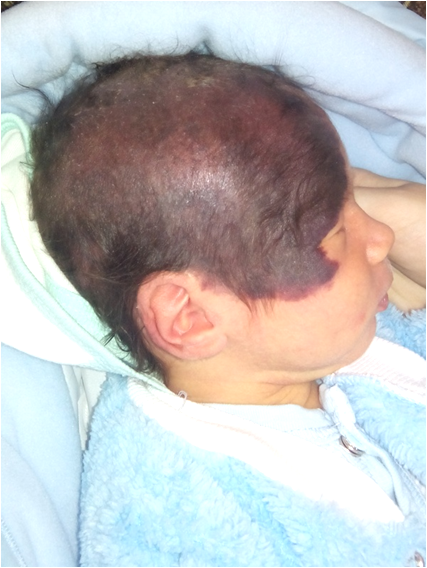
Доброкачественные опухоли у детей. Невусы
Невусы - врожденные образования кожных покровов или появившиеся во внеуторобном периоде (приобретенные), в основе возникновения которых лежат изменения эмбрионального характера. В отдельных случаях их них могут возникать злокачественные опухоли. Растут до определенного момента, обычно к возрасту половой зрелости рост прекращается. Имеется наследственная предрасположенность. Иногда наличие невусов сочетается с пороками развития внутренних органов, нервной системы, костей, зубов, дистрофическими и эндокринными расстройствами.
Различают следующие невусы и невоидные пятна:
1. Сосудистые и ангиомные.
2. Пигментные.
3. Гиперкератотические.
4. Аденоматозные.
5. Цистоматозные и атероматозные.
6. Фиброматозные.
7. Невоидные.
Учитывая существующую возможность злокачественного перерождения пигментных новообразований существуют клинические признаки малигнизации. Прежде всего это:
- увеличение образования в размерах в течение короткого промежутка времени;
- изменение окраски в более темную сторону;
- появление дочерних элементов;
- уплотнение и инфильтрация;
- изъязвление и кровоточивость;
- боли и зуд;
-
увеличение регионарных лимфоузлов.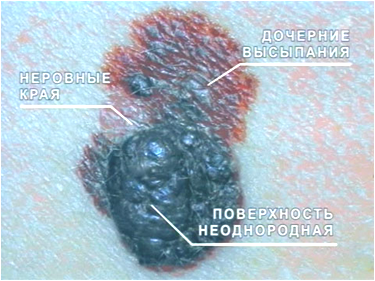
При появлении одного или нескольких признаков показано оперативное лечение – удаление образования с последующим гистологическим исследованием. Наиболее опасны в плане малигнизации гладкие невусы без волос. Определенную роль может играть постоянная механическая травматизация.
Доброкачественные опухоли у детей. Опухоли из зародышевой ткани
Для опухолей, возникающих из зародышевой ткани характерно множество гистологических субтипов и разнообразие предложенных классификаций, сложность которых можно сравнить лишь с неходжкинскими лимфомами.
Человеческий эмбрион – первое скопление половых клеток, которое может определяться в желточном мешке на 4-ой неделе развития. Отсюда клетки мигрируют через среднюю и дорсальную брыжейку и могут наблюдаться в зародышевом эпителии полового тяжа в течение 6-и недель. Затем из этой популяции клеток формируются яички или яичники.
Наиболее часто встречающиеся экстрагонадные локализации опухолей из зародышевой ткани (такие как крестцово-копчиковая область, забрюшинное пространство, средостение, шея и шишковидное тело головного мозга) подтверждают, что аберантное перемещение происходит вдоль полового тяжа, который соседствует с позвоночным столбом, в направлении от шейной до нижней поясничной области. Это наводит на мысль, что злокачественная трансформация, происходящая в то время, когда гонадная ткань проходит нормальный путь развития, связана с отсутствием или недостаточным количеством контролирующих рост факторов в экстрагонадных зонах внедрения клеток полового тяжа. В детском возрасте опухоли из зародышевой ткани в 70% случаев имеют экстрагонадную локализацию.
Злокачественные герминогенные опухоли составляют около 4% среди всех злокачественных опухолей у детей, а частота встречаемости – 0,7 случая на 100 тыс. детского населения в год. В литературе имеются сведения о возможном влиянии факторов внешней среды на процесс возникновения отдельных опухолей. Отмечается 2 пика заболеваемости. Первый в возрасте до года (за счет тератом крестцово-копчиковой области), второй, менее выраженный, у детей от 8 до 14 лет (за счет девочек с тератомами яичников). Девочки несколько чаще болеют, чем мальчики (1,0:0,8).
Наиболее часто встречаются опухоли яичников (27%), затем следуют тератомы крестцово-копчиковой локализации (24%), далее – новообразования яичек (18%), ЦНС (18%) и прочие.
Естественно, клинические проявления заболевания зависят от локализации опухоли:
Центральная нервная система: головные боли, рвота, головокружение, гемипарез, нарушение походки, нарушение зрения и другие симптомы.
Яичники: увеличение живота в объеме, боли в нижних отделах живота, наличие пальпируемой опухоли, реже дисменорея и вирилизация. В случае возникновения острого перекрута яичника, появляется клиника «острого» живота и необходимо выполнение экстренной лапаротомии.
Яички: плотная бугристая, безболезненная опухоль, занимающая либо весь орган, либо один из его полюсов, иногда с инфильтрацией семенного канатика и увеличением паховых лимфоузлов. В отдельных случаях опухоль сопровождается гидроцеле и заболевания следует дифференцировать между собой.
При локализации в крестцово-копчиковой области:
а) наружные опухоль в крестцово-копчиковой области, распространяющаяся на одну из ягодиц; для злокачественных характерна напряженность, гиперемия, выраженный венозный рисунок;
б) внутренние – диагностируются поздно, часто проявляется нарушением функции тазовых органов (дизурия, запоры, вплоть до непроходимости);
в) смешанная форма прогностически более благоприятна.
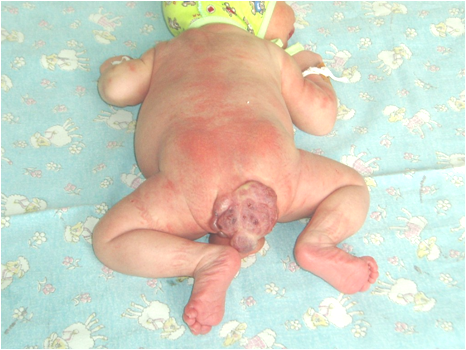
При других локализациях опухолей из зародышевой ткани клинические проявления напрямую связаны с первичной локализацией.
Тератомы могут быть следствием пороков развития тканей одного зародыша или плодом-паразитом. В первом случае выделяют: хористомы (нарушение отщепления и погружения листков), гамартомы (неправильное соотношение различных тканей в органе), а также сохранение эмбриональных структур, которые в норме должны полностью редуцироваться (остаточные элементы щито-язычного протока, жаберных щелей, дивертикул Меккеля и т.д.).
Опухоли из зародышевых клеток относятся к многокомпонентным образованиям содержащим клетки или ткани всех трех зародышевых листков. В соответствии с гистологической классификацией А.И.Абрикосова выделяют различные доброкачественные варианты относятся: различные тератомы (гистиоидные, органоидные, организмоидные), дермоидные кисты, энтерокистомы и т.д.
Биохимическими маркерами этой группы опухолей является: Альфафетопротеин (АФП), человеческий хорионический гонадотропин (b-HCG).
Повышение АФП наиболее выражено при опухолях желточного мешка, эмбриональных карциномах, нарастание b-HCG – при тератобластомах с трофобластическим компонентом (хорионкарциномах), тератобластомах низкой и средней степени дифференцировки. Истинные семиномы данные маркеры не продуцируют. Определение этих показателей в динамике может носить прогностический характер в отношении радикальности операции и наличия метастатических очагов.
Ведущими методами в диагностике патологии являются рентгенологические методы, ультразвуковое исследование и компьютерная томография. Прогноз зависит от радикальности операции. Оперативному лечению в ранние сроки подлежат больные с доброкачественными герминогенными опухолями ввиду возможности быстрой малигнизации. При своевременном адекватном лечении 3-5 летняя безрецидивная выживаемость колеблется от 45% до 85% в зависимости от стадии и морфологического варианта опухоли.
Доброкачественные опухоли у детей. Дермоидные и эпидермоидные кисты
Дермоидные и эпидермоидные кисты у детей встречаются относительно редко (3,4%). Они почти всегда возникают на ранних этапах развития, являясь дизонтогенетическими образованиями. Дермоиды относятся к группе органоидных и гистиоидных тератом, так как по своему строению состоят из тканей различных органов. Представляют собой кисты с соединительнотканной капсулой, покрытой многослойным плоским эпителием, соответствующим эпидермису кожи. В стенке бывают волосы, сальные и потовые железы. Полость заполнена продуктами сальных и потовых желез, слущенным эпителием.
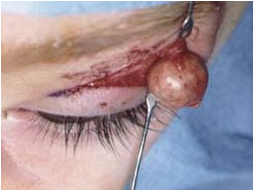
В динамике отмечается склонность к увеличению в результате скопления содержимого. Если порок развития затрагивает все производные кожи - формируется дермоидная киста, а если только эпидермис - эпидермоидная (эпидермальная) киста. Наряду с этим, эпидермальные кисты могут возникнуть из внедрившегося в результате травмы покровного эпителия.
Встречаются кисты как наружной, так и внутренней локализации. Следует подчеркнуть, что излюбленной локализацией наружных кист являются места слияния и зарастания эмбриональных щелей: наружный и внутренний край глазницы, яремная ямка, средняя линия шеи, волосистая часть головы (в основном проекция стреловидного шва). Реже они локализуются в заушной области, полости рта, на переносице.
Клиника. Обычно на первом-втором году жизни обнаруживается опухолевидное образование одной из вышеперечисленных локализаций. Оно округлой формы (реже слегка вытянутой), располагается подкожно, малоподвижное, не спаянное с кожей, упруго-эластической или тестоватой консистенции, безболезненное при пальпации. Обычно кожа над образованием не изменена (если нет воспалительных явлений). При расположении кисты на черепе очень часто возникает вдавление наружной пластинки, а пальпируемое образование почти всегда бывает неподвижным. Кисты внутренней локализации могут наблюдаться в переднем средостении, легких, печени, селезенке, яичниках, иногда в брыжейке кишечника.
Среди осложнений чаще всего встречается воспаление и нагноение кисты. Редко возможна малигнизация, которая отмечается, судя по данным литературы у подростков и взрослых. Последней предшествует быстрый рост и изъязвление кожи в зоне кисты.
Злокачественные опухоли у детей. Саркомы мягких тканей
Злокачественные опухоли мезенхимального происхождения. Чаще встречаются рабдомиосаркомы, реже лейомиосаркомы, злокачественные мезенхимомы, липосаркомы. Рабдомиосаркома чаще поражает мочевой пузырь, влагалище, мягкие ткани головы, шеи, орбиты и ЛОР-органы. Ангиогенные саркомы локализуются на лице и туловище, синовиальные и фибросаркомы поражают конечности.

Располагаясь в мягких тканях, эти опухоли имеют характерные местные проявления. При локализации в области туловища и конечностей опухоль плотная (в большинстве случаев каменистой плотности), чаще округлой или овальной формы, без четких границ, малоподвижная, безболезненная. Кожа над опухолью имеет характерный внешний вид: она чаще «восковидная», с выраженным подкожным венозным рисунком. При прорастании нервных сплетений, магистральных нервных стволов и сосудов болевой синдром может усиливаться и быстро прогрессировать.
С целью установления диагноза может быть использован широкий круг специальных методов исследования. Среди них: обзорная рентгенография, ультразвуковое исследование, ангиографические методы, компьютерная томография и магнитно-резонансная томография. Окончательный диагноз устанавливается в результате патогистологического исследования материала, полученного во время оперативного вмешательства (при удалении опухоли или открытой ее биопсии).
Дифференцировать заболевание часто приходится с костными саркомами, так как при расположении мягкотканых злокачественных опухолей в области конечностей и туловища часто возникают вторичные поражения костей.
Для опухолей характерно очень раннее метастазирование в регионарные лимфатические узлы, далее процесс распространяется гематогенным путем.
Окончательный диагноз любой злокачественной опухоли устанавливается после ее гистологического исследования!
Лечение сарком мягких тканей комбинированное (операция, полихимиотерапия, лучевая терапия). Результаты лечения во многом зависят от стадии процесса на момент выявления опухоли и полноты удаления первичного очага. Радикальная операция дает пациенту значительно больше шансов для конечного выздоровления.
Злокачественные опухоли у детей. Нефробластома
Нефробластома (опухоль Вильмса) – это злокачественная опухоль почки, развивающаяся из метанефрогенной ткани.
Особенности опухоли Вильмса:
- частота встречаемости у детей 1 случай на 100 тыс. населения
- наиболее часто выявляется между 1 и 4 годами жизни
- не имеет половой диспозиции
- самая низкая частота отмечается в Азии по сравнению с Европой и США
- ассоциируется с пороками развития (аниридия, гемигипертрофия, урогенитальные пороки развития и т. п.)

Эмбpиoнaльная опухоль гистологически дифференцируется на три подтипа: низкой, средней и высокой степени злокачественности в соответствии с принятой в 1996 году Стокгольмской классификацией. Морфологически выделяют типичные варианты (с равномерным наличием двух компонентов), с преобладанием эпителиального или с преобладанием мезенхимального компонентов.
Ведущим симптомом заболевания является безболезненно нарастающая пальпируемая опухоль. В подавляющем большинстве случаев ее самостоятельно определяют родители и лишь у 10 % пациентов активно (на профилактическом осмотре) обнаруживают врачи.
Для опухоли Вильмса характерна гематурия. Подтверждается поражение почки при ультразвуковом исследовании, проведении компьютерной томографии.
Первичная биопсия опухоли при несомнительном диагнозе у детей старше 6 месяцев и младше 16 лет не показана. Гистопатологический диагноз устанавливается после нефруретерэктомии, которая является обязательным компонентом лечения.
Лечебная тактика:
- предоперационная полихимиотерапия;
- операция – нефруретерэктомия (доступ - срединная или поперечная лапаротомия);
- полихимиотерапия – этапные курсы в течение 2-х лет после операции;
- телегамматерапия;
- динамическое наблюдение до 5 лет после операции при отсутствии данных в пользу прогрессирования процесса.
Злокачественные опухоли у детей. Нейробластома
Нейробластома – злокачественная опухоль, исходящая из эмбриональных нейробластов симпатической нервной системы. Является самой частой экстракраниальной солидной опухолью детского возраста. Нейробластомы относятся к эмбриональным опухолям, поэтому их развитие связано с ранним детским возрастом.
Около 1/3 детей заболевают на первом году жизни, с убыванием частоты в последующие годы. 90% пациентов заболевают в возрасте моложе 6 лет. Половое преобладание не наблюдается.
Нейробластомы являются собирательным понятием. По клеточному составу выделяют: симпатогониому, симпатобластому, ганглионейробластому, ганглионеврому.
Нейробластомы могут развиваться везде, где расположена симпатическая ткань: надпочечник, шея, заднее средостение и забрюшинное пространство. Более 50% всех нейробластом в момент диагноза уже являются метастатическими.
Особенности нейробластом:
- растет в любом месте, где есть симпатические ганглии;
- гормонально активные опухоли, продуцирующие катехоламины и их метаболиты (дофамин, ДОФА, гомованилинминдальная и гомованилиновая кислоты);
- клинические признаки: вялость, сонливость, раздражительность, повышенная потливость, мраморность кожи, выпадение волос, тахикардия, гипертония, диарея;
- местные симптомы зависят от локализации опухоли: синдром Горнера (птоз, миоз, энофтальм), парезы и параличи, гепатомегалия и множественные подкожные узелки.
Для диагностики используют ультразвуковое исследование, компьютерную и магнитно-резонансную томографию, остеосцинтиграфию костей скелета, пункцию костного мозга, трепанбипсию, определение уровня катехоламинов мочи, в крови - ферритина, лактатдегидрогеназы, нейроспецифической энолазы.
Более 50% всех нейробластом в момент установления диагноза уже являются метастатическими. Метастазирование преимущественно гематогенное: в костный мозг (73%), кости (68%), печень (24%), лимфоузлы (44%), головной мозг (9%), кожу (1%).
Лечение комбинированное: хирургическое, полихимиотерапия и телегамматерапия.
Злокачественные опухоли у детей. Опухоли костей
Остеогенная саркома – злокачественная первичная опухоль костей у детей, происходящая из примитивной полипотентной соединительной ткани, способной к образованию опухолевого остеоида кости.
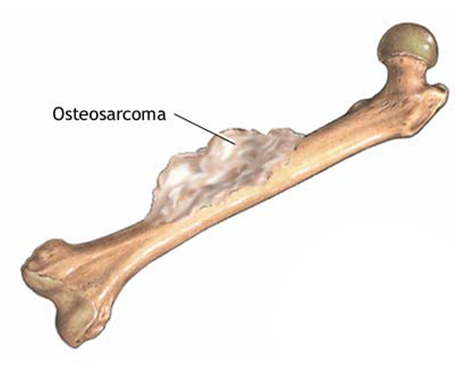
Заболевают чаще дети после 5 лет, в основном мальчики. Чаще поражаются длинные трубчатые кости. Характерным симптомом являются ночные боли в области кости. Конечность увеличивается в объеме, появляется припухлость, пальпируемая опухоль, расширение подкожных вен, патологический перелом.
Метастазирует в легкие, печень, другие кости.
Рентгенологически различают 3 формы:
- остеобластическую - выраженное костеобразование, спикулярная реакция или игольчатый периостит, т. е. разрастание периоста в виде иголок, симптом «козырька»
- остеолитическую – преобладание деструктивных процессов
- смешанную
Кроме рентгенологического исследования для верификации диагноза также проводится компьютерная томография, остеосцинтиграфия, биопсия опухоли.
Саркома Юинга – злокачественная опухоль скелета, в основу которой лежит неостеогенная ткань. Относится к первичным примитивным нейроэктодермальным опухолям. Занимает по частоте второе место после остеогенной саркомы. Наивысшая заболеваемость наблюдается в возрасте 10-13 лет. Около 20% детей поступают в стационары с первично-метастатическими формами. Опухоль поражает любую кость, но преимущественно диафизы длинных трубчатых костей, может встречаться в плоских костях (ребра, таз).
Чаще встречается у мальчиков. Клиника сходна с остеогенной саркомой. Рентгенологически характерен луковичный периостит (симптом луковичной кожуры, т. е. слоистый периостит).
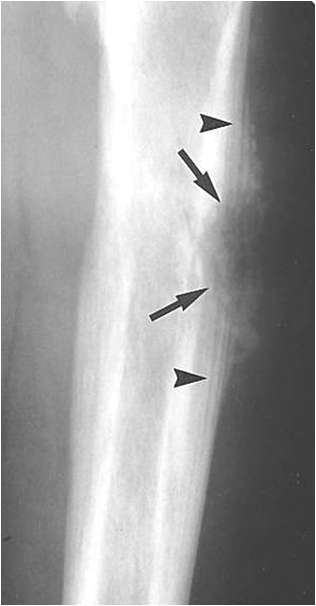

Для верификации диагноза также проводится компьютерная томография, остеосцинтиграфия, биопсия опухоли.
Лечение комбинированное: хирургическое, полихимиотерапия и телегамматерапия.
Принципы терапии в детской онкологии. Химиотерапия
Первичная цель химиотерапии рака состоит в том, чтобы максимизировать противоопухолевый эффект на фоне уменьшения побочных эффектов (токсичность). Эту цель особенно трудно достичь по крайней мере по двум причинам. Во-первых, дозы химиопрепаратов, которые воздействуют на опухолевые клетки, могут оказывать повреждающее действие и на нормальные пролиферирующие клетки костного мозга и желудочно-кишечного тракта. Во-вторых, выбор соответствующих препаратов и доз для лечения конкретной опухоли или больного осуществляется эмпирически потому, что в настоящее время существуют лишь немногие системы для рационального выбора у конкретного пациента (пример с определением клиренса).
Комбинированная химиотерапия. Поскольку рак – это болезнь клона и не все клетки в опухоли одинаково чувствительны к конкретному химиотерапевтическому препарату, то применение комбинации химиотерапевтических средств позволило достичь более длительных ремиссий и повышение частоты излечения, по сравнению с результатами монохимиотерапии.
Химиотерапевтические программы. Комбинированная химиотерапия проводится с перерывами, чтобы учесть возможность восстановления нормальных тканей, поврежденных в результате лечения. Время между циклами минимизировано, чтобы уменьшить возможность распространения злокачественной ткани. Главным образом, комбинированная химиотерапия проводится с интервалами в 21 день. Этот срок учитывает необходимое время для восстановления костного мозга и желудочно-кишечного тракта так, чтобы к концу двадцать первого дня анализы периферической крови нормализовались и прошли вторичные воспалительные изменения в слизистых, вызванные химиотерапией. С соблюдением этого подхода разработано большинство химиотерапевтических программ для лечения детей с солидными опухолями.
Интенсивность дозы. Вопрос об интенсивности лечения подчиняется следующему принципу: какие максимально допустимые дозировки химиопрепаратов должны назначаться, чтобы получить наибольший ответ опухоли? Интенсивность может усиливаться как за счет увеличения дозы препарата, так и за счет сокращения интервала между курсами. Например, если доза циклофосфамида повышается вдвое, то достигается десятикратное увеличение гибели опухолевых клеток. Такие выводы были сделаны и при исследовании опухолей детского возраста in vivo. Например, при рабдомиосаркоме. Рекомендованная стандартная дозировка в рамках первого международного исследования рабдомиосаркомы (IRS-I) составляла 900 мг/м2. Однако, при выполнении IRS-IV она была уже 2200 мг/м2, то есть было рекомендовано увеличение дозы в 2,4 раза по сравнению с IRS-I. Последующие клинические испытания будут стремиться увеличить использование интенсивных программ химиотерапии за счет параллельного применения препаратов, защищающих функцию костного мозга (цитокины) и сердца (кардиопротекторы).
Непрерывность воздействия. Большинство химиотерапевтических препаратов уничтожает клетки в определенной фазе клеточного цикла, и поэтому являются средствами различных периодов. Однако в любое время только часть клеток опухоли находится в соответствующей стадии цикла. Таким образом, специфические препараты, действующие в определенные фазы цикла, способны уничтожить за короткий период только малую часть опухолевых клеток. Это положение было обосновано отдельными исследователями, которые показали, что более продолжительное воздействие на опухоль препаратами определенной фазы цикла давало большую эффективность лечения.
Продолжительность лечения. За предшествующие 20 лет продолжительность химиотерапии при большинстве наиболее распространенных солидных опухолей детского возраста значительно уменьшилась. В результате проведенных рандомизированных клинических испытаний при опухоли Вильмса или саркомы Юинга, продолжительность лечения при многих солидных опухолях теперь уменьшена до 1 года или менее. В будущем клинические испытания при злокачественных опухолях у детей подразумевают отражение главной цели – сокращения продолжительности лечения без ущерба его эффективности.
Адъювантная химиотерапия. Развитие и использование адъювантной химиотерапии явилось главным шагом в лечении большего количества детей с неметастазировавшими солидными опухоли. Адъювантная химиотерапия ставит своей целью лечение пациента с новообразованием без значимых метастазов после удаления первичной опухоли. В этом урегулировании химиотерапия решает задачу устранения болезни, не обнаружимой стандартными радиографическими методами вне первичного опухолевого очага. Чтобы определить роль адъювантной химиотерапии, было проведено международное исследование, в рамках которого было изучено течение заболевания у пациентов с остеосаркомой после удаления первичной опухоли с последующей адъювантной терапией и без нее. Среди больных, которые получили адъювантную химиотерапию, удельный вес выживших без рецидива заболевания составил 66%, а среди тех, кому было проведено только хирургическое удаление опухоли - 17%.
Сегодня адъювантная терапия – хорошо закрепившийся принцип лечения большинства солидных опухолей у детей. Препараты, использующиеся в адъювантной терапии, являются эффективными противоопухолевыми средствами.
Неоадъювантная (первичная) химиотерапия. Один из способов ускорить назначение лекарственного лечения у пациентов с солидными опухолями без отдаленных метастазов состоит в том, чтобы отложить оперативное вмешательство и предварительно провести первичную химиотерапию. Последняя известна как неоадъювантная химиотерапия и преследует своей целью, как можно раньше воздействовать на микрометастазы, в то время, когда отдаленное распространение опухоли минимально. Другая цель неоадъювантного лечения состоит в воздействии на первичную опухоль, что может в результате сокращения размеров опухоли сделать хирургическое удаление возможным или менее вредным, а также позволит уменьшить размеры лучевого поля или суммарную дозу облучения.
Химиотерапия метастатической болезни. Вообще дети с солидными опухолями, у которых имеется метастатическая болезнь, имеют менее чем 40% шансы для длительного выживания без рецидива заболевания. Большинство детей с метастатической болезнью имеют высокий риск ее повторения или прогрессии. Несмотря на появление препаратов, которые высокоэффективны для профилактики диссеминации у пациентов с отсутствием метастазов, эти же средства не излечивают большинство детей с метастатической болезнью при первичной диагностике. Было высказано предположение, что относительная неэффективность лечения метастатической болезни только химиотерапией связана с малым проникновением химиопрепаратов в крупные опухолевые массы и более низким удельным весом активно делящихся клеток. Чтобы преодолеть эти проблемы, некоторые исследователи развили высоко агрессивный подход к детям с метастатической болезнью. Была тенденция выполнять, если возможно, удаление метастазов у пациентов с метастатической болезнью при установлении диагноза и назначать высокодозную химиотерапию.
Химиотерапия может назначаться и с целью усиления эффективности лучевой терапии. Разработка рациональных программ химиотерапии и клинических испытаний выполняется на основе знаний о механизме действия препаратов, их метаболизма и профиля токсичности. Большинство препаратов, использующихся в лечении опухолей у детей, влияют на синтез или функцию ДНК или РНК в злокачественных и нормальных клетках. Таким образом, эти лекарства не только могут убивать опухолевые клетки, но и оказывать нежелательное воздействие на нормальную ткань. Очень важно знание метаболизма химиотерапевтических средств. Некоторые препараты проходят метаболизм и активируются в определенном участке или органе и удаляются из организма одним или несколькими органами. Процессы активации и выведения агентов требуют нормального функционирования органа (например, печень для циклофосфамида) и поэтому детям с печеночной или почечной недостаточностью нельзя назначать некоторые препараты.
Принципы терапии в детской онкологии. Поддерживающая терапия
Предотвращение серьезных побочных эффектов, вторичных к химиотерапии – важный момент в детской онкологии. Органы, которые являются особенно уязвимыми к эффектам химиотерапии: костный мозг, желудочно-кишечный тракт, печень, почки, легкие и сердце. Несколько стратегий были развиты, чтобы адресовать побочные эффекты, которые происходят в этих органах.
Приведем конкретные примеры наиболее выраженного повреждающего действия отдельных химиотерапевтических агентов в отношении органов и систем:
Почки – метотрексат и фосфамид.
Легкие – бисульфан и блеомицин.
Кардиотоксичность – доксорубицин и дактиномицин.
Желудочно-кишечный тракт – антрациклины и дактиномицин (колит, диарея).
Глубокое угнетение костного мозга, которое возникает после проведения полихимиотерапии, может корригироваться введением колониестимулирующего фактора, пересадкой костного мозга или стволовой кроветворной клетки.
Принципы терапии в детской онкологии. Лучевая терапия
Лучевая терапия – высокоэффективный метод лечения многих солидных опухолей у детей. Лучевое воздействие вызывает повреждение ДНК, прежде всего, в опухолевых клетках. Современные лучевые установки значительно более избирательно действуют на опухоль и обладают меньшим повреждающим действием на здоровые ткани организма. Отметим, что далеко не все опухоли детского возраста требуют назначения лучевого лечения. Иногда оно показано у всех больных (остеогенная саркома), а иногда только при локальных рецидивах и отдаленных метастазах (нефробластома). В каждом конкретном клиническом случае показан индивидуальный подход.
Интерактивный блок тема 1.1 Закрытые и открытые повреждения органов брюшной полости у детей
Введение
Травма является главной причиной детской смертности в возрасте старше 1 года. Среди всех травм самые тяжелые возникают вследствие дорожно-транспортных происшествий и падений с большой высоты. Как правило, такие тяжелые повреждение сопровождаются травмой нескольких органов разных систем организма (сочетанная травма). Часто, на фоне скелетной и черепно-мозговой травмы, сочетанные повреждения внутренних органов грудной клети и брюшной полости выявляются позже, чем при их изолированном повреждении, или вообще не выявляются, что значительно повышает летальность в этой группе пациентов.
В Украине каждый год вследствие различных травм погибает около 2000 детей, и в каждом четвертом случае причиной смерти является повреждение органов грудной клетки, в каждом пятом случае – травма органов брюшной полости. Ведущее место среди причин летальности занимает черепно-мозговая травма. Повреждения органов брюшной полости и грудной клетки, как и повреждения других органов и систем, встречаются чаще у мальчиков в возрасте 7 – 14 лет, что объясняется их активным и, часто, неконтролируемым поведением.
Травма органов брюшной полости, как и травма грудной клетки, подразделяется на закрытую и открытую.
При закрытой травме органов брюшной полости на первый план выходят два клинических синдрома: внутрибрюшное кровотечение (при повреждении паренхиматозных органов) и перитонит (при разрыве полых органов).
Разрыв селезенки
Среди органов брюшной полости у детей наиболее часто наблюдаются травмы селезенки (25-27 % всех травм).
Различают следующие виды повреждений селезенки:
поверхностные надрывы капсулы,
подкапсульные гематомы,
разрывы капсулы и паренхимы,
размозжение селезенки, отрыв селезенки от сосудистой ножки.
Основным и постоянным признаком повреждения селезенки является постоянная ноющая боль в левом подреберье и надчревной области. Дети младшего возраста не могут четко локализовать боль и чаще жалуются на разлитые боли. Дети старшего возраста начинают жаловаться на разлитые боли через некоторое время после травмы, что связано с распространением крови по брюшной полости. Однако наибольшая интенсивность болей сохраняется в проекции селезенки. Боль, как правило, усиливается при глубоком вдохе и иррадиирует в левое надплечье и лопатку. Реже отмечаются рвота и учащение дыхания. Переломы ребер при повреждениях селезенки у детей практически не встречаются. Наиболее типичным проявлением внутреннего кровотечения у детей являются бледность кожи и слизистых оболочек. При этом пульс и АД могут сохранять в пределах возрастной нормы в течение нескольких часов после травмы. Иногда дети занимают вынужденное положение: лежа на левом боку с поджатыми к животу коленями. Попытка изменить положение приводит к усилению боли, что заставляет ребенка вернуться в прежнюю позу – симптом «Ваньки-встаньки». При осмотре живота отмечается отставание его левой половины в акте дыхания, иногда видны ссадины в проекции селезенки. Болезненность и мышечное напряжение локализуются в левом подреберье, реже распространяются по всему животу. В некоторых случаях наблюдается несоответствие незначительного напряжения мышц и резкой болезненности при перкуссии живота - симптом Куленкампфа. В брюшной полости уже в ближайшее время после травмы можно определить свободную жидкость, что проявляется притуплением в отлогих местах брюшной полости. При ректальном исследовании можно определить скопление крови в малом тазу. В связи с тем, что в брюшную полость в основном изливается кровь, которая была депонирована в селезенке, в первые часы после травмы показатели красной крови (эритроциты, гемоглобин) изменяются незначительно. Более характерен для повреждений селезенки рост числа лейкоцитов, особенно в первые часы после травмы.
Диагностика разрыва селезенки
В диагностике повреждений селезенки помогают рентгенологическое, ультразвуковое исследование, компьютерная томография, лапароцентез или микролапаротомия с применением методики «шарящего катетера», лапароскопия. При стабильном состоянии ребенка УЗИ и КТ позволяют выявить локализацию, размеры и глубину разрыва селезенки, наличие подкапсульной гематомы или крови в брюшной полости. Оценить характер травмы селезенки позволяют также такие методы, как ангиография и радиоизотопное исследование, но они не получили широкого распространения в практической медицине. В случаях, когда состояние ребенка не позволяет произвести компьютерную томографию и ультразвуковое исследование, что чаще всего связано с наличием тяжелой сочетанной травмы, бессознательным состоянием, для подтверждения диагноза разрыва селезенки применяется методика «шарящего катетера». Это исследование подразумевает введение в брюшную полость через небольшой разрез по срединной линии под пупком катетера, с помощью которого определяется наличие в брюшной полости крови.
В настоящее время до 80-90 % детей с травмами селезенки лечится консервативным способом, который заключается в строгом постельном режиме в течение 10 – 14 дней, применении холода на область травмы, назначении инфузионной и гемостатической терапии. Такая тактика возможна благодаря особенностям строения селезенки у детей. В большинстве случаев кровотечение из паренхимы данного органа останавливается спонтанно. Проведение консервативного лечения допустимо только в специализированных лечебных учреждения, где есть возможность выполнения оперативного вмешательства в любой момент наблюдения, когда возникнут соответствующие показания.
Двухмоментный разрыв селезенки
Двухмоментный разрыв селезенки наблюдается при повреждении паренхимы без повреждения капсулы, что приводит к образованию подкапсульной гематомы, которая, при продолжающемся кровотечении, постепенно увеличивается в размерах, и через несколько часов или суток после травмы может самопроизвольно разорвать капсулу селезенки. При этом состояние ребенка ухудшается и развивается картина кровотечения в брюшную полость. При выявлении у ребенка подкапсульной гематомы селезенки показана госпитализация, консервативное лечение и постоянное наблюдение.
Лечение при разрыве селезенки
Оперативное лечение показано в случаях, когда, несмотря на проводимую инфузионную и гемостатическую терапию, состояние пострадавшего остается нестабильным (нарастают тахикардия – более 130 ударов в минуту, гипотония – систолическое давление менее 80 мм.рт.ст., снижены диурез, гематокрит, нарастает анемия). Одним из показателей нестабильной гемодинамики и продолжающегося кровотечения является необходимость переливания компонентов крови в объеме более 30-40 мл/кг. Методика оперативного лечения определяется степенью повреждения селезенки, но, по возможности, следует выполнять органосохраняющие операции, помня о высоком риске более тяжелого течения любых инфекционных и гнойных заболеваний у детей после спленэктомии.
Повреждения печени
Повреждения печени занимают второе место по частоте среди травм органов брюшной полости (15 – 17 %), но эти повреждения являются причиной половины летальных исходов, обусловленных травмой органов брюшной полости. Более чем в половине случаев травма печени сопровождается повреждением селезенки, травмой других органов и систем организма.
Повреждения печени можно разделить на три группы :
подкапсульные гематомы,
разрывы печени с повреждением капсулы,
центральные разрывы печени (центральные гематомы), при которых внутри паренхимы образуется полость, заполненная кровью и желчью.
Клиника, диагностика и лечение повреждений печени
В большинстве случаев состояние ребенка после травмы расценивается как тяжелое из-за развития шока. Основным симптомом повреждения печени является постоянная боль, чаще в правом подреберье или правой половине живота. Локализация повреждения также влияет на распространение болей. При повреждении купола печени боль локализуется в нижних отделах правой половины грудной клетки; при повреждении задней поверхности печени или ее отрыве от венечной связки боль распространяется в поясничную область; при повреждении нижней поверхности печени боль определяется ближе к пупку. Боль может иррадиировать в правое надплечье и лопатку, при распространении крови по правому боковому каналу, болезненность будет определяться в правой подвздошной области, над лоном. Часто после травмы появляется рефлекторная рвота. Иногда наблюдается рвота цвета кофейной гущи – следствие гемобилии (прорыва центральной гематомы в желчные ходы). Отмечается бледность кожных покровов, тахипноэ, тахикардия, снижение АД.
У большинства пострадавших определяется напряжение мышц передней брюшной стенки, положительный симптом Щеткина-Блюмберга, свободная жидкость в брюшной полости, позже появляются притупление в отлогих местах брюшной полости, вздутие кишечника. Симптомы раздражения брюшины становятся особенно выраженными и четкими при повреждении наружных желчных протоков и развитии желчного перитонита. Характерен симптом «пупка» - резкая болезненность при надавливании на пупок, возникающая вследствие натяжения круглой связки печени. Довольно быстро развивается анемия.
Для диагностики повреждений печени применяются те же методы, что и при травме селезенки: компьютерная томография, ультразвуковое исследование, методика «шарящего катетера», ангиография. Радиоизотопное исследование позволяет выявить травму желчных протоков. Компьютерную томографию необходимо проводить с применением контрастного вещества, которое позволяет определить области скопления крови, наличие активного внутрибрюшного кровотечения.
Наличие активного внутрибрюшного кровотечения и нестабильная гемодинамика являются показаниями к оперативному лечению, которое проводится в 20-30 % всех травм печени у детей. В большинстве случаев, как и при травме селезенки, кровотечение спонтанно останавливается и гемодинамические показатели стабилизируются, что позволяет проводить консервативное лечение. Одним из методов остановки артериального кровотечения из паренхимы печени, который активно разрабатывается в настоящее время, является ангиографическая эмболизация поврежденной артерии.
Повреждения поджелудочной железы
Повреждения поджелудочной железы у детей встречаются достаточно редко. Чаще они отмечаются при сочетанной травме органов брюшной полости и забрюшинного пространства. Повреждения поджелудочной железы возникают в результате форсированного удара в эпигастральную область (для детей наиболее характерен удар о руль велосипеда при падении) или в результате длительного сдавления верхней половины живота.
Клиника и диагностика повреждений поджелудочной железы
Сразу после травмы у детей появляются сильнейшие боли в эпигастральной области, развиваются коллапс и шок. Боли могут иррадиировать в поясничную область, в левый реберно-позвоночный угол, при значительных повреждениях боли носят опоясывающий характер. Возникает рвота, которая при развитии травматического панкреатита становится неукротимой. Пульс частый, слабого наполнения, АД в большинстве случаев не изменяется.
При осмотре живота можно обнаружить следы травмы в эпигастральной области (ссадины, кровоподтеки), живот отстает в акте дыхания, отмечается болезненность над пупком и слева, умеренное напряжение мышц живота, особенно выраженное в эпигастрии. Симптом Щеткина–Блюмберга слабо положительный. При динамическом наблюдении отмечается нарастание признаков раздражения брюшины. При двухмоментном повреждении поджелудочной железы в первые часы после травмы состояние ребенка относительно стабильное, отмечаются умеренные боли в эпигастрии, однократная рвота. Затем внезапно состояние ребенка ухудшается, появляются сильнейшие боли в животе, неукротимая рвота, развивается клиника шока.
Большое значение в диагностике повреждений поджелудочной железы имеют повторные определения уровня амилазы в крови и моче. В первые часы после травмы может происходить снижение уровня амилазы, что связано со спазмом сосудов железы. Затем, чем больше времени проходит с момента травмы, тем более выражено повышение активности фермента. Активность липазы в крови повышается только на 2–3 сутки после травмы.
Из дополнительных методов исследования для выявления характера повреждения поджелудочной железы могут быть применены компьютерная томография и ультразвуковое исследование.
Лечение при повреждениях поджелудочной железы
При подозрении на ушиб поджелудочной железы ребенок переводится на парентеральное питание, назначается строгий постельный режим и курс терапии, направленной на предупреждение развития панкреатита, каждые 4–6 часов определяется уровень амилазы в крови и моче. При отсутствии эффекта от консервативной терапии в течение суток, при выявлении обширного повреждения железы, при разрыве выводного протока железы показано проведение оперативного лечения. Методика оперативного вмешательства определяется характеров выявленных повреждений и может колебаться от дренирования полости сальниковой сумки до резекции дистальной части железы или создания панкреатикоеюноанастомоза. Послеоперационные осложнения (свищ, псевдокиста поджелудочной железы, абсцесс брюшной полости) наблюдаются в 10 – 25 % случаев.
Разрывы полых органов
Чаще травмируется, в силу анатомо-физиологических особенностей, тонкая кишка, а именно ее проксимальний отдел возле связки Трейца и дистальний отдел подвздошной кишки.
Изолированные проникающие разрывы желудка и толстой кишки наблюдаются очень редко.
Самые частые механизмы повреждения:
раздавливание (между передней брюшной стенкой и позвоночником) - краш-травма;
разрыв брыжейки или брыжеечного края кишки;
разрыв перерастянутой кишечной петли.
Закрытые повреждения бывают проникающими и непроникающими.
При проникающих разрывах развивается клиника перитонита.
Повреждение полых органов брюшной полости (желудка и кишечника) чаще всего обусловлено открытыми проникающими ранениями, но у 2 – 6 % пациентов с тупой травмой живота происходит повреждение именно этих органов.
Разрыв желудка
Клиническая картина разрыва желудка характеризуется тяжелым шоком и быстрым развитием перитонита. Появляются резкие боли, особенно выраженные в эпигастральной области, частые позывы на рвоту, рвотные массы при этом скудные, могут содержать примесь крови. Живот не участвует в акте дыхания, определяются мышечное напряжение и положительный симптом Щеткина-Блюмберга, при перкуссии нередко определяется исчезновение границ печеночной тупости.
Рентгенологически в брюшной полости выявляется свободный газ. Тупая травма живота может сопровождаться образованием гематомы в стенке желудка, надрывами слизистой или серозно-мышечной оболочки желудка. При этих повреждениях состояние ребенка после травмы может быть тяжелым, однако противошоковая терапия быстро приводит к улучшению состояние больного, клиническая картина перитонит не развивается. При повреждении серозно-мышечного слоя могут развиться признаки внутрибрюшного кровотечения.
При разрывах желудка показана срочная лапаротомия, обнаруженный разрыв желудка или надрыв серозно-мышечного слоя ушивается двухрядным швом.
Разрыв кишечника
Повреждения кишечника подразделяются на ушибы, сопровождающиеся образованием гематом в стенке кишки или надрывами стенки; полные разрывы стенки кишки с поступлением ее содержимого в брюшную полость. Редким видом травмы кишечника является его отрыв от брыжейки.
Как при закрытых, так и при открытых травмах живота полный разрыв кишечника сопровождается развитием клинической картины перитонита. Ребенок жалуется на боли в животе, которые почти всегда сопровождаются рвотой. Общее состояние ребенка тяжелое. Он бледен, адинамичен, черты лица заостряются, пульс частый, слабого наполнения, повышается температура тела. При пальпации живота определяется резкая болезненность над местом повреждения, с развитием перитонита боль распространяется по всему животу. Выявляются разлитое мышечное напряжение и положительный симптом Щеткина – Блюмберга.
На обзорной рентгенограмме органов брюшной полости, которую необходимо выполнять в вертикальном положении пациента, или в латеропозициии при положении лежа, определяется свободный газ в брюшной полости. Однако отсутствие этого признака не исключает повреждение полого органа. В некоторых случаях перфорация кишечника может быть прикрытой или небольших размеров, что ведет к более медленному развитию перитонита.
При повреждениях кишечника в первые часы отмечается умеренный лейкоцитоз со сдвигом лейкоцитарной формулы влево. По мере развития перитонита лейкоцитоз и сдвиг влево нарастают.
Ушибы стенки кишки могут протекать бессимптомно, однако наличие гематомы в стенке кишки может привести к некрозу стенки, ее перфорации и развитию перитонита. Особенности клинического течения отмечаются при повреждении забрюшинной части двенадцатиперстной кишки. В первые часы послетравмы единственными проявлениями повреждения могут быть жалобы на умеренные боли в эпигастральной области, связанные с формированием забрюшинной гематомы. Однако со временем интенсивность болей нарастает, они локализуются несколько выше и правее пупка. Ухудшение состояния ребенка, появление рвоты, повышение температуры до 38-39°, нарастание явлений интоксикации связано с формированием забрюшинной флегмоны. В эпигастральной области определяется мышечное напряжение и резкая болезненность при пальпации. Боли могут определяться и в поясничной области справа.
При подозрении на травму забрюшинной части двенадцатиперстной кишки показано проведение рентгенографии с водорастворимым контрастным веществом – при проникающих разрывах контрастное вещество выходит за пределы двенадцатиперстной кишки.Причинами разрыва прямой кишки у детей могут быть: падение областью промежности на острый предмет, переломы костей таза, повреждения при ректальном измерении температуры или введении газоотводной трубки.
Разрыв внутрибрюшной части прямой кишки сопровождается сильными болями внизу живота и области промежности, рвотой, повышением температуры, мышечным напряжением и положительными симптомами раздражения брюшины в нижних отделах живота. Могут отмечаться кровянистые выделения из прямой кишки.
Травмы почки
Травмы почки можно разделить на две группы: легкие (ушиб почки, подкапсульная гематома, разрыв паренхимы почки без повреждения чашечно-лоханочной системы) и тяжелые (глубокие разрывы с повреждением выделительной системы, повреждения сосудистой ножки, размозжение почки).
Основным клиническим проявлением травмы почки является гематурия, которая наблюдается у 95 % пациентов. Этот симптом может отсутствовать в случае повреждения сосудистой ножки почки или пиелоуретрального сегмента. Необходимо отметить, что такой симптом, как микрогематурия наблюдается очень часто при травме органов брюшной полости, ушибе передней брюшной стенки. Для тяжелого повреждения почки более характерна макрогематурия, интенсивность которой нарастает, тогда как при легких травмах гематурия довольно быстро исчезает. Также почти у всех пострадавших отмечается боль в животе или поясничной области, однако, необходимо помнить о том, что дети плохо локализуют боль, что может быть причиной диагностической ошибки. Появление припухлости в поясничной области свидетельствует о формировании забрюшинной гематомы или урогематомы. Тяжелые травмы почки и наличие сочетанной травмы (повреждение селезенки или печени) может проявляться симптомами шока.
Диагностика и лечение травмы почки
Во всех случаях подозрения на травму почки (нарастающая гематурия, наличие урогематомы, тяжелая травма живота или нижних отделов грудной клетки, переломы нижних ребер) необходимо применение дополнительных методов исследования. Наиболее объективными являются компьютерная томография с контрастированием и экскреторная урография. Своевременное выделение контраста почками и отсутствие выхода контраста за пределы почки позволяют исключить тяжелую травму и назначить консервативную терапию. При определении показаний к оперативному лечению необходимо учитывать насколько стабильным является состояние пациента, а также возможность сочетанной травмы. Нестабильность жизненных показателей и нарастание урогематомы являются показаниями к проведению операции. Важным преимуществом экскреторной урографии является возможность оценить наличие и функцию второй почки, так, описаны случаи удаления единственной почки при ее травме.
Эффективным методом определения степени повреждения почки и показаний к оперативному лечению является ангиография. Особую ценность этот метод играет при подозрении на травму сосудов почки. Тромбоз почечной артерии, продолжающееся активное кровотечение, деваскуляризация сегментов почки также являются показаниями к операции. Травма крупных сосудов почки обуславливает развитие 90 % поздних осложнений – артериовенозные свищи, инкапсулированная гематома, гипертензия.
Важной особенностью оперативного лечения повреждений почек является эффективный сосудистый контроль, позволяющий остановить кровотечение во время операции. Лигатуры под сосуды почки необходимо подводить за пределами почечных фасций, вблизи места их соединения с аортой и нижней полой веной. Такая манипуляция позволяет в три раза снизить число нефрэктомий при оперативном лечении травм почки.
Травмы мочевого пузыря
Травмы мочевого пузыря возникают вследствие падения ребенка на живот при наполненном мочевом пузыре или при переломе костей таза. В зависимости от локализации повреждения, полные разрывы стенки мочевого пузыря делятся на внутри- и внебрюшинные. Внебрюшинные разрывы выявляются в 3 – 4 раза чаще. Одним из видов травмы являются надрывы только слизистой оболочки мочевого пузыря, которые проявляются гематурией и больной в надлобковой области. Так как разрыв мочевого пузыря часто сочетается с переломами костей таза и повреждениями других органов, то состояние пациентов, как правило, очень тяжелое.
На травму мочевого пузыря указывают такие симптомы, как боль в нижних отделах живота, напряжение мышц передней брюшной стенки и симптомы раздражения брюшины. Наиболее важным симптомом повреждения стенки мочевого пузыря считается гематурия, причем у 95 % пострадавших – это макрогематурия.
Для подтверждения диагноза травмы мочевого пузыря необходимо произвести ретроградную цистографию или компьютерную томография с предварительным наполнением мочевого пузыря контрастным веществом. Оба эти исследования позволяют с высокой точностью определить характер и локализацию травмы мочевого пузыря по направлению затека контраста за пределы мочевого пузыря. Если затека контраста нет, то после исследования необходимо удалить контраст из мочевого пузыря через катетер и сделать еще один снимок. Если на этом снимке определяется скопление контраста в мочевом пузыре, то, с большой долей вероятности, можно предположить неполный разрыв стенки мочевого пузыря. К преимуществам компьютерной томографии относится возможность одновременного исследования почек и органов брюшной полости, что имеет большое значение, так как в половине случаев травма мочевого пузыря является сочетанной. Единственным противопоказанием к установке мочевого катетера и введению контраста в мочевой пузырь является травма мочеиспускательного канала. Ее симптомы: выделение крови из меатуса по каплям (уретроррагия), парауретральная и промежностная гематома, отек мошонки, невозможность помочиться.
Для подтверждения диагноза травмы мочеиспускательного канала показано проведение восходящей уретрографии.
Лечение травм мочевого пузыря
Наличие внутрибрюшинного разрыва мочевого пузыря является показанием к оперативному лечению. После аспирации мочи и крови из брюшной полости стенка мочевого пузыря ушивается двухрядным швом, не захватывая в швы слизистую оболочку (наличие лигатур в просвете мочевого пузыря ведет к формированию конкрементов). Операция завершается дренированием мочевого пузыря (через мочевой катетер или с помощью надлобковой цистостомы). У мальчиков необходимо избегать длительной катетеризации, так как она часто осложняется формированием стриктур мочеиспускательного канала.
При внебрюшинных разрывах мочевого пузыря может применяться как консервативное лечение (установка мочевого катетера при небольших разрывах, которые самостоятельно закрываются), так и оперативное лечение (ушивание стенки мочевого пузыря с его катетеризацией или цистостомией + дренирование околопузырного пространства по Буяльскому).
При разрывах мочеиспускательного канала наилучшие отдаленные результаты (отсутствие стриктур канала) достигаются при наложении первичного шва уретры в первые 24 часа после травмы. Предварительно формируется надлобковая цистостома, которая сохраняется после операции для адекватного дренирования мочевого пузыря. При необходимости операция заканчивается дренирование парауретрального пространства и клетчатки малого таза по Буяльскому. При невозможности наложить первичный шов уретры, края разрыва подшиваются к коже, формируется цистостома. Позже производится вторичная пластика уретры.
Интерактивный блок тема 1 Гнойно-воспалительные заболевания органов брюшной полости у детей
Введение
Острый гнойный перитонит - одно из тяжелейших осложнений разнообразных заболеваний и повреждений органов брюшной полости и забрюшинного пространства у детей. Несмотря на то, что в настоящее время достигнут значительный прогресс в общехирургическом и медикаментозном пособии, методах обезболивания и экстракорпоральной детоксикации, проблема лечения перитонита и его осложнений остаётся весьма актуальной. Важность изучения этой проблемы неоспорима, поскольку отмечается тенденция к увеличению удельного веса воспалительных процессов, что связано со снижением эффективности антибактериальных препаратов в результате повышения к ним резистентности современной микрофлоры. Наиболее частой причиной развития острого гнойного перитонита у детей является острый аппендицит, который приводит к 75% экстренных хирургических вмешательств. Другие воспалительные процессы брюшной полости, потенциально способные осложниться перитонитом (дивертикулит, холецистит, панкреатит и т.д.), встречаются у детей крайне редко и составляют не более 0,5% ургентной хирургической патологии. Перфоративный аппендицит у детей до 5 лет встречается в 50%, а у детей до 3 лет - в 85% наблюдений. Вообще, частота развития аппендикулярного перитонита, по данным различных авторов, достигает от 7,5% до 52,8%. Большое количество послеоперационных осложнений при перитоните всегда вызывало беспокойство хирургов. Наиболее частыми из них являются ранняя спаечная кишечная непроходимость и прогрессирующий перитонит. Частота прогрессирующего перитонита может достигать 23%. Статистика различных клиник указывает, что инфильтраты и абсцессы брюшной полости возникают в 1,82%-19%, а кишечные свищи - в 0,12%-0,84% случаев. Летальность при перитоните аппендикулярного генеза по статистике различных клиник колеблется в значительных пределах - от 0,7% до 22,9%.
Этиология острого аппендицита
Острый аппендицит представляет собой неспецифический воспалительный процесс в червеобразном отростке. В его развитии обычно участвует полимикробная флора, свойственная содержимому здорового кишечника. Инфекция внедряется в стенку червеобразного отростка преимущественно энтерогенным путем, то есть из его просвета, реже попадает гематогенным или лимфогенным путем. Для возникновения воспалительного процесса в стенке червеобразного отростка необходимо воздействие ряда способствующих факторов. К ним относят характер питания, застой содержимого, изменение реактивности организма. Заметную роль в возникновении острого аппендицита играют условия питания: обильная еда со значительным содержанием мясной и жирной пищи обычно приводит к запорам и атонии кишечника и увеличению заболеваемости острым аппендицитом. Это подтверждается также известным фактом снижения числа заболевших острым аппендицитом во время социальных бедствий, например - в годы войны.
Другими способствующими факторами являются перекруты, изгибы червеобразного отростка, попадание в просвет отростка каловых камней, инородных тел. Определенную роль в возникновении острого аппендицита играет также изменение реактивности организма. Нередко острый аппендицит возникает после перенесенных заболеваний: чаще всего ангины, детских инфекционных заболеваний, респираторных и энтеровирусных инфекций.
Патогенез острого аппендицита
Для объяснения механизмов развития воспалительного процесса в червеобразном отростке предположен ряд теорий, из которых основными являются инфекционная, механическая (теория "застоя") и нейрососудистая. Согласно нейрососудистой теории вначале возникают рефлекторные нарушения кровообращения (спазм, ишемия), которые приводят к трофическим расстройствам в стенке червеобразного отростка, вплоть до некроза отдельных участков. Имеется значительное количество научных работ, в которых ведущая роль отводится аллергическому фактору. Свидетельством этого является наличие кристаллов Шарко-Лейдена и значительное количество слизи в просвете воспаленного червеобразного отростка.
У детей, по сравнению с взрослыми, острый аппендицит имеет ряд отличительных черт, которые могут быть объяснены анатомо-физиологическими особенностями растущего организма. Наиболее характерными чертами острого аппендицита у детей являются следующие.
1) У грудных детей аппендицит наблюдается чрезвычайно редко, частота заболеваемости нарастает с возрастом. Редкость заболевания аппендицитом грудных детей объясняют характером питания (преимущественно жидкая молочная пища) и малым числом фолликулов слизистой оболочки червеобразного отростка, что создает неблагоприятный фон для развития инфекции. С возрастом число фолликулов увеличивается, и параллельно увеличивается заболеваемость аппендицитом.
2) У детей воспалительные изменения в червеобразном отростке развиваются значительно быстрее, чем у взрослых, и чем младше ребенок, тем ярче выражена эта особенность. Быстроту развития воспалительного процесса в аппендиксе у ребенка объясняют возрастными особенностями строения нервной системы. Установлено, что в любом детском возрасте, особенно в раннем, отмечается недостаточная зрелость интрамурального нервного аппарата. В ганглиях червеобразного отростка имеется большое количество малых клеток типа нейробластов. Это отражается на развитии патологического процесса, так как в тканях, где нервная система носит эмбриональный характер, патологический процесс протекает необычно.
Классификация аппендицита
Одной из наиболее распространенных и удобной с практической точки зрения является классификация, предложенная В.И.Колесовым (1972).
Согласно этой классификации выделяют следующие формы острого аппендицита.
Слабо выраженный аппендицит (так называемая аппендикулярная колика – colica appendicularis). В настоящее время многие хирурги подвергают критике эту классификационную единицу.
Простой или катаральный, поверхностный аппендицит (appendicitis simplex).
Деструктивный аппендицит (appendicitis destructives):
флегмонозный;
гангренозный;
прободной (перфоративный).
Осложненный аппендицит (appendicitis complicata):
аппендикулярный инфильтрат (хорошо отграниченный, прогрессирующий);
аппендикулярный абсцесс;
аппендикулярный перитонит;
прочие осложнения острого аппендицита (оментит, пилефлебит, сепсис и др.).
Общая симптоматика аппендицита
Заболевают острым аппендицитом дети всех возрастных групп, но преимущественно в 5-14 лет. Девочки по статистике болеют приблизительно в 2 раза чаще мальчиков.
Клиническая картина острого аппендицита определяется возрастом ребенка, типом конституции и резистентностью организма, наличием морбидного фона, а также степенью морфологических изменений в червеобразном отростке и его расположением в брюшной полости. Значительно изменяют клиническую картину возникшие осложнения. Для острого аппендицита характерны следующие общие признаки: боль в животе, дисфагия (тошнота или рвота), диспепсия (диарея или запор), нарушения кишечной перистальтики, повышение температуры, учащение пульса, изменение общего состояния. В то же время следует помнить, что существует два основных клинических симптома острого аппендицита – боль и пассивная резистентность мышц передней брюшной стенки (дефанс) в правой подвздошной области.
Боль в животе является наиболее постоянным признаком. Характер, интенсивность и локализация боли бывают разными. У большинства детей боль появляется внезапно и локализуется в правой подвздошной области. У других больных она локализуется вначале в собственно эпигастральной или околопупочной области и в последующем, спустя 2-3 часа, перемещается в правую подвздошную область. Характер ее дети определяют как ноющая, постоянная боль. Постепенно она усиливается. Как правило, боль при остром аппендиците не иррадиирует.
Тошнота и рвота являются типичными симптомами острого аппендицита и возникают почти всегда после боли. Обычно сначала бывает рефлекторная рвота пищевым содержимым, затем она становится менее обильной. Частота рвоты может служить показателем формы острого аппендицита - при осложненном процессе она принимает характер "истощающей". У ряда детей в начальный период заболевания наблюдается задержка стула и газов, в других случаях - возникает понос. Температура тела у большинства больных повышается до уровня субфебрильных цифр, может достигать 38°С. Пульс учащается параллельно повышению температуры. При деструктивных формах аппендицита и выраженной интоксикации учащение пульса не соответствует изменению температуры тела.
Объективное обследование при остром аппендиците
Объективное обследование начинают с осмотра живота, определяют участие его в дыхании. Правая половина живота обычно отстает в акте дыхания. Для определения локализации боли ребенку старшего возраста предлагают покашлять, после чего он сразу же отмечает место наибольшей болезненности. При пальпации в области расположения червеобразного отростка, чаще всего в правой подвздошной области, определяется болезненность, что является одним из характерных признаков острого аппендицита. Важным симптомом острого аппендицита является напряжение мышц передней брюшной стенки в правой подвздошной области, возникающее рефлекторно при воспалении париетальной брюшины. Степень напряжения мышц бывает различной, от незначительно выраженной до доскообразного живота. Для выявления легкого напряжения мышц следует проводить осторожную пальпацию, начиная со здоровых участков живота и постепенно приближаясь к правой подвздошной области. Целесообразно также проводить одновременную пальпацию брюшной стенки в обеих подвздошных областях. В некоторых случаях, особенно у детей с сопутствующей неврологической патологией, напряжение мышц бывает слабо выраженным или же исследователь может не определять его вовсе.
Симптом Щеткина-Блюмберга
Для диагностики острого аппендицита предложено более 100 симптомов, основанных на вызывании тем или иным способом болевой реакции в месте расположения червеобразного отростка. Обычно для диагностики используют несколько симптомов, из них наиболее важным является симптом Щеткина-Блюмберга. Он вызывается медленным надавливанием пальцами на брюшную стенку и отнятием руки. В этот момент появляется усиление боли. Симптом основан на раздражении воспаленной брюшины и является одним из ранних признаком перитонита, в том числе и при остром аппендиците. Симптом Щеткина-Блюмберга бывает положительным в 90% случаев острого аппендицита.
Симптом Воскресенского
Не менее характерным и наблюдающимся с такой же частотой является симптом "скольжения" Воскресенского. Он вызывается следующим образом. Натянув левой рукой рубашку ребенка во время выдоха, кончиками пальцев правой руки делают быстрое скользящее движение вниз из левого подреберья к правой подвздошной области и задерживают здесь руку. В этот момент больной отмечает усиление боли.
Симптом Ровзинга
Симптом Ровзинга, заключается в толчкообразном надавливании на брюшную стенку в месте расположения нисходящей ободочной кишки. При этом происходит усиление боли в правой подвздошной области. Это обусловлено передачей давления через брюшную стенку и петли кишечника на воспаленный червеобразный отросток.
Симптомы Раздольского и Ситковского
При воспалении брюшины наблюдается повышенная чувствительность брюшной стенки к каждому толчку рукой. На этом и основан симптом перкуторной болезненности Раздольского – усиление боли в правой подвздошной области при проведении перкуссии передней брюшной стенки по ходу рамки толстой кишки в направлении "против часовой стрелки". Приблизительно у половины детей отмечается усиление боли в правой подвздошной области в положении на левом боку (симптом Ситковского) и при пальпации в этом положении (симптом Бартомье-Михельсона).
Симптомы Розанова, Габая, Жендринского
Для диагностики ретроцекального аппендицита используют симптом Яуре-Розанова (болезненность при надавливании пальцем в области треугольника Пти) и симптом Габая (боль в момент отнятия надавливающего пальца в области треугольника Пти).
Симптом Жендринского используют для дифференциальной диагностики острого аппендицита от острого сальпингита (в основном у девушек). Этот симптом заключается в том, что в положении на спине у больной нажимают на живот в точке Кюммеля (на 2 см ниже и правее от пупка) и, не отнимая пальца, просят пациентку сесть. Усиление боли свидетельствует об остром аппендиците уменьшение - на острый сальпингоофорит.
Изменения в анализе крови при аппендиците
У большинства детей при остром аппендиците уже в самом начале заболевания отмечается повышение количества лейкоцитов в периферической крови, которое прогрессирует с развитием воспалительного процесса, достигая 10 Г/Л-25Г/Л. При деструктивном аппендиците лейкоцитоз достигает более высоких цифр, кроме того, наблюдается сдвиг лейкоцитарной формулы влево. Для диагностики деструктивных форм острых хирургических заболеваний, в том числе и острого аппендицита, К.С.Симонян (1971) предложил изучать ферментную формулу лейкоцитов, включающую в себя определение активности щелочной фосфатазы и пероксидазы нейтрофилов, сукцинатдегидрогеназы и глицерофосфатдегидрогеназы лимфоцитов и фосфолипидов в нейтрофилах.
Атипичные варианты расположения аппендикса
Своеобразным клиническим течением отличается аппендицит при забрюшинном положении аппендикса. Заболевание начинается с появления умеренной боли в правой подвздошной или поясничной областях, которая иногда иррадиирует в правое бедро. Состояние ребенка длительное время остается удовлетворительным, слегка учащен пульс, в крови имеется умеренный лейкоцитоз. С переходом воспалительного процесса на окружающую червеобразный отросток клетчатку состояние больного ухудшается, температура повышается до 39°-40°, усиливается боль. При объективном исследовании определяется болезненность в поясничной области, где иногда определяется также напряжение мышц. Положительные симптомы Яуре-Розанова, Габая, Пастернацкого. В крови нарастает лейкоцитоз, определяется сдвиг влево. В моче появляются свежие и выщелоченные эритроциты.
При расположении аппендикса в малом тазу боль обычно возникает в правой паховой области, и длительно отсутствует напряжение брюшной стенки. При близком расположении воспаленного червеобразного отростка к мочевому пузырю появляются дизурические явления, при вовлечении в процесс прямой кишки - частые позывы на акт дефекации. При нарастании воспалительных явлений возникает напряжение мышц, распространяющееся снизу вверх. Ранней диагностике помогает ректальное исследование, определяющее болезненность передней стенки прямой кишки.
Следует помнить также о возможности левостороннего расположения слепой кишки с червеобразным отростком. В таких случаях все характерные симптомы аппендицита определяются в левой половине живота.
Острый аппендицит у детей первых трех лет жизни
Распознавание острого аппендицита у детей до 3 лет представляет большие трудности ввиду запутанного анамнеза, особенностей клинической картины и сложности обследования маленького ребенка. Немаловажную роль играет то обстоятельство, что острый аппендицит у самых маленьких детей - заболевание редкое (оно встречается в 7-10 раз реже, чем у старших детей). В результате, практические врачи мало знакомы с его проявлениями и в первую очередь при обращении больного думают об интеркуррентном заболевании.
Вследствие возрастных особенностей начало заболевания у маленьких детей родителями часто просматривается. Первоначальные боли младенец не может точно объяснить и локализовать, а легкое недомогание при этом расценивается иногда родителями как каприз. Маленькие дети вообще более терпимо относятся к состоянию дискомфорта. И лишь когда боли усиливаются, ребенок проявляет беспокойство, плачет. Таким образом, проходит определенный отрезок времени, прежде чем родители заметят, что ребенок болен и щадит живот. В связи с этим создается впечатление, что заболевание возникает внезапно, бурно. На развитие воспалительного процесса в червеобразном отростке организм маленького ребенка отвечает своеобразной реакцией: на первых порах общие явления преобладают над местными и занимают ведущее место в картине болезни. У детей младшей возрастной группы, в отличие от детей старшего возраста, заболевание чаще сопровождается многократной рвотой, высокой температурой, жидким стулом. Однако указанные явления не всегда выражены стереотипно, и степень их проявления зависит от особенностей индивидуальной резистентности. Обычно рвота появляется через 12-16 часов от начала заболевания. Часто фиксируется фебрильная температура. Диарея возникает не менее чем в 25% случаев. В связи с тем, что неустойчивый стул, высокая температура и рвота у детей до 3 лет - явления обычные при любом заболевании, данное обстоятельство вводит врачей в заблуждение и служит поводом для диагностической ошибки.
Симптомы аппендицита у детей раннего возраста
В диагностике острого аппендицита решающее значение имеет правильный анализ обнаруженных симптомов. Считается, что арифметический подсчёт симптомов "за" и "против" при постановке диагноза является ошибкой. Подобная субъективизация диагностики острого аппендицита приводит, с одной стороны, к значительному количеству "запущенных случаев", а с другой - не менее часто больные переносят эксплоративную аппендэктомию, когда причиной болей в животе служит другое заболевание. Всё это особенно относится к детям младшей возрастной группы, поскольку они, в силу ювенильного психоэмоционального фона, крайне негативно реагируют на осмотр, пальпацию и т.д. На сегодняшний день большинство исследователей основным диагностическим критерием считают наличие болезненности и пассивного напряжения мышц живота в правой подвздошной области. Однако степень сопротивления мышц бывает неодинаковой: от небольшой (малоуловимой) резистентности до резкой ригидности (доскообразный живот). Крайне трудно определить этот симптом у ослабленных детей и больных с неврологическими заболеваниями. Кроме того, дети, боясь обследования, сознательно напрягают живот, что приводит к активному напряжению брюшного пресса.
Развитие клиники острого аппендицита у детей раннего возраста
В ряде случаев наблюдается такая картина: спустя несколько часов или на другой день от начала приступа боли в животе у ребенка стихают, температура падает до нормальных или субфебрильных цифр, и наступает период мнимого благополучия. Однако через 1-2 дня с момента заболевания усиливаются боли, повышается температура, появляются признаки раздражения брюшины. Важным объективным признаком тяжести заболевания в таких случаях оказывается симптом расхождения пульса и температуры.
У детей младшей возрастной группы воспалительный процесс при остром аппендиците крайне редко принимает отграниченный характер. Поэтому у них заболевание чаще осложняется разлитым перитонитом со всеми вытекающими отсюда последствиями.
У новорожденных и грудных детей острый аппендицит является исключительно редким заболеванием и обнаруживается чаще всего случайно на операции, предпринятой по поводу "другого заболевания" (перитонита, например), или на секции. Начинается заболевание с беспокойства ребенка, отказа от груди. Температура повышается до 38°-39°С, возникает рвота, которая со временем прогрессирует. У ребенка заостряются черты лица, появляется страдальческое выражение глаз, прогрессируют эндотоксикоз и обезвоживание. Живот вздут; напряжение брюшных мышц выражено равномерно во всех отделах. Локальную болезненность при пальпации определить не удается. Через 1-2 дня появляется отечность брюшной стенки, кожа лоснится. Отечность более всего выражена в нижних отделах, распространяется на половые органы. На брюшной стенке отчетливо виден венозный рисунок. Симптомы раздражения брюшины и расхождение кривых пульса и температуры в постановке диагноза значения не имеют.
Лечение острого аппендицита
Дети с острым аппендицитом подлежат оперативному (хирургическому лечению). Оперативное лечение должно выполняться в течение 1-2 часов с момента установления диагноза. В случае осложненного течения заболевания, когда необходимо проведение предоперационной подготовки, допустима пролонгация оперативного лечения до 4 часов. У детей выполняют аппендэктомию лигатурным или погружным способом. Современный подход к лечению острого аппендицита в детском возрасте предусматривает использование лапароскопических методик.
Аппендикулярный инфильтрат
Аппендикулярный инфильтрат это конгломерат органов и тканей, формирующийся вокруг воспаленного червеобразного отростка и обычно состоящий из участка инфильтрированного — большого сальника, купола слепой и петель подвздошной кишки, связанных между собой и окруженных фибринозными спайками. Как местный воспалительный процесс, аппендикулярный инфильтрат самостоятельно или под влиянием лечения может на стадии инфильтрации тканей подвергнуться обратному развитию или перейти в следующие фазы — секвестрации некротизированных тканей и их гнойного расплавления с образованием абсцесса. Возникновению способствует ряд причин: характер воспалительного процесса и анатомические особенности червеобразного отростка, возрастные и иммунологические особенности организма, характер патогенного возбудителя.
Частота возникновения аппендикулярного инфильтрата среди больных острым аппендицитом, по данным литературы, колеблется от 1,7 до 19,2 %. Но в большинстве сообщений она не превышает 2—4 %, а по данным клиники она равна 1,9 %. Некоторые авторы отмечают, что аппендикулярный инфильтрат чаще возникает при ретроцекальном расположении аппендикса, другие не подтверждают такой закономерности, так как при этом осложнении наблюдали более частое расположение отростка впереди или медиально от слепой кишки. Возможность образования аппендикулярного инфильтрата во многом определяется индивидуальной реакцией организма на очаг воспаления при остром аппендиците, т. е. при одинаковом анатомическом расположении червеобразного отростка, идентичности высеваемой микрофлоры и примерно сходном общем состоянии больных у одних из них происходит выраженное отграничение воспалительно-деструктивного процесса (образование аппендикулярного инфильтрата), а у других при тех же местных условиях развивается разлитой (диффузный) гнойный или ихорозный перитонит.
Клиника и лечение аппендикулярного инфильтрата
По клиническому течению можно выделить ранние инфильтраты, возникающие в первые 2 сут. от начала заболевания (появление их обычно связано с острыми деструктивными изменениями в червеобразном отростке), и инфильтраты, возникающие на 3—5 день от начала приступа острого аппендицита. Наиболее частым исходом ранних инфильтратов является образование периаппендикулярного абсцесса. Клиническая симптоматика такого инфильтрата не имеет существенных особенностей по сравнению с клиникой острого деструктивного аппендицита, но при обследовании больного, как правило, имеется напряжение брюшной стенки в правой подвздошной области, которое препятствует обнаружению инфильтрата. Лишь в случае отсутствия защитного напряжения брюшной стенки инфильтрат может быть определен как болезненное плотноватой консистенции образование, иногда подвижное, без четких границ.
При возникновении инфильтрата в более поздние (3—5 дней) сроки от начала заболевания первоначальные боли обычно уменьшаются и принимают характер тупых, тянущих и локализующихся в правой подвздошной области. Сохраняется «кашлевой симптом» и болезненность в правой подвздошной области, определяется болезненное, без четких границ, образование. Признаки раздражения брюшины отсутствуют или слабо выражены лишь в этой области.
При благоприятном течении поздний инфильтрат вскоре четко отграничивается и, начиная с 7—8 дня заболевания, размеры его постепенно уменьшаются; в зависимости от темпов обратного развития воспалительного процесса через 3—5 нед. инфильтрат перестает определяться. К этому времени часто исчезает и болезненность при глубокой пальпации.
Увеличение или стабильность размеров, а также слишком замедленное рассасывание инфильтрата с большой вероятностью указывают на деструкцию червеобразного отростка и образование абсцесса или опухолевую природу пальпируемого образования.
При инфильтрате, возникшем на 3—5 день от начала заболевания, обычно применяется консервативное лечение (постельный режим, антибиотики, местное тепло). Однако прежде чем применить физиотерапевтические процедуры, необходимо (особенно у больных пожилого возраста) убедиться, что образование не является опухолью. Больной должен находиться в стационаре до полного исчезновения инфильтрата и в сомнительных (относительно опухолевой природы определявшегося образования) случаях может быть выписан только после рентгенологического исследования желудочно-кишечного тракта. Больным, подвергавшимся успешному консервативному лечению по поводу аппендикулярного инфильтрата, рекомендуется аппендэктомия или непосредственно после полного рассасывания, или через 4—6 недель после выписки из стационара.
При раннем аппендикулярном инфильтрате или инфильтрате, возникшем в более поздние сроки, но подвижном и рыхлом, по опыту клиники, вполне допустима аппендэктомия, с резекцией припаянного к отростку инфильтрированного и отечного участка большого сальника. В этих случаях операция заканчивается введением микроирригатора в правую подвздошную область, через который в течение 3—4 суток осуществляется внутрибрюшинное введение антибиотиков.
Перитонит новорожденных
Воспаление брюшины у новорожденных — заболевание полиэтиологичное. Различают первичный и вторичный перитониты. При первичном инфицирование брюшной полости происходит гематогенным, лимфогенным путями или же контактно в случаях воспаления пупочных сосудов, в том числе при омфалите, и органов забрюшинного пространства. Вторичные перитониты являются следствием воспалительных заболеваний органов брюшной полости, среди которых главенствующее место занимает язвенно-некротический энтероколит.
Чаще всего первичный перитонит развивается на фоне пупочного сепсиса. Первые симптомы — это вздутие живота, частые срыгивания или рвота, падение массы тела. Стул обычно жидкий и частый, зеленоватого цвета, с комочками непереваренной пищи. Температура тела держится в пределах 37,5 —38 °С, особенно если проводят активное лечение по поводу основного заболевания. С развитием воспалительного процесса брюшины постепенно срыгивания переходят в рвоту застойными темными массами. Нарастают явления интоксикации; кожные покровы приобретают сероватый оттенок. Язык обложен беловатым налетом, суховат, иногда с эрозиями. Живот становится стойко вздутым, отмечается задержка стула. На передней брюшной стенке выражена венозная сеть, в нижних отделах живота и вокруг пупка ткани становятся отечными, кожа лоснится. В крови выявляется умеренное повышение количества лейкоцитов. Отчетливо нарастает анемия. При малейшем подозрении на перитонит ребенка экстренно госпитализируют. Лечение первичных перитонитов консервативное, по общим правилам ведения септических больных.
Вторичный - перитонит при язвенно-некротическом энтероколите возникает вследствие перфорации стенки кишки на месте язвы (язв) или инфицирования брюшной полости через истонченную стенку кишки в местах поражения. Летальность в этой группе новорожденных до настоящего времени остается очень высокой.
В период, предшествующий возникновению перитонита, имеются указания родителей на частые срыгивания у ребенка, нарастающее ухудшение состояния. Стул частый, жидкий, с прожилками крови. Перфорация характеризуется внезапным ухудшением общего состояния, ребенок становится беспокойным, появляется рвота застойным содержимым. Стул задержан; после введения газоотводной трубки отходит слизь с прожилками крови. При осмотре обращает на себя внимание резкое вздутие живота, брюшная стенка растянута, поверхностные вены расширены. Могут наблюдаться пастозность и гиперемия кожи нижних отделов живота, отек наружных половых органов. Выражены тахикардия, цианоз носогубного треугольника.
Перитонит, этиология
Перитониты представляют собой группу воспалительных заболеваний брюшины, различных по причинам своего возникновения, механизмам развития и особенностям клинического течения.
Многочисленные микробиологические исследования последних лет убедительно доказали, что перитонит чаще всего представляет собой полимикробную аэробно-анаэробную инфекцию. Основное значение при этом придаётся микробной контаминации и нарушению соотношения аэробов и анаэробов при патологических состояниях. Вообще, данные о значении микробов значительно отличаются от сведений буквально 10-летней давности. В настоящее время бытует мнение, что анаэробы и аэробы играют неодинаковую роль в возникновении, течении и исходе острого перитонита. Считается, что анаэробы ответственны за развитие поздних стадий перитонита, в то время как аэробы чаще высеваются в начальных стадиях. В генезе эндотоксикоза при перитоните у детей большое значение придаётся парезу кишечника, как одному из проявлений тяжёлых функциональных расстройств желудочно-кишечного тракта. При нарушении сократительной активности кишечной стенки резко нарушается пристеночное пищеварение, в кишечной стенке нарушаются процессы всасывания, что сопряжено с поступлением в кровоток продуктов гидролиза белков. В это время токсины и бактерии способны проникать через кишечную стенку и поступать в брюшную полость, за счёт чего значительно увеличивается токсичность воспалительного экссудата. Брюшина обладает выраженной способностью к резорбции экссудата, что усиливает интоксикацию организма.
Отдельную группу составляют специфические перитониты, к которым относятся туберкулезный перитонит, актиномикоз и сифилис брюшины.
Патогенез перитонита
В патогенезе острого гнойного воспаления брюшины ведущую роль играют следующие неразрывно связанные между собой факторы:
патогенные микроорганизмы,
интоксикация,
гиповолемия,
глубокие нарушения обмена веществ.
Бактериальное заражение брюшины является ведущим патогенетическим звеном в развитии перитонита. Первая реакция со стороны брюшины на поступление патогенных микроорганизмов или гноя заключается в расширении сосудистой сети и возникновении воспалительной гиперемии. Наряду с этим происходит увеличение проницаемости сосудов и образуется перитонеальный экссудат. В ранних стадиях экссудат обычно бывает серозный, без нитей фибрина, позднее содержание фибрина в экссудате значительно увеличивается, и он откладывается на серозных поверхностях в виде нитей или хлопьев.
Вопрос о сущности интоксикации при перитонитах окончательно не выяснен. Длительное время ее связывали преимущественно с образованием и всасыванием из брюшной полости эндотоксинов и экзотоксинов, индола и скатола, фенола и крезола. Целый ряд исследователей считает причиной интоксикации глубокие нарушения межуточного обмена, в частности белкового и водно-солевого. В поздних стадиях перитонита интоксикация обусловлена токсическими веществами, циркулирующими в крови.
С самого начала воспалительного процесса, по мере развития перитонита, возникают тяжелые нарушения моторики кишечника. В результате пареза и последующей паралитической непроходимости кишечника возникает застой кишечного содержимого с его разложением, образованием большого количества газов и растяжением кишечных петель. Нарушения процессов всасывания, наряду с повышением проницаемости сосудов, ведут к усиленному выделению и скоплению больших количеств жидкости в просвете кишечника и обезвоживанию организма. На высоте развития острого перитонита происходят значительные потери жидкости, прежде всего - из внеклеточного сектора. Транссудация больших количеств жидкости и выделение пищеварительных соков в просвет кишечника одновременно сопровождаются потерей больших количеств белка и электролитов. Состояние усугубляется присоединяющейся рвотой, ведущей к еще большей потере воды, электролитов и белка. Плазмопотеря на высоте развития паралитической непроходимости может достигать исходного количества плазмы. Все это вместе с потерей жидкости, белка и солей при экссудации в свободную брюшную полость ведет к резкому снижению объема циркулирующей крови, гипоксии, нарушению микроциркуляции, неадекватной перфузии тканей, то есть состоянию шока.
Шок при перитоните
При остром гнойном перитоните можно наблюдать 2 разновидности шока - гиповолемический и токсический.
Гиповолемический шок характеризуется развитием циркуляторной недостаточности, которая вызывается значительным снижением объема циркулирующей крови в основном за счет выраженного уменьшения плазматического объема, потери внеклеточной жидкости, обезвоживания организма, возникающего в результате накопления в брюшной полости экссудата с высоким содержанием белка, а также вследствие рвоты. Недостаточность кровообращения при гиповолемическом шоке характеризуется изменением минутного объема сердца, падением артериального и центрального венозного давления, уменьшением скорости кровотока, значительным снижением сократительной функции миокарда, развитием энергетически-динамической недостаточности миокарда.
В патогенезе гиповолемического шока, сердечно-сосудистой недостаточности при перитоните играют роль кинины, освобождающиеся в результате действия ферментов и эндотоксинов. Кинины вызывают расширение мелких сосудов и увеличение сосудистой проницаемости, усиливая перитонеальную экссудацию и усугубляя таким образом гиповолемический шок.
Реже циркуляторная недостаточность развивается вследствие эндотоксемии (эндотоксический шок). При этом циркуляторная недостаточность является результатом комплексного воздействия бактериальных токсинов на сердце, сосуды и прямого влияния на клеточный метаболизм. Характерными для этой формы шока являются гипотензия, тахикардия, гектическая температурная кривая, бледность кожных покровов. Гемодинамические сдвиги проявляются понижением сердечного выброса, увеличением периферического сосудистого тонуса и удлинением времени циркуляции. Увеличение периферического сопротивления свидетельствует о том, что гипотензия не обусловлена сосудистым коллапсом. При этом отсутствуют признаки гиповолемии (выраженные изменения гематокрита, центрального венозного давления, количества мочи). Близкие к нормальным, показатели центрального венозного давления говорят об отсутствии сердечной недостаточности. Все это подтверждает наличие токсического шока.
Развивающиеся при остром гнойном перитоните нарушения микроциркуляции и гипоксия приводят к нарушению метаболизма, в частности, к увеличению анаэробного метаболизма и метаболическому ацидозу. При особенно больших потерях калия развивается метаболический алкалоз. Существует выраженная обратная связь между величиной рН и содержанием калия в крови.
Важными звеньями в патогенезе острого гнойного перитонита являются нарушения функции почек и печени. Следствием возникающей гиповолемии является уменьшение почечного кровотока, скорости клубочковой фильтрации и минутного диуреза, что приводит к олигурии, увеличению содержания остаточного азота, мочевины и креатинина в крови и в брюшинном экссудате.
Изменения функционального состояния коры надпочечников при гнойном перитоните характеризуются увеличением секреции глюкокортикоидов. Нарушения нейрогуморальной регуляции, интоксикация приводят к угнетению при перитоните иммунологических механизмов (фагоцитарная активность лейкоцитов, образование антител). Снижение количества γ-глобулинов при остром гнойном перитоните также свидетельствует об угнетении иммунной реактивности.
Классификация перитонита
Классификация К.С.Симоняна (1971 г.), согласно которой тяжесть клинического течения перитонита определяется динамикой развития процесса во времени (реактивная стадия - первые 24 часа, токсическая стадия - 24-72 часа и терминальная стадия - свыше 72 часов) ограниченно применима в детской хирургии в связи с особенностями резистентности детского организма.
Динамику перитонита у детей рационально рассматривать согласно классификации П.Л.Сельцовского (1963 г.), видоизменённой В.Д.Фёдоровым (1974 г.), в основе которой лежит степень распространённости перитонита и морфо-функциональных сдвигов.
В зависимости от степени распространенности процесса различают:
местный перитонит (ограниченный и склонный к распространению);
диффузный перитонит;
разлитой перитонит;
общий, или тотальный, перитонит.
При местном перитоните воспалительный процесс локализуется не более чем в двух анатомических областях в пределах одного этажа брюшной полости.
Диффузный перитонит характеризуется распространением более чем в двух анатомических областях в пределах одного этажа брюшной полости.
При разлитом перитоните поражена брюшина двух этажей брюшной полости;
При общем, или тотальном - вся.
В зависимости от характера выпота различают:
серозный;
серозно-гнойный;
фибринозный;
гнойный;
септический перитонит.
Последний представляет собой особую очень редкую форму перитонита, характеризующуюся молниеносным течением, отсутствием выпота в брюшной полости, резкой гиперемией брюшины.
Клиника перитонита
Клиническая картина острого гнойного перитонита весьма многообразна и зависит от этиологии, фазы, распространенности процесса, характера микрофлоры. В одних случаях перитонит может начинаться внезапно (перфорация язвы, разрыв кишечника). В других случаях перитонит возникает как следствие воспалительного процесса в одном из органов брюшной полости (острый аппендицит).
Ребенок с перитонитом занимает вынужденное положение на спине или полусидячее с приведенными к животу бедрами. Сознание ясное, сохраняется часто до самой смерти. При ухудшении состояния возникает эйфория, возбуждение. Черты лица заострены, кожа бледная, покрыта холодным потом, конечности холодные на ощупь, синюшные. Язык сухой. Отмечается сильная жажда. Артериальное давление обычно снижено и падает по мере прогрессирования воспалительного процесса. Пульс частый, до 120-140 уд/мин, малого наполнения. Дыхание частое, поверхностное. Развивающийся парез кишечника приводит к высокому стоянию диафрагмы и еще большему нарушению акта дыхания. Температура при перитоните обычно повышена до 38°С и более, но иногда остается субфебрильной или нормальной (крайне редко). Обычно обнаруживается расхождение между большим повышением температуры и значительным учащением пульса. Диурез при перитоните снижен. По мере прогрессирования перитонита развивается анемия, растет лейкоцитоз со сдвигом лейкоцитарной формулы влево.
Местным симптомом перитонита является боль в животе, которая вначале локализуется в месте расположения источника перитонита, а затем распространяется по всему животу. По мере прогрессирования интоксикации боль ослабевает. При пальпации определяется разлитая болезненность по всему животу, наиболее выраженная в области первичного очага. Почти у всех больных определяется симптом Щеткина-Блюмберга. Одним из наиболее характерных симптомов является напряжение мышц брюшной стенки, выраженность которого бывает различной, от незначительного, с трудом выявляемого, до "доскообразного" живота. Для выявления незначительных степеней мышечного напряжения у детей требуется нежная, поверхностная пальпация. В поздних стадиях, по мере нарастания вздутия кишечника и накопления экссудата, напряжение мышц брюшной стенки значительно уменьшается.
Для поздних стадий перитонита характерным становится вздутие живота, обусловленное паралитической непроходимостью кишечника и атоническим расширением желудка. В это время постоянным симптомом становится рвота, вначале прозрачной жидкостью, затем желчью и, наконец, темным кишечным содержимым со зловонным запахом (каловая рвота). При исследовании через прямую кишку при разлитом гнойном перитоните отмечается резкая болезненность и нависание передней стенки прямой кишки.
Лечение перитонита
Одним из главных моментов оперативного вмешательства при гнойном перитоните, прямо влияющим на конечный результат лечения, является санация брюшной полости. Санация брюшной полости при перитоните обычно завершается дренированием. Многочисленные данные литературы свидетельствуют о том, что выбор дренажа, доступы, из которых производится его установка, методы дренирования индивидуальны и зависят от личного опыта хирурга. В то же время в детской хирургии наметилась тенденция к экономному дренированию либо - в случае полноценной санации брюшной полости - к отказу от него. Альтернативой широкому дренированию брюшной полости многие хирурги считают прогнозируемую релапаротомию и повторную санацию брюшной полости.
Антибактериальная терапия перитонита не всегда успешна, особенно при использовании рутинных сочетаний антибиотиков. Поэтому в последние годы большинство врачей настоятельно советуют в терапию больным с перитонитом включать, помимо антибиотиков широкого спектра действия, препараты метронидазола, метроинидазола, нитазола.
Методы борьбы с парезом кишечника при перитоните весьма многочисленные. Среди наиболее известных отметим программы медикаментозной стимуляции, электростимуляции кишечника, продлённой перидуральной анальгезии, гипербарической оксигенации, рефлексотерапии, разнообразных способов внепочечной депурации. Одним из эффективных методов борьбы с парезом и динамической кишечной непроходимостью является продлённая интубация кишечника специальными зондами.
Сальпингопельвиоперитонит
Из гинекологических заболеваний болевой абдоминальный синдром может отмечаться при воспалительных заболеваниях придатков матки, апоплексии яичника, перекруте кисты яичника. При остром сальпингите или оофорите отмечается болезненность в нижней части живота, больше справа, иногда неотчетливые признаки раздражения брюшины, субфебрильная температура, лейкоцитоз. При ректальном исследовании выявляется болезненность придатков. Заболевание в основном встречается у девочек 10-14 лет, чаще справа. Нарушение целостности яичника с кровоизлиянием в брюшную полость чаще всего отмечается в период овуляции, когда вследствие повышения уровня гормонов яичников наблюдается гиперемия, вазодилятация и повышение проницаемости стенки сосудов яичника. Заболевание начинается остро, среди полного благополучия с сильных схваткообразных болей внизу живота, которые сопровождаются головокружением, тошнотой, рвотой. Обычно в брюшную полость изливается 20-100 мл крови, что не сопровождается гемодинамическими нарушениями. При более значительной кровопотере отмечается учащение пульса, снижение АД, падение гемоглобина. При ректальном исследовании выявляется болезненный яичник, боль при смещении матки. Оперативное лечение показано при интенсивном кровотечении и заключается в ушивании разрыва и аспирации крови из брюшной полости. Если кровотечение незначительное и остановилось самостоятельно, то проводится консервативная терапия: постельный режим, холод на низ живота, гемостатические препараты.
Первичный перитонит, чаще всего развивается у девочек в возрасте 5-10 лет и связан с проникновением инфекции в брюшную полость через влагалище.
Клинически различают две формы заболевания – простую и токсическую.
Токсическая форма начинается остро с сильных болей внизу живота, многократной рвоты, повышения температуры до 39 градусов. Часто отмечаются слизисто-гнойные выделения из влагалища, высокий лейкоцитоз. Через несколько часов после начала заболевания общее состояние ребенка оценивается как тяжелое. При обследовании живота выявляется мышечное напряжение и болезненность во всех отделах, но больше справа внизу, положительные симптомы раздражения брюшины.
Чаще встречается простая форма первичного перитонита, при которой интоксикация не выражена, температура субфебрильная, отмечаются умеренные боли внизу живота или только в правой подвздошной области. Применение лапароскопии в ургентной хирургии детского возраста позволяет с высокой точностью выявить причину болевого абдоминального синдрома. При остром сальпингите маточные трубы гиперемированы и отечны, сосуды брыжейки трубы инъецированы, яичники отечны и имеют тусклый цвет, иногда отмечается гиперемия и полнокровие сосудов париетальной брюшины малого таза. Больные с воспалительными изменениями придатков матки должны получить курс антибактериальной терапии, а затем курс противоспаечной терапии. Лапароскопическими признаками пельвиоперитонита являются обнаружение большого количества прозрачного или мутного выпота в полости малого таза, выпот липкий, поэтому тянется за манипулятором, отмечается гиперемия и отечность матки и ее придатков. Наибольшие воспалительные изменения обнаруживаются в ампулярной части маточных труб. При токсической форме пельвиоперитонита выпот приобретает гнойный характер. Лечение пельвиоперитонита заключается в аспирации выпота из брюшной полости, введении раствора антисептика. В послеоперационном периоде проводится антибактериальная и дезинтоксикационная терапия.
Мезаденит
Мезаденит (синоним мезентериальный лимфаденит) — воспаление брыжеечных лимфатических узлов. Мезаденит часто наблюдается в детском и юношеском возрасте. По течению различают острый и хронический мезаденит. Причиной М. может быть туберкулез, но чаще неспецифическая инфекция, которая проникает из первичного очага (верхние дыхательные пути) гематогенным путем либо через кишечный тракт со слюной и мокротой. М. может быть также реакцией регионарных лимфатических узлов на воспалительный процесс в червеобразном отростке или в кишечнике при каком-либо инфекционном заболевании — бактериальном или вирусном.
Клиническая картина. Молниеносные, или токсические, формы М. встречаются редко. Обычно состояние больного не тяжелое. Наиболее постоянным симптомом являются боли в животе с локализацией в правом нижнем квадранте или в области пупка; боли носят схваткообразный характер и держатся от 2—3 часов до 5 суток. Бывает тошнота, иногда рвота. Температура либо нормальная, либо 37,5—38°. При осмотре живот симметричный, напряжения мышц брюшной стенки обычно не наблюдается. Симптомы раздражения брюшины выражены мало. В крови лейкоцитоз до 15 000— 30 000.
При хроническом мезадените боли в животе имеют неопределенную локализацию и кратковременный характер. Часто отмечаются дисфункции кишечника. Диагностике помогают симптом Штернберга (болезненность по ходу корня брыжейки) и симптом «смещающейся болезненности» при повороте больного. С такой же картиной протекает и туберкулезный М.
Острый (нетуберкулезный) мезаденит иногда заканчивается нагноением брыжеечных лимфатических узлов — гнойный М. При этом состояние больного значительно ухудшается, температура становится гектической, пульс частый. При пальпации определяется умеренное напряжение мышц, иногда удается прощупать воспалительный конгломерат, в который входят сальник и прилегающие петли тонкого кишечника. Крайне редко гнойник прорывается в брюшную полость и развивается перитонит.
Острый М. приходится дифференцировать с аппендицитом (см.), однако все сходные симптомы (боли, напряжение мышц живота, раздражение брюшины и др.) при аппендиците выражены значительно резче. Нередко вследствие трудности диагноза острого М. производят операцию. Хронический М. дифференцируют с заболеваниями, сопровождающимися нерезкими болями в животе, например гельминтозами, хроническим аппендицитом.
Лечение консервативное, строгий постельный режим, введение антибиотиков, при болях в животе — болеутоляющие и антиспастические средства, грелки.
Интерактивный блок к теме 2 Гнойно-воспалительные заболевания у детей. Травма грудной клетки
Вступление
Гнойная (неспецифическая) инфекция - воспалительные заболевания различной локализации и характера, вызванные гноеродной микробной флорой; занимает в хирургии одно из основных мест и определяет сущность многих заболеваний и послеоперационных осложнений.
Гнойно-воспалительные заболевания сопровождают человечество на протяжении всей его истории, доставляя множество страданий, и занимают одно из основных мест среди хирургических болезней. Именно эти заболевания окружены в народе наибольшим количеством слухов, домыслов и заблуждений.
Актуальность темы
Среди общей детской заболеваемости патология органов дыхания занимает одно из ведущих мест. В последние годы значительно улучшились результаты лечения острых заболеваний этих органов, снизилась смертность от пневмоний и их осложнений, однако на сегодняшний день гнойные заболевания легких составляют большую группу патологических процессов, развивающихся в легочной ткани. Гнойно-воспалительные изменения мягких тканей составляют до 20% всех больных хурургического профиля.
Этиология
Факторы, определяющие начало развития, особенности течения и исход заболеваний, связанных с инфекцией в хирургии:
состояние иммунобиологических сил макроорганизма;
количество, вирулентность, лекарственная устойчивость и другие биологические свойства микробов, проникших во внутреннюю среду организма человека;
анатомо-физиологические особенности очага внедрения микрофлоры;
состояние общего и местного кровообращения;
степень аллергизации больного.
этиология
Гнойно-воспалительные заболевания имеют инфекционную природу, они вызываются различными видами возбудителей: грамположительными и грамотрицательными, аэробными и анаэробными, спорообразующими и неспорообразующими и другими микроорганизмами, а также патогенными грибами. При определённых, благоприятных для развития микроорганизмов условиях воспалительный процесс может быть вызван условно-патогенными микробами: Klebsiella pneumoniae, Enterobacter aerogenes, сапрофитами - Proteus vulgaris и др. Заболевание может быть вызвано одним возбудителем (моноинфекция) или несколькими (смешанная инфекция). Группа микробов, вызвавших воспалительный процесс, называется микробной ассоциацией. Микроорганизмы могут проникать в рану, в зону повреждения тканей из внешней среды (экзогенное инфицирование) или из очагов скопления микрофлоры в самом организме человека (эндогенное инфицирование).
Стафилококк
Стафилококки - наиболее частый возбудитель гнойно-воспалительных заболеваний, основной путь инфицирования - контактный. Источником экзогенного инфицирования чаще бывают больные с гнойно-воспалительными заболеваниями. Источники эндогенного инфицирования - хронические или острые очаги воспаления в самом организме человека, но стафилококки могут также сапрофитировать на коже, слизистых оболочках носа, носоглотки, дыхательных путей, половых органов. Для стафилококковой инфекции характерно свойство микробов выделять экзотоксины (стафилогемолизин, стафилолейцин, плазмокоагулазу и др.), а также высокая устойчивость микробов к антибиотикам и химическим антисептикам. Чаще стафилококки вызывают локализованные гнойно- воспалительные заболевания кожи (фурункул, карбункул, гидраденит и др.), а также остеомиелит, абсцессы лёгких, флегмону и другие; возможна общая гнойная инфекция - сепсис. Для стафилококкового сепсиса характерно появление метастазов гнойной инфекции в различных органах.
Стрептококки
Стрептококки. β-Гемолитические стрептококки А, В, D могут вызывать холецистит, пиелонефрит, сепсис, рожу, бактериальный эндокардит, тяжёлые инфекции у детей (пневмонию, остеомиелит, менингит, а также сепсис новорождённых). Особенностью стрептококковой инфекции является тяжёлая интоксикация, а общая гнойная инфекция протекает без метастазирования.
Пневмококки, гонококки и кишечная палочка
Пневмококки вызывают чаще всего пневмонию, реже - гнойный артрит, гнойный отит, менингит, перитонит у детей (пневмококковый перитонит). Особенность пневмококков - отсутствие токсинообразования.
Гонококки известны как возбудители гонореи, но могут вызывать, распространяясь восходящим путём, гнойный эндометрит, аднексит (сальпингоофорит), гнойный пельвиоперитонит (воспаление тазовой брюшины), при переносе гематогенным путём вызывают гнойное воспаление в других органах - гнойный артрит, гнойный синовит и др.
Кишечная палочка вызывает гнойно-воспалительные заболевания органов брюшной полости (аппендицит, холецистит, гнойный перитонит), а также сепсис. Обитает в кишечнике человека, существует как в аэробных, так и в анаэробных условиях, отличается высокой устойчивостью к антибактериальным препаратам. Особенностью вызываемого кишечной палочкой воспалительного процесса является гнилостный распад тканей (кожи, жировой клетчатки, мышц) с развитием тяжёлой интоксикации. В очагах гнойного воспаления кишечная палочка может быть в ассоциациях со стафилококками, стрептококками, в таких случаях воспалительный процесс принимает наиболее тяжёлое течение.
Протей, синегнойная палочка
Протей - род микроорганизмов, объединяющий грамотрицательные палочки. Некоторые из них (Proteus mirabilis, Pr. vulgaris, Pr. incostans) сапрофитируют в полости рта, кишечнике. При попадании в рану вызывают гнойное воспаление с гнилостным распадом мягких тканей, протекающее с тяжёлой интоксикацией. Отличаются высокой устойчивостью к антибиотикам и химическим антисептикам, встречаются в гнойных очагах в ассоциациях с другими микроорганизмами, являются опасными возбудителями внутрибольничной инфекции.
Синегнойная палочка (Pseudomonas aeruginosa) сапрофитирует на коже человека, чаще в местах, где развиты потовые железы. Является одним из возбудителей внутрибольничной инфекции в ожоговых отделениях и отделениях интенсивной терапии. Развивается при пониженной сопротивляемости организма. Подавляет регенерацию тканей, обладает высокой устойчивостью к антибиотикам и химическим антисептикам (кроме полимиксина, амикацина, карбенициллина, борной кислоты).
Анаэробные возбудители
Неспорообразующие анаэробы - большая группа возбудителей гнойно-воспалительных заболеваний, развивающихся в анаэробных условиях, но не образующих спор. Наибольшее значение среди микробов этой группы имеют грамположительные кокки (пептококки, пептострептококки и др.), грамотрицательные бактерии (бактероиды, фузобактерии и др.). Неспорообразующие анаэробы чаще вызывают гнойно-воспалительные осложнения после операций на органах брюшной полости, а также абсцессы лёгкого, внутритазовые абсцессы. Неспорообразующие анаэробы могут вызывать воспалительный процесс самостоятельно или в ассоциации с аэробными бактериями.
Анаэробные спорообразующие бактерии - клостридии - вызывают специфический воспалительный и некротический процесс - газовую гангрену. Наибольшее значение среди клостридий имеют Cl. perfringens, Cl. oedematiens, Cl. septicus, Cl. hystoliticus. Они чаще вызывают заболевания в сочетании друг с другом или в сочетании с гноеродными микробами - стафилококками, стрептококками. Для газовой гангрены характерна тяжёлая интоксикация, обусловленная как продуктами распада тканей, так и бактериальными токсинами.
К анаэробным спорообразующим возбудителям специфической инфекции относится палочка столбняка, сапрофитирующая в кишечнике домашних животных и человека, откуда она попадает в почву и в виде спор может сохраняться длительное время. Загрязнение ран землёй, содержащей споры палочки, может привести к развитию столбняка. Палочка выделяет сильные экзотоксины - тетаноспазмин и тетаногемолизин.
Патогенез
Для развития воспаления гноеродные микробы должны проникнуть через повреждённый эпителий кожи или слизистые оболочки (входные ворота) во внутреннюю среду организма. Неповреждённые кожа и слизистые оболочки являются надёжным барьером, через который микробы проникнуть не могут. Нарушение эпидермиса кожи или эпителия слизистых оболочек, способствующее внедрению микробов, может быть результатом механической травмы, воздействия химических веществ, аллергических факторов, бактериальных токсинов и других травмирующих агентов. Размер повреждения не имеет решающего значения: микроорганизмы проникают во внутреннюю среду при любом - большом или крайне малом (микротравмы) нарушении целостности покровов тела.
Через дефект эпителия микроорганизмы попадают в межклеточные щели, лимфатические сосуды и с током лимфы заносятся в глубжеле- жащие ткани (подкожную жировую клетчатку, мышцы, лимфатические узлы и т.д.). Дальнейшее распространение и развитие воспалительного процесса определяются соотношением количества и вирулентности проникших микробов с иммунобиологическими силами организма.
Если количество микробных тел и их вирулентность невелики, а иммунобиологические силы организма значительны, воспалительный процесс не развивается или, начавшись, быстро прекращается.
Большое влияние на развитие воспаления оказывают местные условия - состояние тканей в зоне внедрения микрофлоры. Микроорганизмы встречают значительное сопротивление в областях тела с хорошо развитой сетью кровеносных сосудов и хорошим кровоснабжением и, наоборот, легче развиваются в областях тела с недостаточным кровообращением. Так, на голове и лице, где имеется густая сеть кровеносных сосудов, гнойные процессы развиваются реже, чем в других областях тела.
Местные иммунобиологические особенности тканей также оказывают влияние на частоту и тяжесть развития гнойных процессов. Весьма значительно сопротивление микробам тканей тех областей тела, которые подвергаются частому воздействию микробов и их токсинов. Например, в области промежности гнойные воспаления встречаются реже, чем в других областях, а процессы регенерации проходят здесь быстрее.
Для развития проникших в органы и ткани микробов необходимо некоторое время для их приспособления к новой биологической среде. Попавшие в рану микроорганизмы обычно начинают проявлять свою жизнедеятельность и размножаться через 5-6 ч. На этом основана методика обработки случайных ран в первые часы после повреждения, цель которой - удалить микрофлору и повреждённые ткани во избежание развития гнойного процесса.
Благоприятствующие факторы
Моментами, благоприятствующими развитию микробов, являются:
наличие в зоне травмы питательней среды для микроорганизмов (кровоизлияние, мёртвые клетки, ткани);
одновременное проникновение нескольких микробов (полиинфекция), оказывающих синергическое действие;
проникновение микробов повышенной вирулентности, например из очага воспаления у другого больного или очага в другом органе или тканях.
Обычно воспалительный процесс, вызванный каким-либо одним видом микроба, протекает легче, чем вызванный несколькими видами микроорганизмов. Вторичное инфицирование не только ухудшает течение воспалительного процесса, но нередко повышает биологическую активность первичной микробной флоры, поэтому при обследовании и лечении больных с гнойными заболеваниями необходимо особенно пунктуально соблюдать правила асептики.
Реакция организма
Внедрение микробов сопровождается местными и общими проявлениями. Проникновение микроорганизма в ткани вызывает местную реакцию, выражающуюся прежде всего в изменениях кровообращения нервно-рефлекторной природы: сначала развивается артериальная гиперемия, затем венозный стаз с образованием отё- ка, появлением болей, местным повышением температуры, нарушением функций и т.д. В воспалительном экссудате накапливается большое ко- личество нейтрофильных лейкоцитов. Полнота проявлений, степень выраженности (яркость) местных симптомов и быстрота их развития у больных различны, что зависит от состояния реактивности организма.
Различают гиперергическую, нормергическую, гипергическую и анергическую формы воспалительной реакции.
У одних больных гнойный процесс развивается бурно, распространяясь на окружающие ткани, в том числе сосуды, с образованием тромбозов, обширных отёков, вовлечением в процесс лимфатических сосудов и узлов, развитием не только обширной местной, но и тяжёлой общей реакции. Такая гиперергическая реакция, несмотря на своевременное и рациональное лечение, нередко приводит к летальному исходу.
У других больных процесс развивается не столь быстро. Воспалительный процесс захватывает меньшее количество тканей, отёк бывает небольшим, общая реакция не носит резко выраженного характера - не- значительное повышение температуры тела, изменение состава крови и т.д. Такая нормергическая реакция на гнойную инфекцию и местный гнойный процесс, вызвавший её, довольно легко ликвидируется при своевременно начатом и правильном лечении.
У некоторых больных местное гнойное заболевание протекает при слабовыраженных местной и общей реакциях. Воспаление в этих случаях ограничивается только локализацией процесса (карбункул, абсцесс и др.), отёк окружающих тканей почти отсутствует, лимфангиита, лимфаденита, тромбоза не наблюдается, температура тела повышается незначительно и т.д. Такие процессы со слабовыраженной местной и общей реакциями (гипергическая реакция) легко поддаются лечению, а у части больных местные гнойные очаги ликвидируются без лечения.
Гнойный процесс может ограничиться поверхностно расположенными тканями (абсцесс, фурункул, карбункул) либо вовлечь в процесс глубжележащие ткани на значительном протяжении, что приведёт к образованию обширной межмышечной флегмоны. Может он также распространиться по подкожной клетчатке, т.е. вызвать распространённую эпифасциальную флегмону с отслоением и разрушением значительных участков кожи.
Результатом местной реакции макроорганизма на внедрившуюся микрофлору является развитие защитных барьеров. Прежде всего образуется лейкоцитарный вал, отграничивающий очаг инфекции от внутренней среды организма; такими же барьерами служат лимфатические узлы. В процессе развития тканевой реакции вокруг гнойного очага и вследствие размножения клеток соединительной ткани образуется грануляционный вал, который ещё более надёжно ограничивает гнойный очаг. При длительном существовании ограниченного гнойного процесса из окружающего его грануляционного вала образуется плотная пиогенная оболочка, которая является надёжным барьером, ограничивающим воспалительный очаг, - формируется абсцесс.
При наличии высоковирулентной микробной флоры и слабой реакции организма защитные барьеры образуются медленно, что нередко ведёт к прорыву инфекции через лимфатические пути (сосуды, узлы) в кровеносное русло; в таких случаях развивается общая инфекция.
Общая реакция организма
Одновременно с местной реакцией на внедрившиеся микробы отмечается общая реакция организма, степень выраженности которой зависит от количества бактериальных токсинов и продуктов распада тканей, проникших в организм из очага поражения, а также общей сопротивляемости организма неблагоприятным факторам. Вирулентные микробы, выделяя сильные токсины, вызывают обычно более бурную общую реакцию.
Гнойный воспалительный процесс часто приводит к развитию интоксикации, которая обусловливается разными причинами.
В очаге воспаления вследствие размножения, жизнедеятельности, гибели микроорганизмов освобождаются бактериальные эндо- и экзотоксины, которые, всасываясь в кровь, оказывают токсическое действие. Кроме того, распад тканей в очаге воспаления приводит к образованию токсических продуктов, а нарушения обмена веществ с преобладанием анаэробных процессов над аэробными способствуют накоплению в организме молочной и пировиноградной кислот и других продуктов воспаления (цитокинов, интерлейкинов, простагландинов и др.). Все эти токсические продукты из очага воспаления проникают в кровь и влияют на деятельность жизненно важных органов - мозга, сердца, печени, почек и др.
Второй источник интоксикации - накопление в крови токсических продуктов жизнедеятельности организма вследствие нарушения функций органов, обеспечивающих дезинтоксикацию (печени, почек). Нарушаются связывание и выведение из организма метаболических продуктов, образующихся за счёт нормальной жизнедеятельности организма (продуктов азотистого обмена - мочевины, креатинина), а также токсических продуктов, проникающих в кровь из очага воспаления (бактериальных токсинов, продуктов распада тканей и др.).
Третий источник интоксикации - всасывание в кровь токсических продуктов, образовавшихся вследствие нарушения деятельности органов под влиянием воспаления, как это наблюдается при перитоните, когда в результате развившегося пареза кишечника в нём скапливаются и разлагаются продукты пищеварения, пищеварительные соки (жёлчь, ферменты). Эти токсические продукты всасываются в большом количестве в кровь, усиливая токсемию и общую интоксикацию организма.
Развивающаяся эндогенная интоксикация проявляется токсемией и зависит от тяжести и распространённости гнойного воспаления, распада тканей. Обусловлена она бактериемией, бактериальной токсемией, накоплением в крови токсических продуктов распада тканей (полипептидов, некротических тел), нарастанием количества циркулирующих иммунных комплексов (ЦИК), образовавшихся при взаимодействии антиген-антитело, ростом концентрации мочевины, протеолитических ферментов, освобождающихся при распаде клеток (например, лизосомальные протеазы при распаде лейкоцитов), накоплением таких метаболитов, как этанол, ацетон и др.
Распад тканей при некротическом процессе, потеря белка с раневым отделяемым, нарушением электролитного и водного баланса, интоксикация, нарушение гемостаза - основные факторы, определяющие изменения ОЦК при гнойном воспалении. У больных с гнойными заболеваниями чаще возникает гиповолемия олигоцитемического типа, которая находится в прямой зависимости от степени интоксикации и тяжести общего состояния. В тяжёлых случаях ОЦК снижается на 15- 25%, объём плазмы - на 7-10%, глобулярный объём - на 8-15%. Объём циркулирующих белков, несмотря на гиповолемию, изменён в меньшей степени, но количество циркулирующих альбуминов снижается постоянно у всех больных. Одновременно увеличивается объём циркулирующих глобулинов.
При гнойно-воспалительных заболеваниях изменяются водно-электролитный баланс, кислотно-основное состояние. В большей степени нарушения выражены при тяжёлом распространённом гнойном процессе и тяжёлом состоянии больного. Происходит перераспределение жидкости: развивается клеточная гидратация с внеклеточной дегидратацией, нарушением кислотного и основного баланса организма. Наиболее выраженные нарушения, требующие неотложной коррекции, отмечаются при сепсисе, разлитом гнойном перитоните, распространённых флегмонах клетчаточных пространств средостения, забрюшинного пространства. Нарушения в электролитном балансе зависят также от стадии течения воспалительного процесса - они наиболее выражены в фазу развития воспаления и распада тканей, когда происходит снижение концентрации ионов калия в плазме (вследствие потери ионов с гнойным отделяемым, воспалительным экссудатом). В фазу регенерации концентрация ионов натрия в плазме повышается, что обусловлено их поступлением в кровь из очага воспаления при обратном его развитии. Определённые изменения в ионном соотношении возникают и в очаге воспаления: наряду с гидратацией тканей отмечаются снижение концентрации ионов калия и повышение - ионов натрия и хлора. Такой процесс «перемещения» в воспалённых тканях воды и электролитов играет большую роль в нарушении водно-электролитного баланса организма и ОЦК.
Токсикоз и гипоксия
Итак, воспалительный процесс приводит к серьёзным изменениям в организме, нарушению функций различных органов и систем, что требует специальных лечебных мероприятий по предупреждению и устранению развившейся интоксикации.
В основе почти всех патологических изменений, возникающих в организме ребенка, больного пневмонией, лежат два ведущих причинных фактора - токсикоз и гипоксия.
Развитию воспалительного процесса легких у грудных детей способствуют богатая васкуляризация слизистой оболочки трахеи бронхов, полнокровие легочной ткани и значительное образование в ней интерстициальной ткани. Малейшее набухание слизистой носа, богатой кровеносными и лимфатическими сосудами, затрудняет прохождение воздуха через узкие носовые ходы, ребенок начинает дышать через рот, что облегчает аэрогенное инфицирование легких и определяет охлаждение слизистой дыхательных путей.
Токсикоз является прямой и косвенной причиной развития гипоксии, которая у детей имеет чаще смешанное происхождение - респираторное, циркуляторное, гемическое и цитотоксическое. Нарушения функции внешнего дыхания и альвеолярного газообмена, прежде всего, связаны с воспалительными изменениями в бронхоальвеолярной системе, из-за уменьшения дыхательной поверхности легких (отек, инфильтрация тканей, накопление слизи в мелких бронхах, ателектазы). Одновременно нарушается проницаемость легочных мембран, что резко затрудняет диффузию газов через них.
Вторая группа факторов обусловлена нарушением нейрогуморальной регуляции функции дыхательной мускулатуры, в том числе мускулатуры бронхов. На высоте заболевания отмечается дезорганизация респираторных движений ребер и диафрагмы, что выражается в несинхронности и неравномерности амплитуды их экскурсий, в периодических формах дыхания (Чейн-Стокса, Биота), в значительном угнетении функции межреберных мышц и дыхательного центра. Тяжелые формы пневмоний у детей младшего возраста сопровождаются значительными циркуляторными расстройствами с явлениями застоя крови, глубокими метаболическими сдвигами, развитием энергетически-динамической недостаточности сердца, коллапсом или состоянием, близким к нему. При этом существенно нарушается легочное кровообращение (Л.В.Асмоловская,1971),повышается проницаемость капилляров с развитием перикапиллярного отека.
Респираторные и циркуляторные нарушения ведут к развитию артериальной гипоксемии, степень которой прямо зависит от тяжести пневмонии.
Конечным звеном в длинной цепи патофизиологических изменений является кислородное голодание тканей, к которому особенно чувствительны структуры центральной нервной системы, сердца, печени, почек. Нарушение тканевого дыхания также обусловлено угнетением активности дыхательных клеточных ферментов, развивающимся респираторным и метаболическим ацидозом.
Рядом авторов доказано значение сурфактанта в патогенезе пневмоний. Патогенез стафилококковых заболеваний самым тесным образом связан и с действием токсинов и ферментов, выделяемых стафилококками - гемолизина, некротоксина, летального токсина, нефротоксина (поражает кортикальный слой почек), лейкоцидина (разрушает лейкоциты), энтеротоксина, стафилокоагулазы, фибринолизина и др. Вторая сторона патогенеза "стафилококковой болезни» обусловлена гиперсенсибилизацией организма ребенка бактериальными протеинами.
Общие принципы лечения
Лечение воспалительных заболеваний проводят с учётом общих принципов лечения и особенностей характера и локализации патологического процесса (флегмона, абсцесс, перитонит, плеврит, артрит, остеомиелит и др.).
Основные принципы лечения больных с хирургической инфекцией:
этиотропная и патогенетическая направленность лечебных мероприятий;
комплексность проводимого лечения: использование консервативных (антибактериальной, дезинтоксикационной, иммунотерапии и др.) и оперативных методов лечения;
проведение лечебных мероприятий с учётом индивидуальных особенностей организма, характера, локализации и стадии развития воспалительного процесса.
Омфалит
Омфалит (от греч. omphalitis: omphalos - пупок, -itis -воспаление) - воспаление кожи и подкожной клетчатки в области пупка. Наиболее частыми возбудителями омфалита являются стафилококк и кишечная палочка.
Различают несколько форм омфалита: простую, флегмонозную и некротическую.
Простая форма (катаральный омфалит, «мокнущий пупок») является наиболее частой формой заболевания. Обычно к моменту выписки ребенка из роддома (на 4-6-е сутки) пупочная ранка покрыта кровянистой корочкой, которая в обычных условиях отпадает, и к 10-14-му дню жизни пупочная ранка заживает (покрывается эпителием - тканью, выстилающей всю поверхность тела). При воспалении заживление пупочной ранки затягивается, из нее появляется прозрачное (серозное) или желтоватое (серозно-гнойное), иногда кровянистое отделяемое. Может наблюдаться небольшое покраснение пупочного кольца. Периодически ранка покрывается коркой и под ней скапливается необильное отделяемое. Длительное мокнутие (2 недели и более) может приводить к образованию на дне пупочной ранки избыточных разрастаний грибовидной формы (фунгус пупка), которые затрудняют ее заживление. Общее состояние ребенка при этой форме чаще не нарушается, иногда отмечается небольшое повышение температуры (около 37,5°С).
Таким образом, основными признаками простой формы омфалита являются:
длительное заживление пупочной ранки (обычно заживление происходит до 14-го дня жизни);
отделяемое из пупочной ранки - при нормальном заживлении отделяемое либо отсутствует, либо очень скудное в течение первой, реже - второй недели жизни. После 14-го дня жизни пупок должен быть сухим;
непостоянный признак - небольшое покраснение пупочного кольца (при обычном заживлении пупочной ранки покраснения нет).
Более тяжелой является флегмонозная форма омфалита. При этой форме воспалительный процесс переходит на окружающие ткани. Заболевание обычно начинается к концу первой или на второй недели жизни, нередко с «мокнущего пупка». Затем помимо мокнутия появляется обильное гнойное отделяемое (пиорея) и выбухание пупка, покраснение и отечность околопупочной области. Кожа вокруг пупка, становится горячей на ощупь. Возможно изъязвление пупочной ранки, покрытое налетом, окруженное плотным кожным валиком. При надавливании на околопупочную область из пупочной ранки выделяется гной. Общее состояние ребенка ухудшается, температура повышается до 38°С, малыш становится вялым, плохо сосет грудь, срыгивает, может быть рвота, уменьшается прибавка массы тела.
Некротическая (гангренозная) форма встречается редко и развивается у резко ослабленных детей (с тяжелой гипотрофией - низкой массой тела при рождении, сниженным иммунитетом). Воспаление быстро распространяется вглубь, почти всегда переходит на пупочные сосуды. Кожа и подкожная клетчатка становятся синюшного цвета, некротизируются (омертвевают). Некротический процесс может охватывать все слои передней брюшной стенки, вплоть до развития перитонита - воспаления соединительнотканной оболочки, выстилающей брюшную полость и покрывающей ее органы. Состояние ребенка тяжелое. Температура тела повышается редко, поскольку ребенок изначально истощен, возможно даже ее некоторое снижение (ниже 36°С), отмечается вялость, снижение двигательной активности, заторможенность, нарушение реакции на окружающих.
Омфалит (его флегмонозная и некротическая формы) может осложняться развитием:
флегмоны передней брюшной стенки - разлитого воспаления подкожной клетчатки;
контактного перитонита;
абсцессов печени.
Возможно возникновение сепсиса и отдаленных гнойных очагов: остеомиелита, деструктивной пневмонии, энтероколита и др.
Лечение омфалита
При простой форме возможно лечение врачом на дому, при всех остальных - только в детской больнице (в отделении патологии новорожденных), Важно не допустить скопления гнойного содержимого и разрастаний под коркой, для чего необходима своевременная обработка пупочной ранки.
При простой форме пупочная ранка сначала промывается раствором перекиси водорода, а затем обрабатывается спиртовыми или водными растворами антисептиков 3-4 раза в день. Фунгус пупка прижигается нитратом серебра, также назначаются ванны со слабым (розовым) раствором калия перманганата.
Лечение флегмонозной формы проводят с участием хирурга. Помимо обработки пупочной ранки антисептиками врач порекомендует закладывать мази с антибактериальными веществами. По показаниям назначаются антибиотики, противостафилококковый иммуноглобулин.
При некротической форме омфалита иссекают омертвевшие ткани до границы со здоровой кожей, также проводится антибактериальная и дезинтоксикационная терапия (внутривенное введение специальных растворов для уменьшения интоксикации).
При всех формах омфалита возможно применение физиолечения (ультрафиолетовое облучение пупочной ранки, применение гелий-неонового лазера, терапия токами ультравысокой и сверхвысокой частоты на пупочную ранку - УВЧ- и СВЧ-терапия). Для профилактики омфалита необходим правильный уход за пупочной ранкой с обязательным соблюдением стерильности при ее обработке.
Мастит
Мастит (mastitis) - воспаление паренхимы и интерстициальной ткани молочной железы.
Возбудителем мастита чаще является стафилококк в виде монокультуры и в ассоциациях с кишечной палочкой и стрептококком, реже - в изолированном виде кишечная палочка или стрептококк, иногда встречаются протей, синегнойная палочка, анаэробная флора, грибы. Выделяют также специфические редко встречающиеся формы мастита - туберкулёзный, сифилитический. Источником инфекции являются бактерионосители и больные со стёртыми формами гнойно-воспалительных заболеваний из окружения пациента. Первостепенное значение в возникновении мастита имеет внутрибольничная инфекция.
Симптомы гнойного мастита новорожденных
Увеличение в размере грудных желез.
Покраснение грудных желез.
Грудные железы горячие на ощупь.
При прикосновении к грудным железам ребенок резко становится беспокойным, начинает плакать (из-за резкой болезненности).
Возможно выделение гноя из грудных желез при надавливании на них или самопроизвольно.
Общее состояние ребенка ухудшается — ребенок беспокойный, плаксивый.
Возможно повышение температуры тела (от 37,5° С до 40° С).
Снижение аппетита.
На фоне повышения температуры (выше 39° С) возможны судороги и рвота.
При надавливании на грудную железу может ощущаться движение жидкости под кожей (гной).
Диагностика
Диагностика основана на появлении вышеописанных симптомов (воспаление грудных желез, ухудшение самочувствия, повышение температуры тела) у детей первых трех месяцев жизни.
Для определения возбудителя инфекции и подбора рациональной антибиотикотерапии прибегают к посеву отделяемого из желез (гноя) с определением чувствительности к антибиотикам.
Лечение гнойного мастита новорожденных
Лечение проводят в условиях стационара.
Применяют:
антибактериальную терапию;
противовоспалительную терапию;
местно — компрессы на пораженную железу;
при отсутствии эффекта или запущенном мастите (своевременно ребенку не была оказана помощь) прибегают к хирургическому лечению: воспаленную железу вскрывают и удаляют гной (дренируют);
после операции используют рассасывающие мази и компрессы, физиолечение.
Флегмона новорожденных
Флегмона новорожденных — тяжелое гнойно-инфекционное заболевание, вызываемое стафилококком. Тяжелому течению заболевания способствуют низкая иммунологическая реактивность новорожденного и низкая чувствительность стафилококка ко многим антибиотикам. Часто заболеванию предшествует опрелость, нередко — пиодермия.
Этиопатогенез.
Тонкая кожа ребенка легко повреждается.
Хорошее кровоснабжение подкожной клетчатки, обильная сеть лимфатических сосудов, отсутствие соединительнотканных перемычек (способствуют быстрому распространению инфекции).
Нарушение правил ухода за новорожденным — возникновение опрелостей, отдельных гнойничков, остатки мочи и фекалий на коже.
Заболевание начинается на 5—8-й день жизни, иногда несколько позже, с подъема температуры до 38—39°; дети беспокойны, плохо сосут грудь. Отмечается ограниченное покраснение кожи, чаще на спине (особенно в поясничной и крестцовой области).
Общие симптомы:
повышение температуры тела до 38-39° С;
быстрое нарастание интоксикации — ухудшается общее состояние ребенка, он вялый, отказывается от еды;
кожные покровы серые с мраморным оттенком;
частое поверхностное дыхание;
учащенное сердцебиение;
глухие тоны сердца.
В месте поражения:
участок покраснения и уплотнения с четкими границами, болезненный при пальпации (прощупывании), кожа над очагом поражения горячая на ощупь, не собирается в складки;
через 8-12 часов пораженный участок увеличивается в 2-3 раза, кожа над ним приобретает синюшный оттенок, появляется отек окружающих тканей;
в центре очага появляется размягчение (на ощупь участок более мягкий, чем по краям);
в некоторых случаях начинается некроз (отмирание) кожи, ее отторжение с образованием обширных раневых дефектов — дно раны серого цвета с остатками омертвевшей ткани, края подрытые, неровные;
при благоприятном течении образуются раны небольших размеров (3-6 см в диаметре), которые постепенно заживают;
на месте раны часто образуются грубые рубцы, вызывающие деформацию грудной клетки, поясничный лордоз и кифоз (изгиб позвоночника выпуклостью вперед и назад соответственно), прогрессирующие с ростом ребенка
Формы некротической флегмоны новорожденного:
Простая форма: преобладают местные явления (воспаление в месте поражения), а общее состояние остается сравнительно удовлетворительным.
Токсикосептическая форма - действие токсинов (отравляющих веществ, вырабатываемых возбудителем заболевания (стафилококком, стрептококком)) распространяется на весь организм. Характеризуется:
быстрым ухудшением общего состояния,
нередко рвотой и поносами
и бурным (очень быстрым) течением, что может привести к летальному исходу уже в первые сутки заболевания.
Лечение некротической флегмоны новорожденных
Лечение хирургическое – вскрытие флегмоны, удаление гноя (Вскрытие инфильтрата производят множественными небольшими разрезами- насечками. Разрезы на границе здоровой и пораженной кожи лучше способствуют оттоку отделяемого и ограничению воспалительного процесса).
В послеоперационном периоде – мазевые повязки на рану.
Стимуляция заживления раны путем применения консервированной плаценты, фибринной пленки, ультрафиолетового облучения, УВЧ-терапии.
Интенсивная терапия, включающая дезинтоксикационные, антибактериальные мероприятия.
Общеукрепляющая и иммуностимулирующая терапия (витамины А, Е, группы В, полноценное питание, покой).
При благоприятном течении процесса рана постепенно заполняется грануляциями и медленно рубцуется. Осложнения проявляются в виде вторичного сепсиса. При своевременном и правильном лечении исход благоприятный.
Профилактика заключается в безупречном уходе за новорожденными, в строгой изоляции детей, заболевших пиодермией.
Какая особенность в проведении оперативного пособия при вскрытии и дренировании некротической флегмоны у новорожденных?
 Нанесение
множественных разрезов-насечек длиной
6-8 мм в шахматном порядке по всей краям
очага
Нанесение
множественных разрезов-насечек длиной
6-8 мм в шахматном порядке по всей краям
очага
Лимфаденит
Лимфаденит – это воспалительное поражение лимфатических узлов. Патологическая реакция лимфоузлов при данном заболевании являет собой барьерную функцию лимфатической системы, ограничивающую распространение инфекции по организму. Между тем, активное развитие лимфаденита может стать стартовой точкой для появления распространенных гнойных процессов: сепсиса и аденофлегмоны.
Этиология
Неспецифический лимфаденит чаще всего возникает, как осложнение другого воспалительного процесса. Возбудителем данного заболевания становится гноеродная патогенная флора – стафилококки, стрептококки, а также вырабатываемые ими продукты тканевого распада и токсины, проникающие в лимфоузлы гематогенным, лимфогенным или контактным путем.
Первостепенным очагом воспаления при лимфадените могут быть гнойные раны, фурункулы, флегмоны, панариции, карбункулы, трофические язвы, рожистое воспаление, кариес, тромбофлебит или остеомиелит. При этом, регионарные воспалительные процессы чаще всего вызывают местный лимфаденит.
Симптоматика.
Первым признаком неспецифического лимфаденита является болезненность и увеличение регионарных лимфоузлов. При гиперпластической и катаральной форме заболевания увеличенные узлы легко выявляются на ощупь при обычном медицинском осмотре.
Нагноение лимфатического узла сопровождается активной интоксикацией организма (лихорадкой, головной болью, общей слабостью и ухудшением аппетита), а сам узел становится болезненным, плотным и теряет свои контуры. В области пораженного узла появляется отечность и гиперемия, а через некоторое время происходит его гнойное расплавление, сопровождающееся появлением флюктуации.
При отсутствии лечения лимфаденита, происходит прорыв гноя наружу или в прилежащие ткани. В последнем случае у больного проявляются признаки развития аденофлегмоны, проявляющиеся в виде плотного, разлитого и болезненного инфильтрата с обособленными участками размягчения. При развитии гнилостной формы лимфаденита, во время пальпации узла фиксируется газовая крепитация (легкое похрустывание). При развитии деструктивных процессов прогрессируют общие нарушения: появляется тахикардия, лихорадка, дает о себе знать интоксикация, нарушается сон. Помимо этого, в большинстве случае у больного поднимается температура и ухудшается или полностью пропадает аппетит.
Как правило, диагностирование острого неспецифического лимфаденита, имеющего поверхностную локализацию, производится на основании выраженных клинических признаков, жалоб больного и не вызывает затруднений. Гораздо хуже дело обстоит с выявлением осложненных форм заболевания, то есть в тех случаях, когда оно протекает с вовлечением забрюшинного пространства и клетчатки средостения, а также с аденофлегмоной или периаденитом. В частности, сложность диагностирования лимфаденита заключается в его дифференциации с флегмоной, остеомиелитом и нагноившейся атеромой. При хроническом течении заболевания для подтверждения диагноза, а также для дифференциации его от лейкоза, лимфогрануломатоза, саркоидоза и других заболеваний, проводится пункционная биопсия лимфоузла или его иссечение с гистологическим анализом.
В свою очередь, подтверждение диагноза специфического лимфаденита опирается на целый ряд клинико-лабораторных данных, полученных, как результаты:
туберкулиновых проб Пирке и Манту;
микроскопического исследования пунктата;
рентгенографии грудной клетки, мягких тканей шеи, подмышечной, подчелюстной и паховой зоны;
ультразвуковой допплерографии лимфатических сосудов;
компьютерной томографии;
лимфосцинтиграфии;
магнито-резонансной томографии пораженных сегментов;
рентгеноконтрастной лимфографии.
Лечение лимфаденита
В большинстве случаев гиперпластический и катаральный лимфаденит, протекающий в острой форме, лечится консервативно. Больному рекомендуют обеспечить состояние покоя для пораженной области и назначают ему антибиотикотерапию с учетом чувствительности патогенной флоры, а также витаминотерапию и УВЧ-терапию.
При гнойном лимфадените производится вскрытие образовавшейся аденофлегмоны или абсцесса, дренирование очага воспаления и его санация. Помимо этого, больному назначается активная антибактериальная и дезинтоксикационная терапия. Повышенное внимание уделяется и лечению основного заболевания, поддерживающего воспалительный процесс в лимфоузлах при хроническом неспецифическом лимфадените.
В свою очередь, лечение специфических лимфаденитов начинается с терапии первичного процесса (этиологического агента), в роли которого могут выступать такие заболевания, как гонорея, туберкулез, сифилис, актиномикоз и другие.
Прогноз лимфаденита и его профилактика
При своевременно начатом и грамотном лечении прогноз лимфаденита благоприятный. При отсутствии же необходимой терапии наблюдается распространение и генерализация патологического процесса, развитие нарушений лимфооттока, лимфедема, а также рубцевание самого лимфатического узла с развитием процесса замещения лимфоидной ткани.
Профилактика лимфаденита подразумевает под собой:
предупреждение получения микротравм кожи;
предотвращения инфицирования полученных ссадин, ран и других повреждений эпидермиса;
своевременное устранение очагов инфекции (например, лечение кариеса зубов или ангины), вскрытие гнойных патологических образований (фурункулов и панарициев);
своевременная, точная диагностика и адекватное лечение заболеваний, вызывающих специфические формы лимфаденита (гонореи, туберкулеза, сифилиса, актиномикоза и других).
Парапроктит
Острый парапроктит (paraproctitis) - гнойное воспаление околопрямокишечной клетчатки.
Этиология и патогенез
Возбудителями парапроктита чаще являются кишечная палочка, золотистый и белый стафилококки, анаэробы и др. Как правило, определяется смешанная микрофлора.
Внедрению микроорганизмов в параректальную клетчатку способствуют трещины заднего прохода, воспаление геморроидальных узлов, повреждение слизистой оболочки прямой кишки и заднепроходного канала, воспаление крипт, промежностные гематомы, расчёсы покровов заднего прохода и др. Флегмоны околокишечной клетчатки возможны как осложнение огнестрельных ранений, а также распадающейся опухоли.
Воспалительный процесс отличается выраженным отёком и гнойной инфильтрацией рыхлой соединительной ткани. Гнилостная инфекция, распространяясь по околопрямокишечной клетчатке либо по лимфатическим путям на клетчатку таза, часто вызывает некроз - распад тканей без формирования гнойников (гнилостно-некротический парапроктит).
Различают пять форм ограниченных параректальных гнойников:
подкожный
ишиоректальный
подслизистый
пельвиоректальный
ретроректальный

Расположение гнойников при остром парапроктите.
Поперечный (а) и сагиттальный (б) срезы. 1 - подкожный; 2 - ишиоректальный; 3 - пельвиоректальный; 4 - подслизистый; 5 - ретроректальный.
Формы парапроктита
Ишиоректальный парапроктит протекает с тяжёлыми общими явлениями. Процесс, захватывая глубокие слои клетчатки седалищно-прямокишечных впадин, распространяется позади прямой кишки на другую сторону до предстательной железы и, идя кверху, захватывает тазовую клетчатку. Больные отмечают пульсирующую боль в области прямой кишки, высокую температуру тела, иногда озноб.
Отёк, гиперемия кожных покровов при общей интоксикации облегчают диагностику у больных с этой формой парапроктита. Однако в начальной стадии заболевания, когда отсутствуют внешние его признаки, необходимо произвести бимануальное исследование, вводя палец одной руки в прямую кишку и помещая палец другой руки на припухлость снаружи. При этом можно определить болезненный инфильтрат.
Подслизистый парапроктит локализуется в подслизистом слое прямой кишки выше заднепроходных столбов. При пальцевом исследовании можно определить отёчность и болезненность в области заднепроходного отверстия. В отличие от подкожных абсцессов боль при подслизистой форме парапроктита менее интенсивная.
Пельвиоректальный парапроктит - редкая, но самая тяжёлая форма околопрямокишечных гнойников. Абсцесс формируется выше тазового дна, но может быть расположен также низко, спереди, сзади, по бокам прямой кишки. Заболевание в начальной стадии характеризуется отсутствием каких-либо наружных признаков воспаления в области заднего прохода, ишиоректальных впадин. В дальнейшем воспалительный процесс, перфорируя мышцу, поднимающую задний проход, спускается книзу между сухожильной дугой и запирательной фасцией в клетчатку седалищно-прямокишечной впадины, при этом здесь возникает гнойник с характерными клиническими признаками ишиоректального абсцесса.
Если пельвиоректальные абсцессы располагаются низко над мышцей, поднимающей задний проход, то при пальцевом исследовании прямой кишки сравнительно рано можно определить выбухание.
Ретроректальный парапроктит образуется в результате занесения инфекции в лимфатические узлы и отличается от пельвиоректального только тем, что сначала гнойник располагается в клетчатке позади прямой кишки, а затем может также спуститься в ишиоректальную клетчатку и вызвать её флегмонозное воспаление.
Гнойно-воспалительные заболевания у детей. Травма грудной клетки
Лечение парапроктита
Разрезы, применяемые при остром парапроктите: 1 - перианальный абсцесс; 2 - позадипрямокишечный; 3 - ишиоректальный.
Хирургические доступы, применяемые при ишиоректальном (1) и пельвиоректальном (2) абсцессах.
В самой начальной стадии заболевания при наличии небольшого инфильтрата в перианальной области применяют консервативные методы лечения: сидячие тёплые ванны с раствором перманганата калия, поясничную прокаиновую блокаду, грелки, УВЧ-терапию и др. Все тепловые процедуры сочетают с антибиотикотерапией.
Оперативное лечение острого парапроктита включает раннее экстренное хирургическое вмешательство путём вскрытия гнойника с удалением гноя и некротизированных тканей, обследование полости гнойника пальцем, разделение перемычек и дренирование полости.
Применяют радиальный, полулунный, крестообразный разрезы, наиболее удобные из них - полулунный и радиальный (рис. 2, 3). Они обеспечивают зияние раны и отток гнойного экссудата, а также менее травматичны. Необходим строгий постельный режим. При рефлекторной задержке мочи больным кладут грелку на область мочевого пузыря или внутривенно вводят 5-10 мл 40% раствора метенамина.
При гнилостно-некротическом парапроктите во время операции производят полное иссечение омертвевшей клетчатки в пределах здоровых тканей, а также выполняют два-три дополнительных разреза кожи и подкожной клетчатки для дренирования.
Острый гематогенный остеомиелит
Остеомиелит (osteomyelitis) - инфекционное заболевание, характеризующееся воспалением костной ткани с вовлечением в патологический процесс костного мозга, компактной части кости, надкостницы и нередко окружающих мягких тканей.
Этиология и патогенез
Остеомиелит - заболевание полиэтиологическое, вызывается различными неспецифическими возбудителями гнойной инфекции, среди которых чаще встречаются стафилококки, реже - стрептококки, пневмококки, энтеробактерии и другие, а в 10-15% случаев - микробные ассоциации. Возбудителями могут быть и специфические микроорганизмы (туберкулёзная палочка, палочка брюшного тифа, бледная спирохета), а также грибы (актиномицеты).
Из очагов инфекции, имеющихся в организме (например, фурункул, карбункул, гнойный синусит, тонзиллит, отит, флегмоны, абсцессы, рожа и др.), микробы заносятся током крови в костный мозг, где оседают и при определённых условиях вызывают воспаление.
Острый гематогенный остеомиелит чаще встречается у мальчиков в подростковом возрасте. Воспалительный процесс обычно локализуется в длинных трубчатых костях (голень, бедро, плечо).
К факторам, влияющим на развитие остеомиелита, относятся:
особенности кровоснабжения костей у детей, у которых диафизы костей имеют магистральный тип кровоснабжения, а для эпифизов и метафизов характерна петлистая сеть мелких сосудов и капилляров, что способствует оседанию в них микроорганизмов (эмболическая теория Боброва-Лексера);
в развитии остеомиелита важную роль играют биологические и иммунологические особенности организма: бактериемия и занос микробов в сосуды костного мозга приводят к развитию воспалительного процесса лишь при определённой реакции организма, обусловленной состоянием сенсибилизации, ранее возникшей под воздействием различных факторов - таких, как асептическое воспаление, инфекционные заболевания, воздействие продуктов распада белков в организме и других антигенов (аллергическая теория С.М. Дерижанова);
предрасполагающие моменты, к которым относятся травма кости, снижение общей сопротивляемости организма, обусловленное переутомлением, инфекционным заболеванием, гиповитаминозом и др.
Воспалительный процесс при гематогенном остеомиелите начинается в костном мозге в виде его гиперемии и отёка (как проявление серозного воспаления). В последующем развивается гнойная инфильтрация с появлением флегмоны. В этот период возможны тромбоз сосудов и образование некроза кости. По каналам остеона (гаверсовым каналам) гнойно-воспалительный процесс распространяется кнаружи, проходит через слой кости и вовлекает в воспаление надкостницу (периостит). Скопление гноя под надкостницей отслаивает её с образованием поднадкостничного абсцесса. При разрушении надкостницы воспалительный процесс распространяется кнаружи, захватывая окружающие кость ткани с образованием параоссальной флегмоны. Последующее вовлечение в процесс кожи и подкожной клетчатки приводит к самопроизвольному вскрытию флегмоны и образованию гнойного свища. Тромбоз кровеносных сосудов, питающих кость в зоне её компактного слоя, а также воспаление кости (остит) вызывают её некроз и секвестрацию (отторжение). Секвестры могут быть кортикальными, тотальными, центральными. Происходящие одновременно процессы пролиферации кости приводят к развитию периостальных наслоений, иногда с окостенением (оссификацией). Развитие грануляционной ткани в процессе оссификации способствует образованию секвестральной коробки, окружающей секвестр. Образование секвестра и секвестральной коробки, наличие свищей характеризуют переход воспаления в хроническую форму (вторичный хронический гематогенный остеомиелит). Описанные изменения в кости проявляются в разные сроки развития воспаления: периостит развивается через 1,5- 3 нед, секвестры - через 1-2 мес. Первые рентгенологические признаки острого остеомиелита появляются с развитием периостальной реакции (в среднем через 2 нед).
Классификация остеомиелита
