
- •"Липолиз. Окисление жирных кислот. Метаболизм кетоновых тел"
- •1.Что следует понимать под катаболизмом липидов и каково его биологическое значение?
- •2.Назовите вещества липидной природы и продукты их обмена, выполняющие энергетическую роль в организме.
- •4.Разберите взаимоотношения основных этапов окисления высших жирных кислот (вжк):
- •5.Что такое карнитин? Объясните его роль в обмене вжк.
- •6.Поясните процесс -окисления. Назовите ферменты и коферменты этого процесса; витамины-предшественники коферментов; клеточная топография этого процесса.
- •7.Какова энергетическая ценность одного цикла -окисления? Чем определяется число циклов -окисления?
- •8.Подсчитайте полный энергетический баланс окисления одной молекулы пальмитиновой и стеариновой вжк.
- •10.В каких тканях организма процесс -окисления вжк - основной источник энергии, а в каких не используются как источники энергии? Каковы основные источники вжк в организме?
- •11.Объясните процесс окисления глицерина. Какова энергетическая ценность этого процесса?
- •12.Что такое кетоновые тела? Объясните биологическую роль кетоновых тел. Опишите, используя метаболические карты, реакции биосинтеза ацетоуксусной кислоты. Как этот процесс связан с -окислением?
- •13.Где и как используются кетоновые тела в норме? Расшифруйте понятия: кетонемия, кетонурия, кетоацидоз. Какие причины вызывают эти состояния? Чем они опасны?
- •14.Покажите пути распада фосфолипидов в тканях. Назовите ферменты и конечные продукты катаболизма фосфолипидов. Что такое лизофосфолипиды? Где и чем опасно их накопление?
- •15.Опишите принцип метода и диагностическое значение определения содержания триглицеридов и фосфолипидов в сыворотке крови
13.Где и как используются кетоновые тела в норме? Расшифруйте понятия: кетонемия, кетонурия, кетоацидоз. Какие причины вызывают эти состояния? Чем они опасны?
Используются кетоновые тела всеми тканями, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников.
При голодании часть жирных кислот в печени превращается в другие «топливные» молекулы - кетоновые тела. Они, в отличие от жирных кислот, могут использоваться нервной тканью как источник энергии. При голодании и длительной физической работе кетоновые тела служат источником энергии для мышц и некоторых других тканей.
При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек. Таким образом глюкоза сохраняется для окисления в мозге и эритроцитах. Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе.
β-Гидроксибутират, попадая в клетки, дегидрируется NAD-зависимой дегидрогеназой и превращается в ацетоацетат. Ацетоацетат активируется, взаимодействуя с сукцинил-КоА - донором КоА: Ацетоацетат + Сукцинил- КоА → Ацетоацетил-КоА + Сукцинат. Реакцию катализирует сукцинил-КоА-ацетоацетат-КоА-трансфераза. Этот фермент не синтезируется в печени, поэтому печень не использует кетоновые тела как источники энергии, а производит их «на экспорт».
Кетоновые тела - хорошие топливные молекулы; окисление одной молекулы β-гидроксибутирата до СО2 и Н2О обеспечивает синтез 27 молекул АТФ.
В норме концентрация кетоновых тел в крови составляет 1-3 мг/дл (до 0,2 мМ/л), но при голодании значительно увеличивается. Увеличение концентрации кетоновых тел в крови называют кетонемией,
выделение кетоновых тел с мочой - кетонурией. Причиной присутствия кетоновых тел в моче является диабет 1 типа. Другие причины включают голодание, чрезмерную физическую нагрузку, алкоголизм и крайне низкое потребление углеводов. Достаточно высокая концентрация кетоновых тел в моче означает, что организм для получения энергии использует жиры, а не глюкозу.
Накопление кетоновых тел в организме приводит к кетоацидозу: уменьшению щелочного резерва (компенсированному ацидозу), а в тяжёлых случаях - к сдвигу рН (некомпенсированному ацидозу), так как кетоновые тела (кроме ацетона) являются водорастворимыми органическими кислотами (рК~3,5), способными к диссоциации:
СН3-СО-СН2-СООН ↔ СН3-СО-СН2-СОО- + Н+.
Ацидоз достигает опасных величин при сахарном диабете, так как концентрация кетоновых тел при этом заболевании может доходить до 400- 500 мг/дл. Тяжёлая форма ацидоза - одна из основных причин смерти при сахарном диабете. Накопление протонов в крови нарушает связывание кислорода гемоглобином, влияет на ионизацию функциональных групп белков, нарушая их конформацию и функцию.
14.Покажите пути распада фосфолипидов в тканях. Назовите ферменты и конечные продукты катаболизма фосфолипидов. Что такое лизофосфолипиды? Где и чем опасно их накопление?
Опишите биологическую роль арахидоновой кислоты, образующейся при гидролизе мембран фосфолипидов.
Известно, что молекулы белков расщепляются в тканях полностью. Поэтому для молекулы белков можно определить время обновления. Фосфолипиды также активно распадаются в тканях, но для каждой части молекулы время обновления различно. Например, время обновления фосфатной группы отличается от времени обновления 1-ацильной группы, и обусловлено это наличием ферментов, вызывающих частичный гидролиз фосфолипидов, вслед за которым снова может происходить их синтез (рис.)
К сожалению, в настоящее время нет достаточно полных данных о фосфолипазном спектре той или иной ткани. Хорошо известно, что фосфолипаза A1атакует эфирную связь фосфолипидов в положении 1. Фосфолипаза А2 катализирует гидролиз эфирной связи в положении 2 глицерофосфолипидов, в результате чего образуются свободная жирная кислота и лизофосфолипид (в случае фосфатидилхолина – лизолецитин), который реацилируется ацил-КоА при участии ацилтрансферазы.
Фосфолипаза С атакует эфирную связь в положении 3, что заканчивается образованием 1,2-диглицерида и фосфорильного основания.
Фосфолипаза D катализирует отщепление от фосфолипида азотистого основания. Долгое время считалось, что фосфолипаза D содержится только в растительных тканях. В последнее время ее удалось обнаружить в растворимой фракции мозга крысы, а затем в микросомах мозга и других органов, а в самое последнее время-в митохондриях печени крысы.
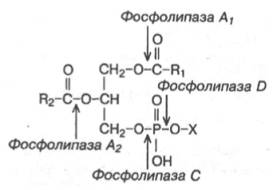
Нет ясности в отношении фосфолипазы В. Возможно, что это-смесь ферментов, обладающих свойствами фосфолипаз А1и А2. Не исключено, что фосфолипаза В-фермент, действующий только на лизофосфолипид (например, лизолецитин), т.е. это лизофосфолипаза.
Лизофосфолипиды – продукт гидролиза фосфолипидов фосфолипазой А2, образуются при определенных стимулах, вызывающих в клетке синтез эйкозаноидов (простагландинов, лейкотриенов).
Могут накапливаться в тканях при некоторых патологич. состояниях, например, при ишемии сердечной мышцы, а также в макрофагах, обработанных разл. адъювантами (веществами, неспецифически усиливающими иммунный ответ на антиген). Обладая высокой биологической активностью, лизофосфолипиды вызывают гемолиз (разрушение) эритроцитов, оказывают литическое (разрушающее) действие на клеточные мембраны, активируют макрофаги и усиливают образование антител на р-римые белки и некоторые др. антигены.
Метаболиты арахидоновой кислоты играют существенную роль во многих биологических процессах. Арахидоновая кислота входит в состав фосфолипидов мембран всех клеток. Ее высвобождение в результате гидролиза мембранных фосфолипидов происходит при активации фермента фосфолипазы А2, который находится в мембранах клеток (прежде всего соеденительной ткани и лейкоцитах). Активация фосфолипазы А2 – универсальная реакция клеток соединительной ткани (тучные клетки, фибробласты, макрофаги, эндотелиоциты и др.) и лейкоцитов на повреждение. Ключевую роль в этом процессе играет увеличение внутриклеточной концентрации Са+², что возникает при дефиците О2, изменении мембранного потенциала клетки, повреждении мембраны клетки, связывании с поверхностными рецепторами клетки медиаторов воспаления. Арахидоновая кислота после отщепления от мембранных фосфолипидов становится доступной для двух других ферментов, находящихся в наружной мембране клеток: 5-липооксигеназы (5-ЛОГ) и циклооксигеназы (ЦОГ). Эти ферменты превращают арахидоновую кислоту в медиаторы воспаления: лейкотриены (ЛТ) и простагландины (ПГ). Из арахидоновой кислоты под влиянием 5-ЛОГ образуется ЛТ А4, который является нестабильным промежуточным продуктом и быстро превращается в ЛТ В4 и С4. ЛТ С4 транспортируется во внеклеточное пространство, где из него образуются ЛТ Е4 и D4. Цистеиниллейкотриены (С4, D4 и Е4) вызывают сокращение бронхов, повышают проницаемость капилляров, стимулируют секрецию слизи и вызывают миграцию эозинофилов в дыхательные пути, в то время как ЛТ В4 усиливает хемотаксис в легкие.
