
Фармакология (Пособие для резидентуры)
.pdf
ОБЩАЯ ФАРМАКОЛОГИЯ
|
|
продолжение табл. 3.2. |
|
|
|
|
1 |
2 |
|
|
|
3. |
Обратный захват (reuptake) нейроме- |
имипрамин блокирует обратный захват |
|
диаторов пресинаптической мембра- |
норэпинефрина и серотонина |
|
ной |
|
|
|
|
3. |
Активность ферментов, разрушающих |
физостигмин снижает активность ацетилхо- |
|
нейромедиаторы в синаптической |
линэстеразы, разрушающей в синаптической |
|
щели |
Ц |
|
щели ацетилхолин |
|
5. |
Возбуждение или блокада синаптиче- |
наркотические анальгетики, возбуждая постси- |
|
ских рецепторов |
наптические опиоидные рецепторы, имитируют |
|
|
эффект энкефалинов; |
|
|
стрихнин, блокируя глициновые рецепторы, |
|
|
препятствует реализации тормозного влияния |
|
|
эндогенного глицина |
Взаимодействие с постсинаптическими рецепторами (в случае стимуляции) вызывает конформацию рецептора с последующей постсинаптической передачей сигнала и наступлением эффекта.
Пресинаптические рецепторы действуют на функции органов и систем опосредованно путем:
гомотропной или аутотропной регуляции высвобождения медиаторов – действие выделяющего медиатора на пресинаптические рецепторы того же нервного окончания;
гетеротропной регуляции высвобождения медиаторов – пресинаптическая регуляция за счет другого медиатора.
Взаимодействие с пресинаптическим медиатором может приводить к стимуляции высвобождения медиатора по принципу положительной обратной связи или угнетению высвобождения медиатора по принципу отрицательной обратной связи (табл. 3.3.).
Таблица 3.3. Примеры пресинаптической регуляции высвобождения медиаторов /3/.
Пресинаптические рецепторы по сравнению с постсинаптическими являются более чувствительными и возбуждаются при низких концентрациях лигандов. Это сказывается и на проявлении фармакологического эффекта. Так, галоперидол в пресинаптической дозе 0,0046 мг/кг оказывает стимулирующее действие на двигательную активность, а в постсинаптической дозе 1-2 мг/кг – угнетающее.
ффект |
|
|
Пресинаптические рецепторы |
|
|
|
|
|
|
М2-холинорецепторы |
|
|
|
α2-адренорецепторы |
|
|
|
Н2-гистаминовые рецепторы |
|
По принципу отрицательной |
D2-дофаминовые рецепторы |
||
обратной связи |
5-НТ1 серотониновые рецепторы |
||
|
|
Р1 пуриновые рецепторы |
|
|
|
-опиоидные рецепторы |
|
|
|
Простагландиновые рецепторы |
|
|
Э |
|
|
По принципу положительной |
β2-адренорецепторы |
||
обратной связи |
АТ1 рецепторы ангиотензина II |
||
Г |
|
|
|
Аффинитет – сродство вещества к рецептору, приводящее к образованию с ним комплекса «вещество – рецептор».
Внутренняя активность – способность вещества при взаимодействии с рецептором стимулиро-
42

ФАРМАКОДИНАМИКА |
3 |
|
|
вать его и вызывать тот или иной эффект.
Аллостерическое (от греч. «allos» – иной, другой, «stereos» – пространственный) взаимодействие – не вызывает «сигнала», при этом лекарственные средства не оказывают прямое действие на медиаторную передачу, а происходит модуляция эффекта медиатора (усиление или ослабление).
Агонист – вещество, которое при взаимодействии со специфическими рецепторами вызывает в них изменения, приводящие к биологическому эффекту (они и обладают внутренней активностью). Стимулирующее действие агониста на рецепторы может приводить к активации или угнетению функции клетки.
Полный агонист вызывает максимальный эффект, взаимодействуяЦс рецепторами.
Частичный агонист не вызывает максимальный эффект при взаимодействии с теми же рецепторами.
Антагонист – вещество, связывающееся с рецепторами, но не вызывающее их стимуляцию. Внутренняя активность у них отсутствует (равна 0). Их фармакологические эффекты обусловлены антагонизмом с эндогенными лигандами (медиаторами, гормонами), а также с экзогенными веществамиагонистами.
Конкурентный антагонист – занимает те же рецепторы, с которыми взаимодействуют агонист.
Неконкурентный антагонист – занимает другие участки макромолекулы, не относящиеся к специфическому рецептору, но взаимосвязанные с ним.
Так в отличие от конкруентногоЭантагониста, который польностью подавляет реакцию рецептора на агонист, неконкруентный антогонист лишь частично устраняет реакцию на агонист.
Нейтральный антагонист, или молчаливый антагонист – имеет нулевую внутреннюю активность,
так как при взаимодействии с рецептором не приводит к развитию физиологического эффекта, а только предотвращает действие эндогенного или экзогенного лиганда /3/.
Негативный антагонист – при взаимодействии с рецептором вызывает «отрицательный» эффект, т.е. эффект противоположный эффекту агониста.
Агонист-антагонист – действует как агонист на один подтип рецепторов и как антагонист на другой.
ИонныеГканалы, в зависимости от проходящих через них ионы, подразделяют на натриевые, калиевые, кальциевые, хлорные, водородные (протонные). Ряд лекарственных средств оказывает эффекты, прямо действуя на ионные каналы. "Управление ионными каналами" означает их открытие или закрытие под определенными воздействиями. Наиболее широко изученными и применяемыми в клинической практике являются блокаторы Na+, Ca2+ и K+ каналов (табл. 3.4).
Таблица 3.4. Средства, влияющие на ионные каналы.
Блокаторы
Противоаритмические средства (амиодарон)
Противодиабетические средства (глибенкламид)
Противосудорожные средства (ретигабин)
Местные анестетики (прокаин)
Противоаритмические средства (хинидин)
Противоэпилептические средства (фенитоин)
Антиангинальные средства Противоаритмические средства Антигипертензивные средства (верапамил)
Антипсихотические средства (флуспирилен)

ОБЩАЯ ФАРМАКОЛОГИЯ
При формировании электрических потенциалов выделяют основные 4 вида ионных каналов:
неуправляемые – постоянно пропускают через себя ионы К+;
потенциал-управляемые – открываются при деполяризации и начинают в этих условиях пропускать через себя
вклетку ионы Na+ (в постсинаптических окончаниях и нервных отростках) или же ионы Са2+ (в пресинаптических окончаниях или рецепторных клетках);
хемо-управляемые – открываются под действием медиатора и начинают пропускать через себя в клетку ионы Na+, что вызывает деполяризацию в виде возбуждающего постсинаптического потенциала;
стимул-управляемые – находятся в сенсорных рецепторах (рецепторных клетках или рецепторных нервных окончаниях) и открываются под действием стимула (раздражителяЦ), начиная пропускать через себя ионы Na+, что вызывает деполяризацию в виде рецепторного потенциала /3, 8/.Э
мутантногоГгена и внедрении его копий.
Созданные нуклеиновые кислоты должны достичь клетки-мишени, т.е. из экстрацеллюлярных пространств попасть в плазму, пройти через клеточные мембраны, проникнуть в ядро и инкорпорироваться в хромосомы. В качестве транспортеров (векторов) предложено использовать некоторые ви-
русы, лишенные способности к репликации, комплексы ДНК с липосомами, белками, плазмидные ДНК и др.
Для лечения онкологических заболеваний исследуются возможности:
блокирования экспрессии онкогенных белков;
активации генов, способных подавлять рост опухолей;
стимуляции образования в опухолях специальных ферментов, превращающих пролекарства в токсичные только для опухолевых клеток соединения;
повышения устойчивости клеток костного мозга к угнетающему действию антибластомных средств;
повышения иммунитета против раковых клеток и т.д.
Для блокирования экспрессии определенных генов, используют специальную технологию антисмысловых (антисенсовых) олигонуклеотидов. Создаются короткие цепочки нуклеотидов (из 15–25 оснований), которые комплементарны той зоне нуклеиновых кислот, где находится ген-мишень. В результате взаимодействия с антисмысловым олигонуклеотидом экспрессия данного гена подавляется. Витравен первый препарат из группы антисмысловых нуклеотидов, применяемый местно при ретините, вызванном цитомегаловирусной инфекцией.
44

ФАРМАКОДИНАМИКА 3
3.3. ЗАВИСИМОСТЬ ФАРМАКОТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА
|
|
ОТ СВОЙСТВ ЛЕКАРСТВЕННЫХ СРЕДСТВ И УСЛОВИЙ ИХ |
|
|||
|
|
ПРИМЕНЕНИЯ |
|
|
|
|
|
|
|
|
|
||
|
3.3.1. Химическое строение, физико-химические и физические свойства |
|
||||
|
|
лекарственных средств |
|
|
|
|
|
|
|
ЭЦ |
- |
|
|
|
мишень |
и |
|
|||
|
для |
- |
|
|||
|
лициловой |
- |
|
|||
|
тимое |
- |
|
|||
|
ного |
|
|
|||
|
|
|
двух |
|
||
|
разноименных |
связи |
|
|||
|
возникают |
остатками |
|
|||
|
сильных |
|
|
|||
|
|
|
стероидных |
|
||
|
гормонов |
через |
|
|||
|
цитоплазматическую |
|
|
|||
|
|
|
наиболее |
|
||
|
часто |
мишенями |
|
|||
( табл |
|
|
||||
|
|
|
|
|
||
|
|
Таблица 3.5. Типы взаимодействия веществ с рецепторами /3/. |
|
|
||
|
|
|
|
|
||
|
|
Типы взаимодействия |
Приблизительная прочность связи, кДж/моль |
|
||
|
|
|
|
|
|
|
|
|
Ковалентные |
|
210–420 |
|
|
|
|
|
|
|
|
|
|
|
Электростатические (ионные) |
21 |
|
|
|
|
|
|
|
|
|
|
|
|
Ион-дипольные |
|
8–21 |
|
|
|
|
|
|
|
|
|
|
|
Диполь-дипольные |
|
4–12 |
|
|
|
|
|
|
|
|
|
|
|
Водородные связи |
|
8–21 |
|
|
|
|
|
|
|
|
|
|
|
Ван-дер-ваальсовы (дисперсионные) |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
Гидрофобные |
|
3* |
|
|
|
|
|
|
|
|
|
|
|
Примечание: *на одну CH2-группу |
|
|
|
|
РазличияГв активности стереоизомеров влияют на комплементарность – пространственное соответствие вещества с рецептором. Белки-переносчики лучше переносят через мембраны левовращающиеся (L-изомеры) большие водорастворимые молекулы, чем правовращающиеся (D-изомеры) (табл. 3.6).
45

ОБЩАЯ ФАРМАКОЛОГИЯ
Таблица 3.6. Сравнение активности изомеров.
Активный изомер |
Слабый изомер |
|
|
L (–)-эпинефрин |
D (+)-эпинефрин |
|
|
L-кодеин |
D-кодеин |
|
|
L-тироксин |
D-тироксин |
|
|
L-пропранолол |
Ц |
D-пропранолол |
Цис-изомер карбидина при блокаде постсинаптических D2-дофаминовых рецепторов проявляет свойства типичных нейролептиков, для транс-карбидина, в основном блокирующего пресинаптические D3 дофаминовые рецепторы, характерны свойства атипичных нейролептиков.
Гидрофильные соединения плохо проникают через тканевые барьеры, для липофильных характерна высокая степень прохождения практически всех биологических барьеров.
Проявление эффекта лекарственных средств зависит и от степени ионизации, так, курареподобные средства, являющиеся четвертичными аминами, оказывают менее слабое действие по сравнению с третичными соединениями,Эслабо подвергающимися ионизации.
Степень измельченности порошкообразных веществ и степень летучести жидких летучих лекарственных средств для ингаляций обуславливает их локальное или системное действие /3, 8/.
3.3.2. Дозы и концентрации
Доза (греч. «dosis» – прием, порция) – это количество лекарственного средства, вводимого в организм. Действие лекарственных средств в большой степени определяется их дозой. В зависимости от дозы (концентрацииГ) меняются:
скорость развития эффекта;
выраженность эффекта;
продолжительность действия;
характер действия.
Повышение дозы (концентрации):
уменьшает латентный период;
повышает эффективность; увеличивает длительность эффекта.
Дозы выражаются в:
весовых единицах (< 0,001, 0,01, 0,1, 1,0, 10,0 < г)
объемных единицах (< 0,1, 1, 10 < мл) биологических единицах (УЕ, ЕД, МЕ).
По времени действия:
разовая доза (dosis pro dosi) – количество вещества на один прием;
суточная доза (dosis pro die) – рассчитывается для приема в течение 1 суток;
курсовая доза (dosis pro cursus) – доза препарата на курс лечения. Применяется при назначении лекарственных средств, способных при длительном лечении вызывать токсические явления (например, противомикробные химиотерапевтические средства); начальная доза – первичная доза лечения;
эффективная доза (ЕD50) – доза вещества, которая обеспечивает требуемый результат у половины (50%) испытуемых.
46
|
|
|
|
|
ФАРМАКОДИНАМИКА |
3 |
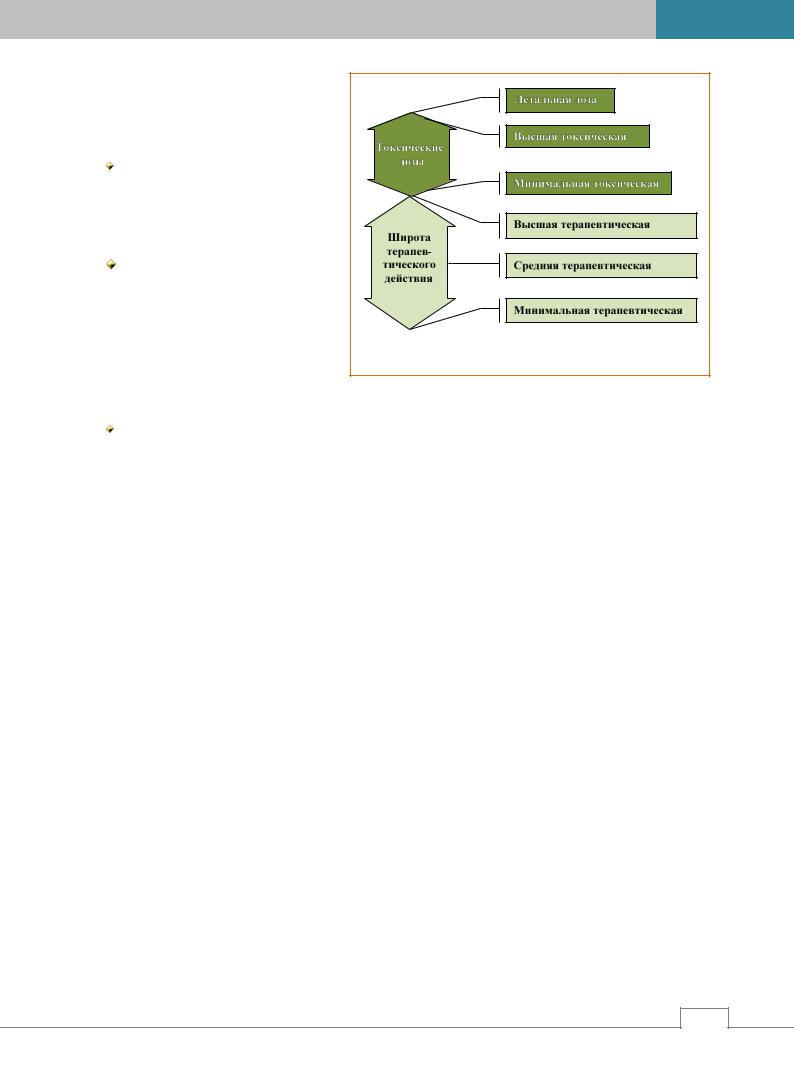
По силе действия дозы делятся на ле- |
|
|
||||
чебные и токсические (рис. 3.7). |
|
|
|
|||
Лечебные дозы делятся на мини- |
|
|
||||
мальные, средние и высшие /1, 3/: |
|
|
|
|||
минимальная |
действующая |
доза, |
|
|
||
пороговая, пограничная – доза, в |
|
|
||||
которой |
лекарственные средства |
|
|
|||
вызывают |
начальный биологиче- |
|
|
|||
ский эффект; |
|
|
|
|
|
|
средняя терапевтическая доза – доза, |
|
|
||||
превышающая |
минимально |
дей- |
|
|
||
ствующую дозу, обычно составля- |
|
|
||||
ет 1/2-1/3 от высшей разовой дозы |
|
|
||||
и не вызывает патологических от- |
Рис. 3.7. Виды доз. |
|
||||
клонений. В этой дозе лекарствен- |
|
|
||||
ные средства оказывают необходимое фармакотерапевтическое действие у преобладающего |
||||||
большинства больных. |
|
|
|
|
||
высшая терапевтическая доза (всегда ниже минимальной токсической дозы) – однократно вве- |
||||||
денное без вреда для больного максимальное количество лекарственного средства. Применя- |
||||||
ется при недостаточной выраженности эффекта после применения средней терапевтической |
||||||
дозы (как правило, при неотложной терапии). |
|
|
||||
Токсическая доза (dosis toxica) – доза, вызывающая опасные для организма токсические эффекты, |
||||||
проявляющиеся нарушением физиологических функций организма. |
|
|||||
Смертельная, или летальная доза (dosis letalis) – минимальная доза лекарственного средства, вызы- |
||||||
вающая летальный исход. Выражается как LD50, т.е. доза, вызывающая гибель 50% испытуемых жи- |
||||||
вотных. |
|
|
|
|
|
|
Ударная доза – первая доза, превышающая последующие дозы. Применяется при необходимости |
||||||
быстрого создания высокой концентрации лекарственногоЦвещества в организме. |
|
|||||
Поддерживающая доза – количество лекарственного средства, необходимое для поддержания како- |
||||||
го-либо терапевтического эффекта. |
|
|
|
|||
Дробная доза – применение одноразовой дозы в несколько приемов. |
|
|||||
В лечебной практике используются дозы, находящиеся в диапазоне терапевтической широты. |
||||||
Терапевтическая широта, широта терапевтического действия – диапазон доз от минимальной тера- |
||||||
певтической до минимальной токсической дозы. |
|
|
||||
Терапевтический индекс – отношение летальной дозы к эффективной дозе (LD50/ED50). Чем больше |
||||||
терапевтический индекс и терапевтическая широта, тем безопаснее лекарственное средство. |
|
|||||
|
|
|
Э |
|
|
|
Для более точной дозировки препаратов рассчитывают их количество на 1 кг массы тела (напри- |
||||||
мер, мг/кг, мкг/кг). В отдельных случаях предпочитают дозировать вещества, исходя из величины по- |
||||||
верхности тела (на 1 м2). |
|
|
|
|
||
Зависимость действия лекарственных средств от дозы может быть не только количественной, но и |
||||||
качественной. Ацетилхолин в малых дозах возбуждает М-холинорецепторы, в 10 раз больших дозах – |
||||||
также Н-холинорецепторы. Натрия оксибутират в малых дозах оказывает обезболивающее и седа- |
||||||
тивноеГ, в средних дозах – противосудорожное и снотворное, в больших дозах – наркозное действие /3, |
||||||
8/.
47

ОБЩАЯ ФАРМАКОЛОГИЯ
3.3.3. Повторное применение лекарственных средств
Повторное применение может приводить к изменению действия лекарственных средств. Повышение эффекта лекарственных средств может связано с сенсибилизацией и кумуляцией.
Сенсибилизация – повышение чувствительности организма к лекарственному средству. В результате могут развиться неспецифические и токсические эффекты лекарства, что требует медленной или резкой отмены приема лекарственного средства. Так, на фоне длительного приема психостимуляторов возникают психозы, так как каждый последующийЦприем препарата вызывает большее повышение концентрация дофамина в мозге и более выраженные изменения поведения.
Кумуляция – увеличение эффекта ряда веществ, связаное с их способностью к накоплению и развитию токсических эффектов. В связи с этим дозировать такие препараты нужно с учетом кумуляции, постепенно уменьшая дозу или увеличивая интервалы между приемами препарата.
Различают материальную и функциональную кумуляции:
материальная кумуляция – накопление в организме фармакологического вещества. Этот вид кумуляции характерен для высоколипофильных веществ, которые имеют низкую скорость элиминации. Кумуляция может привести к интоксикации. Например, повторное применение сердечныхЭгликозидов приводит к их накоплению и к нарушениям сердечного ритма.
функциональная кумуляция – «накапливается» эффект, а не вещество. Например, антиагрегант тиклопидин быстро инактивируется в воротной вене, но при этом он успевает необратимо изменить мембрану эритроцитов, которые находятся в крови этой вены. При повторных введениях тиклопидина его эффекты суммируются, т.е. все большее и большее число эритроцитов подвергается необратимой модификации и реологические свойства крови улучшаются. Другой пример – при алкоголизме нарастающие изменения функции ЦНС
Гмогут приводить к развитию белой горячки. В данном случае спирт этиловый быстро окисляется и не задерживается в тканях. Суммируются лишь его нейротропные эффекты. Функциональная кумуляция происходит также при применении ингибиторов МАО.
Снижение эффекта лекарственного средства при повторном приеме может быть связано с развитием толерантности.
Толерантность (привыкание) – снижение эффективности веществ при их повторном применении. В случае привыкания для получения исходного эффекта дозу препарата необходимо повышать или одно вещество заменять другим.
Индивидуальная (врожденная) толерантность – развитие толерантности к впервые принимаемому лекарственному средству при первом приеме. Причиной может являться снижение количества рецепторов в клетках, энзимопатии и др.
Видовая толерантность характерна для одного вида живых существ. Например, кролики легко переносят смертельные для человека дозы атропина, так как у них имеется атропиназа, разрушающая атропин.
Возрастная толерантность – отсутствие развития эффекта лекарственного средства у определенной возрастной категории. Например, у маленьких детей с бронхиальной астмой β-адреномиметики малоэффективны из-за недоразвития β-адренорецепторов. У стариков лекарственные средства, действующие на сердечно-сосудистую систему, вызывают чрезмерные эффекты из-за замедления компенсаторных рефлексов с барорецепторов /3/.
В зависимости от механизма возникновения выделяют 2 вида толерантности:
фармакокинетическая (биохимическая, метаболическая);фармакодинамическая (клеточная).
48
|
|
|
ФАРМАКОДИНАМИКА |
3 |
Фармакокинетическая толерантность возникает при индуцировании фермента, разрушающего |
||||
лекарственное средство. В результате ускоренного метаболизма концентрация лекарства в крови по- |
||||
нижается, эффект ослабляется. Возможна аутоиндукция, например, барбитураты индуцируют мик- |
||||
росомальные ферменты печени, что ускоряет их элиминацию. |
|
|||
Фармакодинамическая толерантность развивается вследствие адаптационных изменений |
||||
клеточных или рецепторных структур. Уменьшения концентрации лекарства в крови не наблюдается, |
||||
в результате реакция на данное вещество ослабевает при неизмененной концентрации. В основе |
||||
фармакодинамической толерантности лежат несколько механизмов: |
|
|||
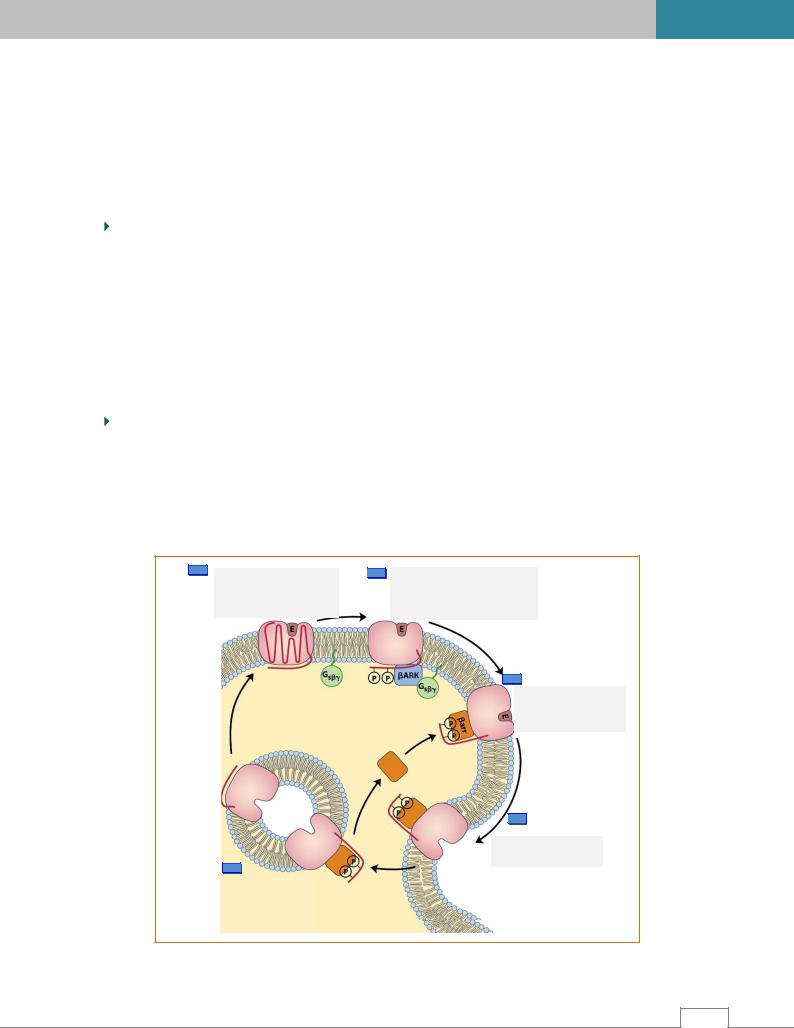
Десенситизация – снижение чувствительности рецептора путем изменений рецептора. |
||||
Например, β-адреномиметики приводят к фосфорилированию β-адренорецепторов. |
|
|||
гетерологическая десенситизация – активность β-адренергических рецепторов ингибируется |
||||
путем фосфорилирования протеинкиназой А карбоксильной концевой области |
||||
рецепторов. Фосфорилированный рецептор нормально связывает лиганд, но не активирует |
||||
GS-белок. |
|
|
|
|
гомологичная десенситизация осуществляется рецептор-специфическими ферментами. |
||||
Например, β-адренергическая рецепторная киназа – βARK (β-adrenergic receptor kinase) фос- |
||||
форилирует только β-адренергические рецепторы. С фосфорилированным рецептором |
||||
связывается β-аррестин и блокирует его взаимодействие с G-белком (рис. 3.8). |
|
|||
Down-регуляция – снижение числа рецепторов к лекарственному средству. Как правило, коли- |
||||
чество рецепторов уменьшается при длительной экспозиции высокой концентрации сигнальных мо- |
||||
лекул. Рецепторы исчезают из-за интернализации: нарушения транскрипции генов, деградации |
||||
мРНК, протеолиза и секвестрации в клетке. Это наблюдается при применении агон истов к лиган- |
||||
дам рецепторов. Например, наркотические анальгетики снижают количество опиоидных рецепторов. |
||||
Однако использование определенных антагонистов рецепторов может также повредить рецепторы |
||||
(интернализация рецепторов из-за антагонизма) /3/. |
|
|
||
1 |
Связывание эпинефрина с |
2 GSβγ притягивает βARK к мембране, |
|
|
|
|
|||
|
β-адренергическим рецептором |
где она фосфорилирует остатки |
|
|
|
инициирует диссоциацию GSβγ c |
серина на карбоксильном конце |
|
|
|
GSα (не показано). |
|
рецептора. |
|
|
Э |
Ц |
|
|
|
3 |
|
||
|
β-Аррестин (βarr) |
|
||
|
связывается с |
|
||
|
фосфорилированным |
|
||
|
С-концевым доменом |
|
||
|
рецептора. |
|
||
|
|
|
||
|
|
|
4 |
|
|
|
|
Комплекс рецептор- |
|
|
|
|
аррестин входит в клетку |
|
|
|
|
путем эндоцитоза. |
|
|
5 |
|
|
|
|
Включенный в везикулу |
|
|
|
|
аррестин диссоциирует, |
|
|
|
|
рецептор дефосфори- |
|
|
|
|
лируется и возвращается |
|
|
|
|
на клеточную |
|
|
|
|
поверхность. |
|
|
|
Г |
|
|
|
|
|
Рис. 3.8. Десенситизация рецептора β-аррестином /8/. |
|
||
49
ОБЩАЯ ФАРМАКОЛОГИЯ
Интернализация – погружение молекул внутрь клетки. Считается одним из механизмов десенситизации клетки. После связывания лиганда многие рецепторы путем эндоцитоза убираются внутрь клетки в эндосомы. Вначале на поверхности мембраны происходит образование окаймленных ямок, которые впячиваются внутрь клетки и превращаются в окаймленные пузырьки. Потеряв окаймляющий чехол, эти пузырьки сливаются с другими, образуя промежуточные пузырьки с гладкой поверхностью, называемыми эндосомами, которые в свою очередь сливаются с лизосомами. Однако к настоящему времени получены результаты того, что интернализованный рецептор сохраняет свою связь с лигандом вплоть до попадания в лизосомы.
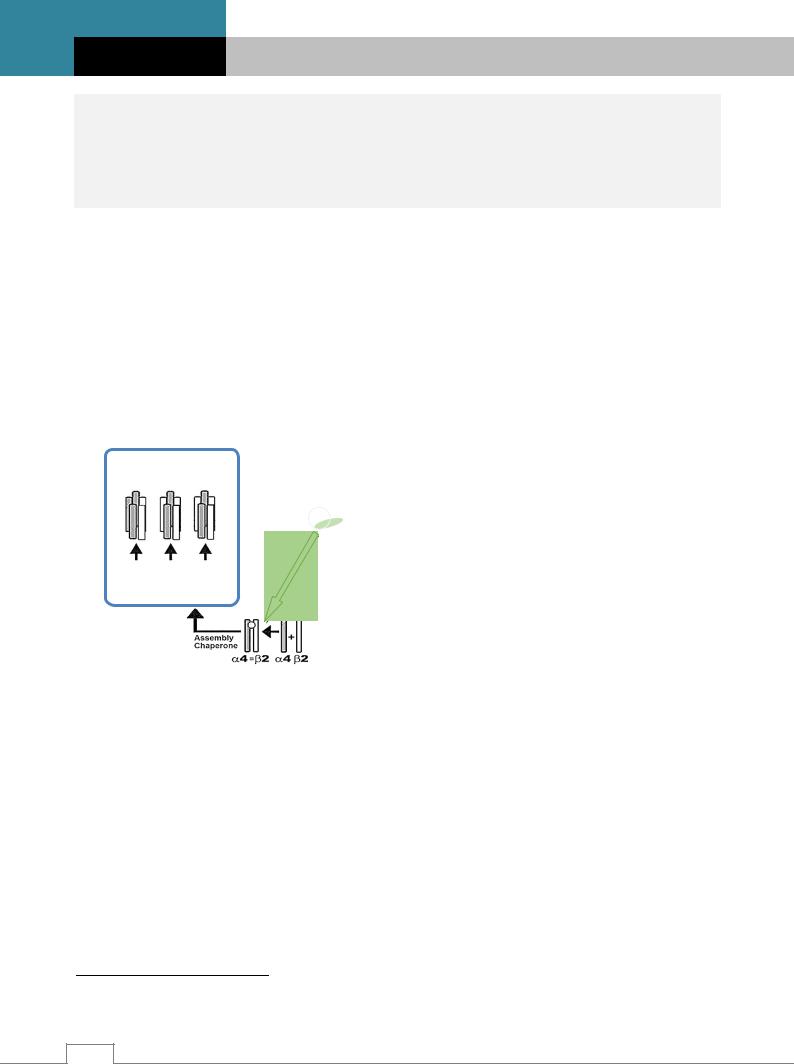
 Up-регуляция – увеличение числа рецепторов за счет синтеза новых рецепторов и их встраивания в мембрану. Считается, что количество рецепторов увеличивается при длительной экспозиции низкой концентрации сигнальных молекул. В основном наблюдается при применении антагонистов к лигандам рецепторов. Например, β-адреноблокаторы компенсаторно увеличивают число β-адренорецепторов за счет синтеза новых молекул. Однако, как показали исследования агонисты также могут стимулировать синтез нового поколения рецепторов. Например, up-регуляция 5-НТ3 рецепторов запускается длительным действием как антагониста 5-НТ3 рецепторов бемесетроном, так и агонистами – серотонином, М-хлорфенилбигуанидом (аллостерический агонист и модулятор 5-НТ3 рецепторов). Хроническое употребление никотина также вызывает up-регуляцию никотиновых ацетилхолиновых рецепторов. Никотин действует в качестве шаперона5 для соединения
Up-регуляция – увеличение числа рецепторов за счет синтеза новых рецепторов и их встраивания в мембрану. Считается, что количество рецепторов увеличивается при длительной экспозиции низкой концентрации сигнальных молекул. В основном наблюдается при применении антагонистов к лигандам рецепторов. Например, β-адреноблокаторы компенсаторно увеличивают число β-адренорецепторов за счет синтеза новых молекул. Однако, как показали исследования агонисты также могут стимулировать синтез нового поколения рецепторов. Например, up-регуляция 5-НТ3 рецепторов запускается длительным действием как антагониста 5-НТ3 рецепторов бемесетроном, так и агонистами – серотонином, М-хлорфенилбигуанидом (аллостерический агонист и модулятор 5-НТ3 рецепторов). Хроническое употребление никотина также вызывает up-регуляцию никотиновых ацетилхолиновых рецепторов. Никотин действует в качестве шаперона5 для соединения
α и β субъединиц никотинового рецептора и субклеточного транспорта (рис. 3.9). |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Э |
|
|
|
|
|
nAChR α4β2 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Никотин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3.9. Действие никотина на up-регуляцию |
|
|
|
|
|
|
|
|
|
|
никотиновых рецепторов /8/. |
|
|
|
|
Up-регуляция |
|
|
|
|
Ц |
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||||
|
|
Г |
|
|||||||
|
|
|
|
сборка |
|
|
|
|||
|
|
|
|
шаперона |
|
α4β2 α4 + β2 |
|
|||
 Уменьшение выделения нейромедиаторов – агонисты рецепторов тормозят выделение нейромедиаторов по принципу отрицательной обратной связи. Например, наркотические анальгетики нарушают освобождение эндогенных обезболивающих пептидов – энкефалинов, β-эндорфина и динорфина.
Уменьшение выделения нейромедиаторов – агонисты рецепторов тормозят выделение нейромедиаторов по принципу отрицательной обратной связи. Например, наркотические анальгетики нарушают освобождение эндогенных обезболивающих пептидов – энкефалинов, β-эндорфина и динорфина.
 Включение компенсаторных механизмов регуляции. Например, при первом введении гипотензивного средства нифедипина у пациента может развиться ортостатический коллапс (резкое падение артериального давления). Однако, при последующих введениях барорефлексы адаптируются к способности лекарства расширять сосуды и не допускают падения артериального давления ниже уровня, необходимого для кровоснабжения мозга.
Включение компенсаторных механизмов регуляции. Например, при первом введении гипотензивного средства нифедипина у пациента может развиться ортостатический коллапс (резкое падение артериального давления). Однако, при последующих введениях барорефлексы адаптируются к способности лекарства расширять сосуды и не допускают падения артериального давления ниже уровня, необходимого для кровоснабжения мозга.
Вследствие изменений в рецепторах толерантность может развиваться избирательно к опреде-
ленным эффектам. Например, толерантность к терапевтическому эффекту приводит к токсическим эффектам (терапевтический индекс уменьшается). И наоборот, толерантность к побочным эффектам приведет к ослаблению или исчезновению неблагоприятного действия.
5 Шаперон – белок, восстанавливающий правильную нативной третичную или четвертичную структуры белка, а также участвующий в образовании и диссоциации белковых комплексов.
50

ФАРМАКОДИНАМИКА |
3 |
|
|
К некоторым лекарственным средствам развиваются оба вида толерантности. Например, фе-
нобарбитал вызывает индукцию микросомальных ферментов печени, в результате чего ускоряется его
собственный метаболизм и элиминация, а также изменяется плотность и количество рецепторов.
Перекрестная толерантность – возникает к веществам, похожим на длительно принимаемый пре-
парат по строению и механизму действия. Например, у героиновых наркоманов развивается пере-
крестная толерантность ко всем опиоидам, и при детоксикации можно использовать любой стимуля-
тор опиатных рецепторов.
никающее привыкание, иногда после первого введения вещества. При повторном введении лекар-
ственного средства часто не все рецепторы освобождаются от предыдущей дозы или происходит ис-
тощение количества медиатора, поэтому повторный эффект бывает слабее первого. Например, при повторном применении с интервалом 10–20 мин эффект эфедрина оказывается намного слабее, чем при первой инъекции.
Тахифилаксия (от греч. «tachys» – быстрый, «phylaxis»Ц– бдительность, охрана) – очень быстро воз-
Лекарственная зависимость – непреодолимое стремление к приему вещества с целью повыше-
ния настроения, улучшения самочувствия, устранения неприятных переживаний и ощущений, в том числе возникающих при отмене веществ, вызывающих лекарственную зависимость. Различают пси-
хическую и физическую лекарственную зависимость:
психическая лекарственнаяЭзависимость – развитие эмоционального дистресса при прекраще-
нии приема лекарства. Зависимый ощущает себя опустошенным, погружается в депрессию,
испытывает чувство страха, тревоги, его поведение становится агрессивным;
физическая лекарственная зависимость – более выраженная степень зависимости, которая тре-
бует постоянного присутствия в нем лекарства для поддержания состояния физиологического равновесия и при которой в ответ на отмену психоактивного вещества развивается абстинент-
ный синдром /3/.
Эффект последействия – изменения функционального состояния организма, продолжающиеся после Гпрекращения действия лекарственного средства. Например, эффекты снотворных, принятых перед сном, продолжаются до полудня следующего дня, пациенты испытывают сонливость, наруша-
ются психомоторные реакции и т.д.
При внезапной отмене лекарственных средств могут развиться с и н др о м «отдачи», синдром абстиненции, синдром «отмены».
Синдром «отдачи», или «феномен рикошета» – обострение патологического процесса и возвращение симптомов болезни при резкой отмене лекарственного средства после длительного приема. Происходит суперкомпенсация функций с обострением болезни. Например, при длительном назначении β-адреноблокаторов для лечения стенокардии происходит новообразование
β-адренорецепторов в миокарде (up-регуляция), после отмены препаратов медиатор норэпинефрин и гормон эпинефрин возбуждают ранее существовавшие и «новые» адренорецепторы. У больных повышается потребность сердца в кислороде, появляются тяжелые приступы стенокардии и даже развивается инфаркт миокарда.
Синдром абстиненции, или явления лишения − психические изменения и серьезные соматические нарушения, связанные с расстройством функций многих систем организма вплоть до смертельного исхода, возникающие при полном прекращении приема психоактивного вещества либо снижении его дозы.
Синдром «отмены» – при длительном применении некоторых лекарственных средств и внезап-
ной их отмене могут возникать реакции угнетения функции органа. Примером может служить гипо-
функция коры надпочечников при длительном применении глюкокортикоидов. Эти препараты, со-
51
