
книги / Теория химических реакторов. Введение в основные разделы курса
.pdf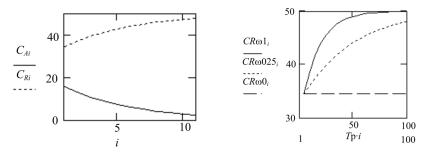
Рис. 43. Изменение концентрации |
Рис. 44. Влияние коэффициента |
сырья и продуктов на выходе |
рециркуляции на релаксационные |
из реактора с рециклом |
зависимости |
Второй предельный случай, при ω = 0 (идентификатор CRω0), соответствует работе реактора «на проход», без рециркуляции части сырья, поэтому концентрация на выходе остается постоянной. При промежуточном значении ω = 0,25 релаксационная кривая располагается между этими двумя предельными случаями.
В качестве полезного упражнения читателю предлагается решить задачу главы 10 при равенстве исходных концентраций реагентов А и В на входе в каскад реакторов (СА0 = СВ0).
11. УЧЕТ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ ПРИ РАСЧЕТЕ РЕАКТОРОВ
Протекание большинства химических реакций сопровождается выделением или поглощением тепла, что существенно влияет на характеристики процесса – его скорость и селективность, а также на аппаратурное оформление и режим проведения процессов.
Наибольшее внимание при этом должно уделяться экзотермическим процессам, при проведении которых температура реакционной массы увеличивается. Поскольку в подавляющем числе случаев при этом увеличивается и скорость суммарного процесса, это вызывает ускорение выделения тепла, и, в случае отсутствия активной или пассивной регулировки температуры в реакторе, она может вырасти до так называемой адиабатической, иногда равной нескольким тысячам °C. В некоторых случаях даже небольшое увеличение температуры нежелательно, поскольку в условиях протекания ряда параллельных реакций, имеющих разные энергии активации, селективность процесса может существенно снижаться за счет большего ускорения реакций с бόльшими значениями Еакт.
11.1. Учет теплоты реакции для реакторов различного типа
В зависимости от температурных режимов работы все реакторы могут быть поделены на три основных типа: изотермические, адиабатические и политропные.
Идеальным типом изотермического реактора является такой, в котором избыточное тепло снимается за счет кипения одного из реагентов при регулируемом давлении в аппаратуре.
122
Адиабатические реакторы в чистом виде практически не существуют, поскольку всегда в той или иной степени происходит теплообмен через стенку аппарата.
Наиболее близки к адиабатическому режиму быстропротекающие процессы – взрывы, горение, высокотемпературный твердофазный синтез и др.
Большинство существующих реакторов относятся к политропному типу, это означает, что температура в реакторе устанавливается на основании баланса выделяемого и отводимого тепла. Поэтому единственным способом расчета теплового режима таких аппаратов является составление уравнений теплового и материального баланса.
Учитывая, что перенос тепла за счет теплопроводности описывается уравнением Фурье, аналогичным уравнению Фика для диффузии, а часть тепла переносится теми же конвекционными потоками, что и вещество, построение уравнения баланса тепла, в принципе, соответствует процедуре, описанной в подразделе 5.1.
Для адиабатического реактора, в зависимости от его гидродинамического типа, можно записать следующие уравнения баланса тепла:
а) Реактор идеального перемешивания в стационарном режиме:
Vсек ρ g CP (tк −tн ) = |
Vсек ρ |
(Cк −Cн )Qp , |
(182) |
|
|||
|
M |
|
|
где ρ – плотность; g – ускорение силы тяжести; СР – теплоемкость при постоянном давлении; М – молекулярная масса реагента; к, н – индексы конечного и начального состояния потока; Qр – тепловой эффект реакции (Qр = –∆Нр). Принимается ρ = const;CP = const.
б) Реактор идеального вытеснения (для элементарного слоя):
V |
ρ g C |
|
dt =W Q |
|
ρ |
F d L, |
(183) |
||
|
|
|
|||||||
сек |
|
P |
|
r |
p M |
|
|||
где F – площадь поперечного сечения потока; L – длина реактора; |
|||||||||
Wr – скорость химической реакции, |
моль |
; t – температура. |
|
||||||
м3 с |
|
||||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
123 |
Эти же уравнения при добавлении членов, описывающих теплообмен через стенку реактора, будут соответствовать политропному реактору.
Реактор идеального перемешивания:
Vсек ρg CP (tк −tн ) = VсекMρ(Cк −Cн )Qр + KF (tк −tx ), (184)
где K – коэффициент теплопередачи через стенку реактора; F – площадь поверхности теплообмена; tх – температура хладоагента.
Реактор идеального вытеснения: |
|
|
||
Vсек ρ g CP dt =Wr QP |
ρ |
F d L + K П(t −tx )d L, |
(185) |
|
M |
||||
|
|
|
||
где П – периметр поперечного сечения потока в реакторе, имеющего поперечную площадьF; t – текущая температура на данном участке dL.
Уравнения (182)–(185) позволяют получить выражение для установившейся конечной температуры или найти ее приращение за время dτ или на длине dL реактора. В любом случае, приращение температуры в системе связано с долей превращенного вещества dC, поэтому температура в реакторе, или в его элементарном объеме, может быть описана уравнением общего вида:
T =Tн ± f (Qр,С, K ), |
(186) |
следовательно, уравнение Аррениуса для константы скорости реакции может быть записано в следующем виде:
k = k |
−E |
акт RT = k |
|
|
− |
e |
0 |
exp |
|||
0 |
|
|
|
|
|
|
|
|
|
|
|
Eакт |
|
|
(187) |
|
. |
||
R(Tн ± f |
|
||
(C )) |
|
||
Оно не содержит в явном виде температуру, поэтому при введении константы скорости реакции, записанной в таком виде, в уравнения реакторов последние допускают интегрирование. К сожалению, чаще всего лишь в численном виде с использованием ЭВМ.
124
11.2. Устойчивость режимов работы реакторов
Существует несколько видов неустойчивости работы реакторов. Уравнения (182)–(185) отражают основное условие устойчивости работы реакторов по критерию постоянства температуры. Нарушение этого условия может произойти либо в случае изменения интенсивности выделения тепла при протекании химической реакции, либо при изменении характера теплообмена. Повышенное тепловыделение приведет к повышению температуры в системе до величины, при которой интенсивность теплоотвода не станет равной новой интенсивности тепловыделения. Таким образом, критерием тепловой устойчивости выступает равенство тепловых мощностей (количества тепла в единицу времени) процесса генерации тепла и его теплоотвода. Для нахождения равновесной температуры необходимо выразить обе эти зависимости через общий параметр – температуру.
Решение уравнения
|
dQ(T ) |
dQ(T ) |
(188) |
|||||
f1 (T ) = f2 |
(T ) |
|
|
= |
|
|
||
d τ |
d τ |
|||||||
|
|
реакц |
|
TO |
|
|||
позволяет найти равновесную температуру.
Найдем математическое выражение для описания тепловой мощности от протекающей реакции. Для объема вещества dV, находящегося в реакционном объеме, количество выделяемого (или поглощаемого) тепла пропорционально тепловому эффекту реакции Qр и количеству г-моль вещества, претерпевших превращение, т.е. dQ = Qр dV dC. С другой стороны, изменение концентрации
определяется кинетикой процесса:
dC |
|
n |
|
n |
|
|
E |
n |
|
|
|
= −kC |
|
d c = −kC |
|
d τ d c = −k0 exp |
− |
|
C |
|
d τ. |
dτ |
|
|
|
|
||||||
|
|
|
|
|
|
RT |
|
|
||
Подставляя это значение в предыдущее равенство, получим:
|
|
|
E |
n |
|
d Q |
|
|
−E |
n |
|
|
||
d Q = −Qp k0 |
dV exp |
− |
|
C |
|
d τ |
|
= −Qp k0 |
dV exp |
|
C |
. |
(189) |
|
|
|
d τ |
|
|||||||||||
|
|
|
RT |
|
|
|
|
RT |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
125 |

Скорость теплоотвода через стенку определяется величиной поверхности теплообмена dF, ограничивающей объем dV, коэффициентом теплопередачи К и перепадом температуры между веществом
в объеме dV и хладоагентом, т.е. |
|
|||||
|
|
|
|
dQ |
= Кd F (T − Tx ). |
(190) |
|
|
|
|
d τ |
||
|
|
|
|
|
|
|
Записывая |
уравнения (189) |
и (190) в виде уравнения |
баланса |
|||
dQ |
|
|
|
|
||
∑ |
|
|
= 0, получаем уравнение с одним неизвестным, которое мо- |
|||
|
||||||
|
d τ i |
|
|
|
|
|
жет бытьрешено любым численным методом (в частности графически):
f |
(T ) = K |
|
d F |
|
(T − T |
) = f |
|
(T ) = Q k |
|
exp |
|
− |
E |
Cn . |
(191) |
|
|
|
2 |
0 |
|
|
|||||||||
1 |
|
|
x |
|
p |
|
|
|
|
|
|||||
|
|
dV |
|
|
|
|
|
|
|
|
RT |
|
|||
Анализ особенностей решения уравнения (191)
Функция f1 равна нулю при Т = Тх. В зависимости от тангенса угла наклона, определяемого произведением параметра теплообмена К
и величиной удельной поверхности теплообмена (d F dV ), прямая
линия, соответствующая f1(Т), будет расположена как f1,1, f1,2 или f1,3. При изменении (повышении) температуры хладоагента до Tx′ эта за-
висимость будет соответствовать прямой f1,2′ на рис. 45.
Решением уравнения (191) является условие равенства f1 и f2, что соответствует точкам Rн и RC.
В случае f1,3(Т) и f1,2′ (T ) решение отсутствует.
Рассмотрим состояние и динамику системы при какой-то промежуточной температуре Tпн . В этом случае для условий f1,1 и f1,2 ско-
рость теплоотвода больше, чем скорость генерации тепла по f2, поэтому система в целом будет постепенно охлаждаться за счет усиленного теплоотвода и, в конечном итоге, переместится в точку устойчивого равновесия Rн, т.е. к температуре Тн2 для, например, f1,2.
126
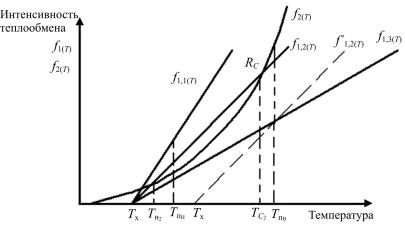
Рис. 45. Графическое решение уравнения (191)
Для условий f1,3 при Tпн скорость генерации тепла ( f2 ) больше,
чем скорость его теплоотвода (f1,3), следовательно, температура системы будет неуклонно повышаться без ограничений, поскольку tg угла наклона кривой f2 везде после Tпн больше, чем tg f1,3. При увели-
чении Тх до Tx′ также возникают условия для неограниченного роста температуры – теплового взрыва.
Таким образом, зона температур Tн2 <Tпн <TC2 является обла-
стью устойчивой работы реактора только для условий теплообмена, соответствующих f1,2.
Рассмотрим состояние и динамику системы при Tпв >TC2 для ус-
ловий f1,2. В этом случае интенсивность генерации тепла ( f2 ) больше, чем интенсивность теплоотвода ( f1 ) . Температура системы будет неуклонно повышаться, т.к. для всех температур выше TС2 tg( f2 ) > tg( f1 ) . Таким образом, критерием устойчивости режима работы реактора является соотношение
127
|
|
|
|
|
tg( f1 ) > tg( f2 ) |
|
|
|
|
|
(192) |
||||||
или, в явном виде: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
tg( f |
) = |
d f1 |
= |
d |
К |
|
d F |
|
(T − T |
) |
= К |
|
d F |
|
T + |
||
|
|
|
|
|
|
|
|
||||||||||
|
1 |
|
dT |
|
|
|
x |
|
|
|
|
||||||
|
|
|
dT |
dV |
|
|
|
dV |
|
||||||||
+ |
d |
(dV ρgCpT ) = К |
d F |
+ dVρgCpT. |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||
dT |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
dV |
|
|
|
|
|
|
|
||||
Второй член в этом выражении появился в связи с накоплением части тепла в массе вещества, находящегося в реакторе
(Ср – изобарная теплоемкость реагентов). |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
tg( f |
|
) = |
|
d |
( |
f |
|
) = |
|
d |
Q k |
|
dV exp |
− |
E |
Cn |
= |
|
|||||||||||||
2 |
|
|
2 |
|
|
0 |
|
|
|||||||||||||||||||||||
|
|
|
|
|
dT |
|
|
|
|
|
|
dT |
|
|
p |
|
|
|
|
|
RT |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
= Q k |
|
dVCn |
|
E |
|
|
|
exp |
− |
E |
. |
|
|
|
|
|
|
|
|
|
|
||||||||||
0 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
p |
|
|
|
|
|
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
|
|
|
|
|
|
|
|
||||||
Отсюда, условие устойчивости температурного режима в точке |
|||||||||||||||||||||||||||||||
равновесия: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К |
d F |
|
+ dV ρgC |
p |
|
> Q k |
|
dVCn |
E |
|
|
exp |
− |
E |
. |
(193) |
|||||||||||||||
|
|
0 |
|
2 |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
RT |
|
|
|
|
RT |
|
|
||||||
dV |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Достаточно сильными средствами регулирования температурного режима реактора являются параметры К и (dF/dV). Первый из них может быть изменен за счет выбора хладоагента и режима теплообмена, второй позволяет за счет секционирования реактора (проведение реакций в тонких трубках) значительно увеличить tg( f1 ).
Рассмотрим поведение системы (рис. 46) при температурах выше Tпв . Ранее было указано, что температура в системе может возрастать
неограниченно. В действительности, для подавляющего числа случаев увеличение температуры имеет ограничение, связанное с кинетикой, или материальным балансом процесса. Очевидно, что для проточных реакторов количество генерируемого тепла в единицу времени не может превысить тепла реакции, которое связано с количеством
128
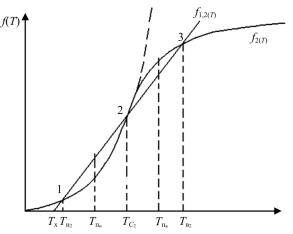
подаваемого и преобразуемого сырья в единицу времени, т.е. Vсек. С другой стороны, при проведении реакции на катализаторе при высоких температурах скорость реакции возрастает настолько, что вступает в действие ограничивающий фактор, связанный со скоростью подвода вещества к поверхности катализатора. Обычно это диффузия в пограничном слое. Диффузия – достаточно медленный процесс, слабо зависящий от температуры. Поэтому при повышении температуры обязательно наступает момент, когда возможная скорость реакции становится больше скорости диффузии. Поэтому диффузия ограничивает скорость протекания химической реакции. Следовательно, кри-
вая, соответствующая f2 (τ) на рис. 45, во всех случаях не может
иметь неограниченного роста, но при высоких температурах начнет отклоняться вправо почти до горизонтального состояния. При этом для условий f1,2 появится еще одно решение при Tв2 .
Рис. 46. Эффект катастрофы при работе реактора
Поведение системы при нижней промежуточной температуре Tн2 <Tпн <TC2 рассмотрено выше: система будет переходить в ниж-
нюю устойчивую точку 1 (условие (193)). При любой верхней про-
129

межуточной температуре TC2 <Tпв <Tв2 система будет переходить
в состояние, соответствующее верхней устойчивой точке 2 (условие (193)). Особое внимание заслуживает средняя точка TC2 , соответст-
вующая одному из решений уравнения (191). В этой точке условие (193) не соблюдается, и она является неустойчивым решением. Любое малейшее нарушение баланса тепла переведет систему либо в левый, либо в правый диапазон температур, в результате чего система достаточно быстро «переключится» в одно из своих устойчивых состояний – 1 или 3. Это явление называется бифуркацией и подробно изучается в теории катастроф.
11.3. Пример расчета реакторов при учете теплового эффекта реакции
Ι. Рассчитать степень превращения в адиабатическом и политропном реакторе идеального вытеснения для реакции разложения:
A → R + S.
С |
|
=10 |
кмоль |
; |
k = exp |
|
29,7 − |
186 200 |
|
сек−1 , |
M |
|
= 60 ; |
||||
А0 |
|
3 |
|
|
|
A |
|||||||||||
|
|
м |
|
|
|
|
RT |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Cp =155 |
Дж |
|
|
; ∆Hp = +62 800 |
Дж |
. |
|
|
|
||||||
|
|
моль град |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
моль |
|
|
|
||||
Начальная температура 350 °С. Считается, что реакция проходит только в объеме реакционной зоны, представляющей собой трубку
с внутренним диаметром 50 мм, длиной L = 10 м; Vсек = 0,2 10−3 м3 с . Теплоемкость жидкости остается примерно постоянной. Удельный вес γ также принимается примерно постоянным и равным 600 кгм3 .
1. Адиабатический реактор.
1.1. Сечение F = πd4 2 = 3,144 0,052 =1,96 10−3 м2 .
130
