
книги / Химия диэлектриков
..pdf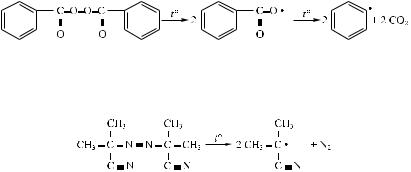
В качестве инициаторов используют в основном азосоединения и органические пероксиды. Распространенным инициатором является пероксид бензоила, распад которого описывается уравнением
Другой инициатор азо-бис-изобутиронитрил распадается с выделением азота:
Скорость разложения инициаторов зависит от их химического строения, от температуры реакции и от используемого растворителя. Поэтому, меняя температуру процесса или при постоянной температуре меняя растворитель, можно подобрать оптимальные условия для распада инициатора.
Инициаторы могут распадаться под действием света и особенно ультрафиолетового облучения. В этом случае скорость распада не зависит от температуры, а определяется интенсивностью и длиной волны падающего света. Поскольку растворители способны поглощать определенную долю падающего излучения, они тем самым снижают скорость распада инициаторов.
Интересно отметить, что ультрафиолетовое облучение способно возбуждать и непосредственно молекулы мономера без инициаторов. Полимеризацию, инициированную ультрафиолетовым светом, называют фотоинициированной полимеризацией.
Молекулы инициаторов могут распадаться на свободные радикалы под действием катализаторов. Эти реакции в основном происходят с переносом электрона и относятся к окислительно-восстано- вительным. К ним более склонны пероксиды и гидропероксиды. Пероксид бензоила распадается уже при комнатной температуре в присутствии ароматических третичных аминов.
31

Инициирование
Итак, свободный радикал содержит неспаренный электрон. Такая частица является в высшей степени нестабильной, реакцион- но-активной и постоянно подыскивает себе пару, чтобы перейти в стабильное состояние. Она немедленно атакует любую молекулу, которая содержит неспаренный электрон или не очень бдительно следит за своими валентными электронами.
Если в системе есть соединения с двойной связью, то свободный радикал немедленно атакует -электроны двойной связи мономера. В приведенных ниже уравнениях -углерод-углеродная связь в молекуле мономера изображена как обычно, черточкой, а -связь — в виде пары электронов, чтобы лучше представить суть происходящих явлений.
Поскольку электронная плотность -связи расположена вне плоскости молекулы и далеко удалена от ядер, она становится легкой добычей свободного радикала. Он вырывает один электрон-связи и образует -связь с атомом углерода. Второй электрон бывшей -связи переходит на концевой углеродный атом.
Другими словами, свободнорадикальный активный центр перемещается с радикала инициатора на мономерное звено. Этот процесс электронной перестройки сопровождается выделением энергии (порядка 80 кДж/моль), так как -электронный уровень энергетически выше, чем -уровень. Таким образом, свободнорадикальная атака мономера на стадии инициирования — экзотермический процесс, в то время как распад инициатора на свободные радикалы — процесс эндотермический.
Вся цепь превращений от атаки мономера свободным радикалом до переноса неспаренного электрона на мономерное звено называется стадией инициирования полимеризации.
Ðîñò öåïè
После инициирования следует процесс роста цепи. На этой стадии активный центр, находящийся на первом мономерном звене,
32

атакует двойную связь следующей молекулы мономера. Эта атака приводит к присоединению второго звена и к переносу активного центра на него:
Хотя активный центр в виде неспаренного электрона сохраняется, такой процесс термодинамически выгоден, поскольку -связь заменяется на простую -связь с высвобождением 80 кДж/моль тепловой энергии.
Активный центр атакует следующую молекулу мономера и т. д. Рост цепи продолжается, пока свободный радикал не погибнет на примесях или при встрече с себе подобным или пока не ис- черпается весь мономер.
Структуру растущей цепи можно изобразить следующим обра-
çîì:
Такая структура полимерной молекулы образуется в том слу- чае, если один из атомов углерода при двойной связи в молекуле мономера более доступен для образования -связи, чем другой. Причиной этого могут быть пространственные или электронные эффекты. Если же такого различия между атомами при двойной связи нет, возможны четыре типа присоединения молекулы мономера к активному центру растущей цепи:
1. Голова к хвосту:
33

2.Хвост к хвосту:
3.Голова к голове:
4.Хвост к голове:
Конечно, надо предварительно договориться, что считать головой, а что — хвостом молекулы.
Следует отметить, что при любом типе присоединения каждый раз -связь опускается на -уровень. Поэтому процесс идет самопроизвольно с выделением 80 кДж на каждый присоединенный моль мономера, т. е. необходим лишь небольшой подвод энергии к реакционной смеси на стадии распада инициатора на свободные радикалы, а дальше по ходу процесса энергию необходимо отводить, чтобы избежать теплового взрыва реактора.
Обрыв цепи
Стадия роста цепи рано или поздно заканчивается обрывом цепи. При этом присоединение молекул мономера к растущей полимерной молекуле прекращается, и рост цепи останавливается.
При разложении инициатора образуется большое количество свободных радикалов, и каждый из них инициирует рост своей цепи. Поэтому в системе одновременно существует много или, по крайней мере, несколько растущих цепей. В зависимости от температуры, времени реакции, концентрации мономера и инициатора существует большая или меньшая вероятность столкновения двух
34
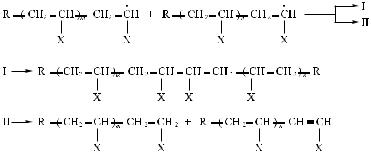
растущих цепей. В этом случае между ними возможны два типа взаимодействий, ведущие к обрыву этих цепей:
В первом случае две цепи, являющиеся свободными радикалами, взаимодействуют своими реакционными центрами, объединяют неспаренные электроны и образуют -связь. Поэтому такой вид обрыва цепей называют обрывом путем рекомбинации.
Во втором случае атом водорода от одной цепи перескакивает со своим электроном к концевому атому другой цепи и образует с ним -связь. Цепь, отдавшая атом водорода, стабилизируется путем образования концевой двойной связи. В этом случае получаются две цепи, каждая из которых короче, чем цепь, образованная по первому, рекомбинационному пути. Такой тип обрыва цепей называют диспропорционированием.
Поскольку в результате обрыва цепей образуются неактивные молекулы, не способные к дальнейшему росту, их иногда называют «мертвыми». Как видно из приведенных примеров, макромолекулы полимера, или «мертвые» цепи, кроме повторяющихся звеньев, могут содержать и другие фрагменты (R– и –CH=CHX). Обычно они располагаются на концах цепи и потому называются концевыми группами.
Передача цепи
Существует еще один вид взаимодействий, ограничивающий рост цепей, который получил название передачи цепи.
При реакции передачи цепи одна растущая цепь прекращает свой рост, но одновременно с этим появляется новый свободный радикал, способный инициировать рост новой полимерной цепи.
35

Эта реакция протекает обычно за счет отрыва атома водорода или любого другого подвижного атома от молекул мономера, инициатора, растворителя, любой примеси или даже «мертвых» полимерных цепей.
Схематически это можно представить так:
При этом старая цепь прекращает свой рост, а на появившемся радикале начинается рост новой цепи. Получается, что рост цепи перенесли с одного активного центра на другой, откуда и название — реакция передачи цепи.
В результате передачи цепи через низкомолекулярные соединения уменьшается средняя молекулярная масса полимера, но при этом образуются молекулы более однородные по величине молекулярной массы. Низкомолекулярные соединения, специально используемые для этого, называются регуляторами роста цепи.
Ингибиторы
Ингибиторы — это химические вещества, способные замедлять или прекращать рост полимерной цепи путем превращения активных свободных радикалов в малоактивные радикалы или стабильные продукты.
Наиболее часто в качестве ингибиторов используются гидрохинон, нитро- и динитробензол.
Некоторые ингибиторы представляют собой стабильные долгоживущие свободные радикалы, которые не взаимодействуют с нейтральными молекулами, но легко обрывают растущие цепи путем прямой рекомбинации с активным центром. К таким ингибиторам относится дифенилпикрилгидразил:
36

Атмосферный кислород тоже является хорошим ингибитором, поскольку его молекулы бирадикальны по природе:
Из приведенного уравнения видно, что на одной молекуле кислорода гибнут две растущие полимерные цепи. Поэтому радикальную полимеризацию обычно проводят в атмосфере азота, исключая контакт реакционной смеси с кислородом.
Основное назначение ингибиторов — предохранять мономеры от самопроизвольной полимеризации во время их хранения и транспортировки. Перед полимеризацией, естественно, мономеры надо освободить от ингибиторов. Это достигается либо перегонкой мономеров, либо их промывкой раствором щелочи. При этом ингибиторы или разрушаются, или в виде натриевых солей переходят
âводную фазу.
Âпроизводстве полимеров ингибиторы иногда не удаляют из мономера, а добавляют небольшой избыток инициатора, который, распадаясь на свободные радикалы, в первую очередь связывает ингибиторы.
Другое применение ингибиторов — регулирование размера полимерных цепей. Если необходимо получить однородный продукт линейного строения, не допустить его сшивания и излишней полимеризации, то по достижении нужной степени полимеризации в систему вводят ингибитор, который убивает все растущие цепи и как бы замораживает достигнутое к данному моменту состояние полимера.
3.1.2. Ионная полимеризация
Ионная полимеризация также протекает по цепному механизму и также включает атаку на -электронную пару мономера. Однако в этом случае на нее воздействует не свободный радикал с неспаренным электроном, а положительный или отрицательный ион.
Катионная полимеризация
Представим реакционную систему, в которую вводится протон. Протон как электрофильная частица вытягивает на себя оба -элек- трона двойной связи мономера и образует простую -связь с ато-
37

мом углерода в голове молекулы, а положительный заряд перемещается к хвосту.
Происходит инициирование цепи с образованием катиона карбония. Этот карбкатион атакует электроны -связи второй молекулы мономера, оттягивает их на себя и образует -связь, а положительный заряд смещается к хвосту второй молекулы.
Далее по такому же механизму продолжается рост цепи. В этой цепной реакции в отличие от радикальной полимеризации происходит не разделение -электронной пары мономера, а ее совместное перемещение с образованием карбкатиона.
Для инициирования роста цепи используют кислоты Льюиса, такие как трехфтористый бор. Применительно к ионной полимеризации их называют катализаторами. В присутствии небольших количеств воды или спиртов (называемых сокатализаторами) катализаторы образуют гидраты, существующие в виде ионных пар:
Здесь Н+ — инициирующий полимеризацию активный центр, а [F3BOH]– — противоион. В процессе полимеризации протон атакует -электроны мономера, начиная рост цепи, а анион [F3BOH]– сопровождает растущую цепь, постоянно следуя за карбкатионом.
Обрыв цепи при катионной полимеризации происходит в результате присоединения противоиона к карбкатиону растущей цепи и далее по схеме:
38

Эту реакцию переноса протона с регенерацией гидрата трехфтористого бора называют «осаждением ионной пары». Возможен
èдругой путь:
Âобоих случаях происходит регенерация исходного катализа-
òîðà.
Âкачестве катализаторов катионной полимеризации, кроме ВF3, используют также AlCl3, SnCl4, TiCl4. По механизму катионной полимеризации наиболее часто полимеризуют изобутилен, стирол, метилстирол, многие простые виниловые эфиры.
Анионная полимеризация
Известен другой тип ионной полимеризации, когда атаку -свя- зи мономера осуществляет анион. Отрицательный заряд аниона отталкивает -электроны двойной связи по возможности дальше — на самый конец присоединяющейся молекулы мономера. Одновременно атакующий анион образует -связь с молекулой мономера за счет собственных электронов, а смещаемые -электроны образуют карбанион.
Образовавшийся карбанион атакует новую молекулу мономера, отталкивая ее -электроны к одному концу и присоединяя другим концом и т. д.
Таким образом, если в катионной полимеризации -электроны смещаются в сторону, противоположную росту цепи, то здесь —
âнаправлении роста.
Âкачестве катализатора анионной полимеризации используют металлоорганические соединения: бутиллитий, трифенилметилкалий, этилат натрия, амиды металлов. Мономеры, полимери-
39

зуемые по анионному механизму: бутадиен, изопрен, стирол, акрилонитрил.
Конечно, в анионной полимеризации тоже существует противоион (катион), постоянно следующий за растущей цепью. Замече- но, однако, что обрыв цепи в этом виде полимеризации не обязателен. Если мономер и катализатор достаточно чисты, то реакция идет на 100 % и карбанионы на концах цепей остаются активными. Если к синтезированному полимеру добавить свежий мономер, то реакцию можно возобновить даже через несколько недель.
3.1.3. Координационная полимеризация
К категории координационной полимеризации относят реакции олефинов и диенов в присутствии металлоорганических катализаторов.
На первой стадии этого полимеризационного процесса молекула мономера встраивается в металлоорганическое соединение по связи металл — алкил:
Ме — переходный металл типа титана, молибдена, хрома, ванадия, никеля или родия.
Рост цепи происходит путем внедрения молекул мономера между металлом катализатора и углеродом цепи:
Важно отметить, что при таком типе присоединения молекулы мономера ориентируются относительно катализатора строго определенным образом, эта же ориентация сохраняется и в растущей цепи. Благодаря этому, образуются так называемые стереорегулярные полимеры.
Часто при координационной полимеризации активный комплекс является гетерогенным, т. е. ион металла находится в твердой
40
