
- •Практические занятия по физике
- •Часть 1
- •Учебное пособие
- •Краткие теоретические сведения и основные формулы
- •Величина полного ускорения
- •Поступательное движение
- •В случае равномерного вращательного движения угловая скорость
- •Алгоритм решения задач
- •Вращательное движение
- •Примеры решения задач
- •Решение
- •Решение
- •Уравнение движения при равноускоренном движении имеет вид
- •Решение
- •Решение
- •Задачи для самостоятельного решения
- •Краткие теоретические сведения и основные формулы
- •Выражение (2.5) можно записать в виде
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Подставив это выражение в уравнение (2), найдём
- •Решение
- •Подставляя численные значения, получаем
- •Решение
- •Решение
- •Задачи для самостоятельного решения
- •Занятие 3
- •Законы сохранения импульса и момента
- •Импульса. Энергия. Работа. Мощность
- •Контрольные вопросы для подготовки к занятию
- •Краткие теоретические сведения и основные формулы
- •Потенциальная энергия упруго деформированного тела
- •Полная механическая энергия:
- •Для переменного момента силы:
- •Примеры решения задач
- •Решение
- •Решение
- •Перепишем векторное уравнение (1) в скалярном виде
- •Кинетическая энергия начального положения тела
- •Решение
- •Подставив числовые значения, получим
- •Решение
- •Решение
- •Кинетическая энергия диска, вращающегося вокруг своей оси
- •Решение
- •Решение По закону сохранения энергии
- •Задачи для самостоятельного решения
- •Занятие 4
- •Краткие теоретические сведения и основные формулы
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Тогда – плотность газа равна произведению массы одной молекулы на концентрацию молекул. Получим
- •Отсюда получаем изменение давления при утечке газа
- •Задачи для самостоятельного решения
- •Занятие 5
- •Явления переноса. Распределение молекул
- •По энергиям.
- •Контрольные вопросы для подготовки к занятию
- •Краткие теоретические сведения и основные формулы
- •Примеры решения задач
- •Решение
- •Решение Барометрическая формула
- •Задачи для самостоятельного решения
- •Занятие 6 первое и второе начала термодинамики Контрольные вопросы для подготовки к занятию
- •Краткие теоретические сведения и основные формулы Первое начало (закон) термодинамики выражает закон сохранения энергии:
- •На основании первого начала термодинамики
- •Адиабатный процесс
- •Работа, совершаемая газом при адиабатном процессе:
- •Теплоемкость одного моля и удельная теплоемкость при постоянном давлении:
- •Методика решения задач
- •I часть Примеры решения задач
- •Решение
- •Задачи для самостоятельного решения
- •II часть Примеры решения задач
- •Решение
- •Тогда работа
- •Вычислим
- •Решение
- •Решение
- •Задачи для самостоятельного решения
- •Занятие 7 закон кулона. Теорема остроградского – гаусса Контрольные вопросы для подготовки к занятию
- •Краткие теоретические сведения и основные формулы
Занятие 6 первое и второе начала термодинамики Контрольные вопросы для подготовки к занятию
1. Что является предметом термодинамики и в чем сущность термодинамического метода исследования физических явлений?
2. Дайте определения термодинамической системы, равновесного состояния, процесса. Почему неравновесные процессы нельзя изображать в диаграммах состояния?
3. Чем отличается внутренняя энергия реального газа от внутренней энергии идеального газа?
4. Сформулируйте и запишите выражения первого начала (закона) термодинамики.
5. Какой вид принимает уравнение первого начала термодинамики для изохорного, изобарного и изотермического процессов? По каким формулам можно рассчитать производимую работу, количество переданной теплоты и изменение внутренней энергии идеального газа при этих процессах?
6. Какая теплоемкость газа больше при постоянном объеме или при постоянном давлении и почему? Напишите уравнение Р. Майера.
7. Дайте определение адиабатного процесса. Какими формулами выражается связь между параметрами состояния идеального газа при адиабатном процессе?
8. При каком процессе происходит более значительное изменение давления в зависимости от изменения объема – при изотермическом или адиабатическом?
9. Запишите формулы, по которым можно теоретически рассчитать теплоемкости идеальных газов и показатель адиабаты.
10. Какой процесс называется круговым (или циклом)? Изобразите цикл на диаграмме и поясните его.
11. В чем различие между обратимыми и необратимыми процессами? Почему все реальные процессы необратимы?
12. Каковы особенности прямого цикла? По какой формуле определяется термический КПД тепловой машины?
13. Каковы особенности обратного цикла? Что такое холодильный коэффициент и коэффициент перекачки теплового насоса?
14. Изобразите схематически цикл Карно в координатах рV и поясните его.
15. Приведите формулировки второго закона термодинамики. Чем он дополняет первый закон термодинамики?
16. Что такое энтропия? По каким формулам можно определить изменение энтропии идеального газа?
Краткие теоретические сведения и основные формулы Первое начало (закон) термодинамики выражает закон сохранения энергии:
Q = U + A. (6.1)
Теплота Q, сообщаемая системе, расходуется на изменение ее внутренней энергии U и на совершение ею работы против внешних сил.
Формулу (6.1) для малого изменения состояния системы можно записать в дифференциальной форме:
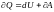 .
(6.1а)
.
(6.1а)
где
dU
– малое изменение внутренней энергии
системы;
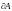 - элементарная работа, совершенная
системой;
- элементарная работа, совершенная
системой;
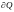 – элементарное
количество подведенной теплоты.
– элементарное
количество подведенной теплоты.
Количество теплоты, подводимое к рабочему телу, определяется по формуле
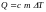 Дж,
(6.2)
Дж,
(6.2)
где
m
- масса тела, кг;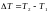 - изменение температуры, К;
с - удельная
теплоемкость,
- изменение температуры, К;
с - удельная
теплоемкость,
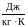 .
.
Удельная теплоемкость с – физическая величина, равная количеству теплоты, необходимому 1 кг вещества для изменения его температуры на 1 К:
 Дж,
(6.3)
Дж,
(6.3)
где С – молярная теплоемкость, .
Молярная теплоемкость С – физическая величина, равная количеству теплоты, необходимому 1 молю вещества для изменения его температуры на 1 К.
Молярная теплоемкость С и удельная теплоемкость с связаны между собой соотношением С = ∙ с.
Работа, совершаемая системой:
- при бесконечно малом изменении объема
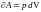 Дж;
(6.4)
Дж;
(6.4)
- при конечном изменении объема
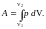 (6.5)
(6.5)
Работа и теплота представляют собой две количественно эквивалентные формы передачи энергии и в системе СИ измеряются в джоулях (Дж).
Количества
работы и теплоты зависят от вида процесса,
при котором система переходит из одного
состояния в другое. В частности, в газах
различают теплоемкость при постоянном
давлении ср
и при постоянном объеме
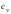 .
.
Работа и теплота, в отличие от внутренней энергии, не являются функциями состояния и поэтому их элементарное приращение А и Q нельзя обозначить полным дифференциалом.
Изменение внутренней энергии идеального газа при любом процессе
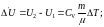 (6.6)
(6.6)
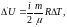 (6.7)
(6.7)
где i – число степеней свободы.
Изменение внутренней энергии однозначно определяется начальным и конечным состоянием системы. При совершении системой любого процесса, в результате которого она вновь возвращается в исходное состояние, полное изменение ее внутренней энергии равно нулю, т.е.
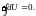
Изохорный процесс (V = const) характеризуется следующими соотношениями:
 ;
(6.8)
;
(6.8)
dV = 0, A = 0, Q = U,
т.е. теплота, сообщенная газу, полностью идет на изменение его внутренней энергии.
Изобарный процесс (р = сonst):
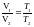 ,
(т
= соnst,
μ
= const).
(6.9)
,
(т
= соnst,
μ
= const).
(6.9)
При изобарном процессе работа газа при изменении объема, например от V1 до V2, равна
 ,
(т
= соnst,
μ
= const).
(6.10)
,
(т
= соnst,
μ
= const).
(6.10)
Если
использовать уравнения Менделеева –
Клапейрона для выбранных состояний, то
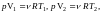 откуда
откуда
 .
(6.11)
.
(6.11)
Из этого выражения вытекает физический смысл молярной (универсальной) газовой постоянной
 ,
,
т.е. она численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К (R = 8,31 )
