
3159
.pdf
Lik Lki |
(4.15) |
Согласно этим соотношениям, i-тая термодинамическая сила Xi влияет на поток k -того свойства jk таким же образом, как k -тая сила Xk на поток i-того свойства ji .
Соотношения взаимности есть следствие принципа микроскопической обратимости, утверждающего, что, если в момент времени t в механической системе поменять все скорости на обратные (т. е. изменить направление потоков в нашей терминологии), то все процессы пойдут в обратном направлении через те же состояния, что в прямом. Применительно к химическим реакциям (диффузию можно рассматривать, как мономолекулярную «реакцию») это положение означает принцип детального химического равновесия. В состоянии равновесия любой молекулярный процесс и процесс, обратный этому процессу, протекают с одинаковой скоростью. По Фаулеру: «Мы можем ожидать, что в системе, находящейся в равновесии, частота перехода от условий A к условиям B будет такой же, как от B к A...
переходы от A к B не должны рассматриваться как сбалансированные при помощи различных непрямых путей переходов, таких как от B к C , а затем к A».
Принцип детального химического равновесия не вытекает из первого и второго законов термодинамики, а является дополнительным к ним.
В системе, где имеется несколько независимых реакций, A B
B
связанных циклом типа |
C |
, принцип детального |
A B |
|
|
равновесия  C
C выполняется лишь в том случае, если справедливы соотношения взаимности.
выполняется лишь в том случае, если справедливы соотношения взаимности.
Общее доказательство выходит за пределы представлений о химическом равновесии. При доказательстве
131
соотношений взаимности устанавливается соответствие между потоком в неравновесной системе ji и скоростью изменения
термодинамических параметров системы xi , причем предполагается, что система находится в состоянии, сравнительно близком к равновесию. В этом случае
отклонение xi от равновесного значения xie можно считать малым и, разлагая скорости xi в ряд по степеням x1 x1e , x2 x2e ,..., ограничиваться членами первого порядка.
4.3. Термодинамика многокомпонентной системы при одновременном действии нескольких градиентов
В качестве примера использования второго постулата Онзагера найдем термодинамические силы, вызывающие перенос вещества i-того сорта в многокомпонентной системе
(так называемая химическая или диффузионная сила, XD ) и
перенос тепла (тепловая сила, XT ) при одновременном действии градиентов концентрации и температуры.
Изменение энтропии при необратимом процессе записывается как
TdS dU pdV idci , |
(4.16) |
i |
|
здесь U - внутренняя энергия; p - давление; V - объем; |
|
T - температура; i , и ci - химический |
потенциал и |
концентрация i-того компонента.
Если объем остается постоянным, а энергия и концентрация компонентов могут изменяться в связи с происходящим переносом тепла и вещества, выражение (4.16) примет вид
132
S |
|
1 |
|
U |
|
|
i |
|
ci |
. |
(4.17) |
t |
|
|
i T |
|
|||||||
|
T t |
|
t |
|
|||||||
Частные производные берутся в произвольной точке системы.
Чтобы выразить U t и ci
t и ci  t через соответствующие плотности потоков энергии (тепла jT ) и вещества ji ,
t через соответствующие плотности потоков энергии (тепла jT ) и вещества ji ,
воспользуемся законами сохранения энергии:
U |
|
|
|
|
div |
j 0 |
(4.18) |
||
|
||||
t |
i |
|
||
|
|
|||
и вещества (частиц i-того сорта):
ci |
|
|
|
|
div |
ji 0, |
(4.19) |
||
t |
||||
|
|
|
записанными в форме уравнений непрерывности. Подставим U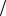 t и ci
t и ci  t из уравнений (4.18) и (4.19) в
t из уравнений (4.18) и (4.19) в
(4.17)
S |
|
1 |
|
|
|
|
i |
|
|
|
|
|
|
div |
jT |
|
div |
ji . |
(4.20 |
||
t |
T |
|
|
|||||||
|
|
|
i |
T |
|
|
||||
Чтобы воспользоваться вторым постулатом Онзагера, нужно, чтобы правая часть уравнения (4.20) была записана в форме произведения потоков на градиенты, определяющие термодинамические силы ( jk Xk ). Заметим, что в правой
k
части уравнения (4.20) стоят произведения скаляров на дивергенции векторов. Воспользуемся известным соотношением векторного анализа
div a diva a ,
следовательно,
diva div a a .
тогда
133

S |
|
|
j |
T |
|
1 |
|
|
|
|
|
|
|
i |
j |
i |
|
|
|
|
i |
|
|
|||||||
|
|
div |
|
jT |
|
|
|
|
|
div |
|
|
|
ji |
|
|
или |
|||||||||||||
|
|
T |
|
|
|
T |
|
|
|
|
||||||||||||||||||||
t |
|
|
|
T |
|
|
i |
|
|
|
|
|
i |
|
T |
|
||||||||||||||
|
S |
|
|
jT |
i ji |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
i |
|
|
|
||||||||||||
|
|
|
div |
|
|
|
|
|
|
jT |
|
|
|
ji |
|
|
. |
(4.21) |
||||||||||||
|
t |
|
|
|
T |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
i |
|
T |
|
|
|
||||||||||
Видно, что правая часть уравнения (4.21) уже имеет нужную форму произведения потоков на градиенты. Левая же, очевидно, представляет собой полное изменение энтропии в
единицу времени dS |
dt , |
|
а |
выражение под |
знаком |
||||||||
дивергенции имеет смысл плотности потока энтропии |
jS в |
||||||||||||
системе, где протекают потоки тепла jT и вещества ji : |
|||||||||||||
|
|
|
|
1 |
i |
|
|
||||||
|
jS |
|
|
|
jT |
ji . |
(4.22) |
||||||
|
|||||||||||||
|
|
|
|
|
T |
|
i |
|
|
|
|
||
Таким образом, уравнение (4.21) совпадает по форме с |
|||||||||||||
уравнением (4.14) второго постулата Онзагера: |
|
||||||||||||
|
dS |
|
S |
|
|
|
|
1 |
|
|
|
||
|
|
|
|
|
|
|
divjS |
|
|
|
jk Xk . |
(4.23) |
|
|
dt |
t |
|
T |
|
||||||||
|
|
|
|
|
|
|
k |
|
|||||
Отметим, что для энтропии нет закона сохранения, как это есть для энергии или вещества: dU dt 0 и dci
dt 0 и dci  dt 0, но dS
dt 0, но dS dt 0.
dt 0.
Из сравнения уравнений (4.23) и (4.21), видно, что тепловая сила
|
|
1 |
|
|
1 |
|
|
XT |
T |
|
|
|
|
T , |
(4.24) |
|
|
||||||
|
T |
|
T |
|
|||
а диффузионная (химическая)
XDi T i |
T . |
(4.25) |
В изотермическом случае T const
134
XDi i ,
что точно совпадает с результатом (4.2), полученным на основе качественного термодинамического анализа. Аналогично можно показать, что термодинамическая сила, вызывающая перемещение заряженной частицы в электрическом поле, равна
Xe |
e |
, |
(4.26) |
где e - заряд частицы; - потенциал поля. Термодинамическая сила химической реакции (роль
«потока» в этом случае играет скорость реакции)
Xхим i i , |
(4.27) |
i |
|
где i - химический потенциал i-того компонента; i -
стехиометрический коэффициент i-того компонента в уравнении реакции.
Поскольку в случае химической реакции «поток» является скалярной величиной, то и соответствующая сила — скаляр.
Исходя из полученных, результатов дадим общее феноменологическое описание изотермической диффузии в бинарной системе, содержащей атомы двух сортов и вакансии.
В системе возникнут три потока: два - атомов и третий - вакансий. В соответствии с первым постулатом Онзагера (4.13)
j L X |
|
L X |
|
L X |
|
|
; |
|
||||
|
1 |
11 |
1 |
12 |
2 |
13 |
|
3 |
|
|
(4.28) |
|
j2 |
L21X1 |
L22 X2 |
L23 X3 |
; |
||||||||
j |
3 |
L X |
1 |
L X |
2 |
L X |
3 |
. |
|
|||
|
31 |
32 |
33 |
|
|
|
|
|||||
Термодинамические силы, как это следует из уравнения |
||||||||||||
(4.2), равны |
|
|
|
|
|
|
|
|
|
|
|
|
X1 1; X2 |
2; |
X3 |
3, |
(4.29) |
||||||||
135
где 1 и 2 - химические потенциалы атомов сортов A и B ; 3 - химический потенциал вакансий.
Потоки (4.28) не являются независимыми. При вакансионном механизме диффузии, если объем образца не изменяется, сумма потоков должна быть равна нулю:
j1 j2 j3 0, |
(4.30) |
или поток вакансий
j3 j j1 j2 .
Условие (4.30) выполняется при любых значениях i ,
поэтому
L11 L21 |
L31 |
0, |
|
|
L12 L22 |
L32 |
0; |
|
(4.31) |
|
||||
L13 L23 L33 0 .
С учетом выражения (4.31) и соотношений взаимности можно записать потоки атомов в следующем виде:
j L |
|
L |
2 |
; |
|
||||||||
|
1 |
11 |
1 |
|
12 |
|
|
. |
(4.32) |
||||
j |
2 |
L |
|
|
|
L |
|
2 |
|
|
|||
|
12 |
1 |
|
22 |
|
|
|
|
|
||||
Согласно первому уравнению Фика, любой из этих потоков имеет вид
ji Di ci .
Сравнение с уравнениями (4.32), полученными из общей феноменологической теории, позволяет сформулировать три условия применимости первого уравнения Фика.
1. Поток атомов любого сорта не зависит от градиента концентрации атомов другого сорта (L12 0). Первое уравнение Фика соответствует модели невзаимодействующих потоков атомов. Разумеется, потоки атомов и вакансий не являются независимыми.
136

2. Вакансия находится в равновесии: cv cve , так что
v 0. Достаточно и менее жесткого требования:
концентрация вакансий всюду одинакова, тогда v 0.
3. Раствор - идеальный (бесконечно разбавленный или совершенный), так что химический потенциал обоих компонентов
i i (T) kTlnci и i kT lnci
При выполнении этих условий оба уравнения (4.32)
можно записать в виде |
|
|
Li i |
|
|
|
|
|
ji |
|
|
kT ci |
|
(4.33) |
|||
|
ci |
|
||||||
|
|
|
|
|
|
|
||
и они совпадают с первым уравнением Фика, если |
|
|||||||
D* |
Li i |
kT. |
|
(4.34) |
||||
c |
|
|||||||
|
i |
|
|
|
|
|
||
|
|
|
|
i |
|
|
|
|
Так как в разбавленном растворе D* B*kT , где |
B* - |
|||||||
|
|
|
|
|
|
i |
i |
i |
подвижность, то величина |
Lii |
ci имеет смысл подвижности |
||||||
атомов i-того сорта.
Отказ от третьего ограничения эквивалентен введению термодинамической активности. В реальном раствореi iст kTlnai . Подстановка этого выражения в уравнения
для потоков опять приведет, в конечном счете, к первому уравнению Фика (4.9), но с коэффициентом диффузии
Di Bi*kT 1 ln i 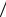 ln ci .
ln ci .
Если потоки атомов взаимодействуют, то L12 0. и полагая, кроме того, что
Если химические потенциалы компонентов связаны уравнениями Гиббса—Дюгема:
c1 1 c2 2 0, |
(4.35) |
137

и сохраняется требование равновесия для вакансий и идеальности для раствора, то вместо уравнений (4.32) получим систему
|
|
|
|
L11 |
|
|
|
L12 |
|
|
|
|
|
||
j1 |
kT |
|
|
|
|
c1; |
|
||||||||
c |
|
|
|
||||||||||||
|
|
|
|
|
|
|
c |
2 |
|
|
|
|
|
||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
(4.36) |
||
|
|
|
|
L22 |
|
|
|
L12 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||
j |
|
kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
2 |
|
|
c2 |
|
|
|
c1 |
|
|
2 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Переход от уравнений (4.33) к уравнениям (4.36) эквивалентен учету вакансионного течения, которое полностью определяет величину перекрестного коэффициента L12 . На важность эффекта вакансионного течения впервые указал Дж. Маннинг. Физически этот эффект заключается в следующем. Если атом движется по вакансионному механизму, то он может совершить, скачок только после того, как в ближайшем к нему узле появилась вакансия.
Рис. 4.2. Эффект течения вакансий
На рис. 4.2 поток вакансий направлен справа налево. При таком направлении потока вакансия имеет большую вероятность приблизиться к атому, показанному крестиком, справа в узел A, чем слева в узел B . Поэтому выделенный атом будет, чаще совершать скачки вправо, чем влево.
138
Величина эффекта зависит от того, насколько часто вакансии приближаются к данному атому по различным направлениям. Таким образом, она зависит от частоты скачков других атомов, а не выделенного атома.
Эффект течения вакансий отличен от эффекта корреляции. Появление корреляционного множителя обусловлено тем, что скачки рассматриваемого атома влияют на распределение вакансий, находящихся вблизи от него. Фактор корреляции не изменяется, если приложена движущая сила. Наоборот, эффект течения вакансий зависит от того, как изменяется распределение вакансий вблизи данного атома изза движения других атомов, а не его. Этот эффект пропорционален движущей силе и исчезает при стремлении потока вакансий к нулю.
Маннинг показал, что учет вакансионного течения заметно изменяет коэффициент взаимной диффузии и сдвиг меток в эффекте Киркендалла.
Таким образом, даже в простом случае бинарного сплава учет перекрестных коэффициентов может быть существенным.
Положение еще более усложняется в многокомпонентных системах, в которых число независимых коэффициентов Lik даже с учетом соотношений взаимности
составляет n n 1 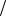 2, где n — число компонентов. Пренебрегать перекрестными коэффициентами в большинстве случаев нельзя, поскольку взаимодействие компонентов является существенным.
2, где n — число компонентов. Пренебрегать перекрестными коэффициентами в большинстве случаев нельзя, поскольку взаимодействие компонентов является существенным.
139
5. ДИФФУЗИЯ В МНОГОФАЗНЫХ СИСТЕМАХ 5.1. Связь между характеристиками диффузии и
диаграммами фазового равновесия
Если диффузия происходит в гомогенном твердом растворе, то концентрационные кривые имеют плавный вид. Если система состоит из нескольких фаз, то на концентрационных кривых c c x появляются вертикальные ступеньки, обусловленные тем, что гетерогенные смеси не могут образоваться диффузионным путем. Действительно, в пределах двухфазной области составы соответствующих фаз постоянны, и градиент концентрации в пределах каждой из них равен нулю. Фаза может расти в результате диффузии только в том случае, если ей отвечает на диаграмме область гомогенности, внутри которой может возникнуть градиент концентрации.
Соответственно диффузия через стехиометрическое химическое соединение, строго говоря, невозможна, если перенос вещества, происходит только под действием градиента концентрации. Это правило, обычно не выполняется, так как всегда имеется хотя бы небольшая область растворимости или действуют другие градиенты.
Это иллюстрируется рис. 5.1. Нижний рисунок в каждой паре представляет собой повернутую на 90° концентрационную кривую, описывающую диффузию компонента B в образце, составленном из двух металлов A и
B . |
Очевидно, что высота (ширина на рис. 5.1.) ступеньки |
соответствует ширине двухфазной области на диаграмме. |
|
A, |
Если вещество B диффундирует при температуре T1 в |
то у поверхности раздела образуется фаза . В любой |
|
момент времени (t 0) концентрация компонента B в фазе изменяется от c 1 (атомные доли) на поверхности до c ,
отвечающего пределу растворимости A в при этой
140
