
- •О.Б. Рудаков, е.А. Хорохордина, л.Г. Барсукова лабораторный практикум по химии
- •Рецензенты:
- •Введение
- •Техника безопасности и правила работы в химической лаборатории
- •Работа 1. Основные классы неорганических соединений
- •1.1. Цель работы
- •1.2. Подготовка к работе
- •1.2.1. Теоретические сведения
- •Номенклатура и химические свойства сложных неорганических веществ
- •Формулы и названия бескислородных кислот
- •Формулы и названия кислородсодержащих кислот
- •1.3. Рабочее задание
- •1.3.1. Свойства основных оксидов
- •1.3.2. Получение и свойства кислотных оксидов
- •1.3.3. Получение и свойства гидроксидов
- •Получение солей и их свойства
- •Варианты заданий
- •1.4. Выполните упражнения
- •2.2.3. Теоретические сведения
- •Расчет объема воздуха, необходимого для горения
- •Расчет объема продуктов сгорания
- •Типовая задача 1
- •Типовая задача 2
- •Типовая задача 3
- •2.3. Рабочее задание
- •Состав горючего вещества и условия его горения
- •Объём воздуха для горения и объём продуктов сгорания веществ
- •2.4. Выполните упражнения
- •3.2.1. Теоретические сведения
- •3.3. Рабочее задание
- •3.3.1. Определение теплоты реакции нейтрализации сильной кислоты сильным основанием
- •Варианты задания
- •3.3.2. Термодинамический расчет изменения стандартной энтальпии реакции нейтрализации и оценка возможности самопроизвольного протекания процесса
- •3.4. Выполните упражнения
- •3.5. Выводы
- •Работа 4. Скорость химических реакций. Химическое равновесие
- •4.1. Цель работы
- •4.2. Подготовка к работе
- •4.3. Рабочее задание
- •4.3.1. Зависимость скорости реакции от концентрации реагирующих веществ
- •Значения термодинамических функций
- •Зависимость скорости реакции от концентрации тиосульфата натрия
- •4.3.2. Зависимость скорости реакции от температуры
- •Зависимость скорости реакции от температуры
- •4.3.3. Определение состояния термодинамического равновесия в системе и направленности химического процесса
- •Термодинамические функции
- •4.3.4. Влияние температуры на смещение химического равновесия
- •Влияние концентрации веществ на химическое равновесие
- •Влияние концентрации веществ на химическое равновесие
- •Влияние давления на химическое равновесие
- •4.4. Выполните упражнения
- •Пример 1
- •Пример 2
- •Пример 3
- •Пример 4
- •5.3. Рабочее задание
- •6.2. Подготовка к работе
- •6.2.1. Теоретические сведения
- •Ионно-молекулярные равновесия в растворах электролитов
- •Кислотно-основные равновесия
- •Измеряя рН раствора известной концентрации, можно вычислить степень диссоциации вещества или электролита. Пример 1
- •Пример 2
- •Равновесия в растворах гидролизующихся солей
- •6.3. Рабочее задание
- •6.3.1. Проведение практически необратимых реакций двойного обмена
- •Перечень реактивов к рабочему заданию
- •6.3.2. Колориметрические методы определения рН
- •Окраска индикаторов в разных средах
- •6.3.3. Измерение рН раствора электролита электрометрическим методом и вычисление степени его диссоциации
- •Варианты рабочего задания
- •6.3.4. Гидролиз солей
- •6.4. Выполните упражнения
- •6.5. Выводы
- •Работа 7. Гетерогенные дисперсные системы
- •7.1. Цель работы
- •7.2. Подготовка к работе
- •7.2.3. Теоретические сведения
- •Решение. Запишем реакцию взаимодействия указанных веществ в молекулярной и ионно - молекулярном форме:
- •Избыток
- •Избыток
- •7.3. Рабочее задание
- •7.3.1. Получение и стабилизация суспензии мела в воде
- •7.3.2. Получение и стабилизация эмульсии масла в воде
- •7.3.3. Получение золей иодида серебра
- •7.3.4. Получение золя гидроксида железа (III)
- •7.3.5. Коагуляция коллоидного раствора Fe(oh)3
- •7.4. Выполните упражнения
- •8.2.1. Теоретические сведения
- •8.3. Рабочее задание
- •8.3.1. Окислительно-восстановительные процессы с участием простого вещества
- •8.3.2. Окислительные свойства азотной кислоты
- •8.3.3. Окислительные свойства бихромата калия
- •Влияние среды на окислительные свойства перманганата калия
- •8.4. Выполните упражнения
- •9.2.1. Теоретические сведения
- •9.3. Рабочее задание
- •9.3.1. Измерение электродных потенциалов металлов
- •Зависимость электродного потенциала от природы металла и концентрации его соли
- •9.3.2. Взаимодействие металлов с водой
- •9.3.3. Взаимодействие металлов с кислотами
- •9.3.4. Взаимодействие металлов с растворами солей
- •9.3.5. Измерение эдс гальванического элемента
- •Зависимость эдс гальванического элемента от природы металлов и концентрации растворов солей
- •9.4. Выполните упражнения
- •10.2.1. Теоретические сведения
- •10.3. Рабочее задание
- •10.3.1. Коррозия меди при контакте с йодом
- •10.3.2. Коррозия при контакте двух металлов
- •10.3.3. Факторы, влияющие на скорость коррозии
- •10.3.4. Защита металлов от коррозии
- •10.4. Выполните упражнения
- •Для процессов на катоде к(-)
- •11.3.2. Электролиз с активным анодом Электролиз сульфата меди с медным анодом
- •11.4. Выполните упражнения
- •11.5. Выводы
- •Работа 12. Теория строения органическисоединений. Номенклатура органических соединений
- •12.1. Цель работы
- •12.3.3. Номенклатура органических соединений (углеводородов)
- •12.4. Выполните упражнения
- •13.2. Подготовка к работе
- •13.2.4. Теоретические сведения
- •13.3. Рабочее задание
- •13.3.1. Получение углеводородов простой перегонкой нефти
- •13.3.2. Химические свойства насыщенных углеводородов
- •13.3.2.1. Получение и свойства метана
- •13.3.2.2. Бромирование насыщенных углеводородов
- •14.2.2. Теоретические сведения
- •14.3. Рабочее задание
- •14.3.1. Химические свойства этиленовых углеводородов
- •14.3.2. Получение и свойства ацетилена
- •15.2.2. Теоретические сведения
- •15.3. Рабочее задание
- •15.3.1. Бромирование ароматических углеводородов:
- •15.3.2. Нитрование толуола
- •15.3.3. Окисление толуола
- •15.5. Выполните упражнения
- •15.4. Выводы
- •Работа 16. Определение теплоты сгорания парафина
- •Цель работы
- •Подготовка к работе
- •16.2.2. Теоретические сведения
- •16.3. Рабочее задание
- •16.4. Выполните упражнения
- •17.2.3. Теоретические сведения
- •17.3. Рабочее задание
- •17.3.1. Отношение спиртов и фенолов к активным металлам, гидроксидам и солям
- •17.3.2. Образование сложных эфиров (реакция этерификации)
- •17.3.3. Дегидрация спиртов
- •17.3.4. Окисление спиртов и фенолов
- •17.3.5.Бромирование фенола
- •17.4. Выполните упражнения
- •18.2.3. Теоретические сведения
- •18.3. Рабочее задание
- •18.3.1. Полимеризация формальдегида (демонстрационно)
- •18.3.2. Окисление альдегидов
- •18.3.3. Конденсация альдегидов и кетонов
- •18.3.4. Кислотные свойства карбоновых кислот
- •18.3.5. Образование и гидролиз сложных эфиров
- •18.3.6. Окисляемость органических кислот
- •18.4. Выполните упражнения
- •19.2.2. Теоретические сведения
- •19.3. Рабочее задание
- •19.3.1. Акролеиновая проба
- •Состав жиров и масел
- •19.3.2. Определение йодного числа
- •Пример расчета йодного числа
- •19.4. Выполните упражнения
- •20.2.1. Теоретические сведения
- •20.3. Рабочее задание
- •20.3.1. Омыление жиров щелочью (получение мыла)
- •20.3.2. Растворимость и обменные реакции мыла
- •20.3.3. Эмульгирующие и моющие свойства мыла
- •20. 3.4. Определение пенообразующей способности пав и устойчивости пен
- •Характеристика пены
- •21.2.1. Теоретические сведения
- •21.3. Рабочее задание а. Синтез полимеров
- •21.3.1. Полимеризация стирола (или метилметакрилата)
- •21.3.2. Получение фенолформальдегидного полимера (резола)
- •21.3.3. Конденсация карбамида с формальдегидом (опыт проводить в вытяжном шкафу)
- •21.3.4. Получение глифталевой смолы
- •21.3.5. Термическая деструкция полиметилметакрилата
- •21.3.6. Выделение хлористого водорода при термическом разложении поливинилхлорида
- •21.3.7. Особенности горения полимерных материалов
- •Особенности горения различных полимерных материалов
- •21.4. Выполните упражнения
- •21.5. Выводы
- •22.2.3. Теоретические сведения
- •22.3. Рабочее задание
- •22.3.1. Гидролиз крахмала кислотами
- •22.3.2. Растворение и гидролиз целлюлозы кислотами
- •22.3.3. Получение азотнокислых эфиров (нитратов) целлюлозы
- •Б. Белки
- •22.3.4. Отношение белков к кислотам и щелочам
- •22.3.5. Биуретовая реакции белков
- •22.3.6. Ксантопротеиновая реакции белков
- •23.4. Выполните упражнения
- •23.5. Выводы
- •Библиографический список
- •Термодинамические характеристики некоторых веществ
- •Равновесие в растворах электролитов
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Оглавление
- •3 94006 Воронеж, ул. 20-летия Октября, 84
16.4. Выполните упражнения
16.5.1. Теплота сгорания октана С8Н18 равна 4817 кДж/моль, а угля равна
394 кДж/моль (при грубом приближении уголь – это 100-процентный углерод). Составьте термохимические уравнения реакций горения этих веществ. Рассчитайте удельные теплоты сгорания С8Н18 и угля. Сделайте вывод о том, какое из этих веществ более горючее.
16.5.2. С помощью формулы Д.И. Менделеева (см.формулу (16.2)) определите низшую удельную теплоту сгорания метана (кДж/кг) и сравните её с табличными данными (QСГ.Н(СН4) = 55600 кДж/кг.
16.5. Выводы
16.4.1. Перечислите методы определения теплоты сгорания веществ.
16.4.2. Сравните экспериментальные данные с результатами расчета теплоты сгорания парафина по уравнению Менделеева и объясните причину их расхождений (если они имеются).
Работа 17. СПИРТЫ И ФЕНОЛЫ
17.1. Цель работы
17.1.1. Познакомиться со строением, классификацией, номенклатурой спиртов и фенолов.
17.1.2. Изучить свойства спиртов, фенолов и понять зависимость между их строением и свойствами.
Подготовка к работе
17.2.1. Повторите разделы: представления о типах и механизмах реакций органических соединений.
17.2.2. Усвойте классификацию кислородсодержащих производных углеводородов, их изомерию, номенклатуру.
17.2.3. Теоретические сведения
Спирты (алкоголи) - производные углеводородов, содержащие в своем составе одну или несколько гидроксильных групп (-ОН). Общая формула спиртов R-OH.
Химические свойства спиртов определяются, во-первых, присутствием реакционноспособной гидроксильной группы и, во-вторых, строением связанного с ней радикала. Реакции, идущие с участием гидроксильной группы, могут сопровождаться разрывом связи О Н или С О. Поскольку эти связи полярные, реакции спиртов и фенолов, в основном, протекают по гетеролитическому (ионному) механизму.
Важнейшие реакции спиртов:
1) образование алкоголятов
2R-О-H + 2Na → 2RONa + Н2;
2) образование сложных эфиров (реакция этерификации)
R-О-H + НООС – R → R-О – CO - R + Н2О,
спирт кислота сложный эфир
3) замещение гидроксильной группы на галоген
R - ОН + НВг → R - Вг + Н2О,
4) дегидратация спиртов
(внутримолекулярная) R-CH2-CH2-OH → R-CH2=CH2 + Н2О,
этиленовый
углеводород
(межмолекулярная) R-OH + H-OR → R – О – R + Н2О,
простой эфир
5) окисление спиртов: первичные спирты окисляются сравнительно легко до альдегидов

вторичные спирты окисляются до кетонов

третичные спирты окисляются с разрывом углеродной цепи до смеси кислот, окисление протекает в жестких условиях:

Используя реакции окисления, можно определить положение в цепи гидроксильной группы;
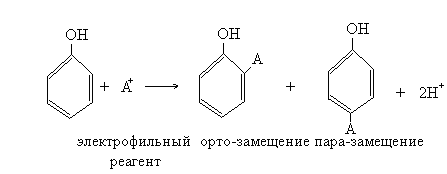
6) реакции электрофильного замещения ароматического кольца фенола (ОН-заместитель I рода)
Литература: [8 - гл. III, § 1 – 5; гл. IХ, § 16].
