
- •Физическая химия
- •Введение
- •Тема 1.
- •Первый закон Термодинамики.
- •Термохимия
- •Теоретические сведения
- •Вопросы для подготовки
- •Примеры решение типовых задач
- •Термодинамические величины некоторых простых веществ и соединений
- •Задачи для самостоятельного решения
- •Тема 2. Второй закон термодинамики Теоретические сведения
- •Вопросы для подготовки
- •Примеры решения типовых задач
- •Тема 3. Химическая кинетика Теоретические сведения
- •Вопросы для подготовки
- •Примеры решения типовых задач
- •Тема 4. Растворы Теоретические сведения
- •Вопросы для подготовки
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •3 94006 Воронеж, ул. 20-летия Октября, 84
М инистерство
образования и науки Российской Федерации
инистерство
образования и науки Российской Федерации
Государственное образовательное учреждение
высшего профессионального образования
Воронежский государственный архитектурно-строительный университет
Кафедра физики и химии
Физическая химия
Методические указания
к самостоятельной внеаудиторной работе по физической химии
для студентов, обучающихся по специальности 270106
«Производство строительных материалов, изделий и конструкций»
Воронеж 2011
У ДК 544
ББК 24.5
Составитель
Г.Г. Кривнева
Физическая химия: метод. указания к самост. внеаудиторн. работе по физической химии студентов, обучающихся по специальности 270106 «Производство строительных материалов, изделий и конструкций». / Воронеж. гос. арх.-строит. ун-т; сост.: Г.Г. Кривнева. – Воронеж, 2011. – 20 с.
Методические указания составлены в соответствии с Государственным образовательным стандартом по дисциплине «Физическая химия» для студентов, обучающихся по специальности 270106 «Производство строительных материалов и конструкций».
Предназначены для самостоятельной подготовки студентов к лабораторным занятиям по основным разделам курса физической химии.
Данные указания составлены в помощь студентам при подготовке к лабораторным занятиям и являются дополнением к Лабораторному практикуму по физической химии.
Табл. 1 . Библиограф.: 2 назв.
УДК 544
ББК 24.5
Печатается по решению редакционно-издательского совета
Воронежского государственного архитектурно-строительного университета
Рецензенты: Н. В. Соцкая, канд. хим. наук, доцент кафедры физической
химии Воронежского государственного университета;
Введение
Самостоятельная работа студентов – важнейший вид обучения. Успешное проведение лабораторных занятий во многом определяется уровнем самостоятельной подготовки студентов. Научить студента работать самостоятельно - одна из основных задач. С этой целью предпринято издание данных методических указаний.
Содержание указаний соответствует рабочей программе курса «Физическая химия» и включает темы: «Первый закон термодинамики. Термохимия», «Второй закон термодинамики», «Химическая кинетика», «Растворы».
В методических указаниях перед каждой темой даются краткие теоретические сведения, рассматриваются решения типовых задач, приводятся задания для самостоятельного решения.
Тема 1.
Первый закон Термодинамики.
Термохимия
Теоретические сведения
Классическая термодинамика применяется к системам, находящимся в термодинамическом равновесии, и рассматривает только начальные и конечные состояния. Первый закон термодинамики – представляет собой закон сохранения энергии в применении к термодинамическим процессам. Одна из его формулировок: в любом процессе приращение внутренней энергии ΔU какой-либо системы равно количеству сообщенной системе теплоты Q минус количество работы А, совершенной системой. Математическое выражение первого закона для процессов, связанных с бесконечно малыми изменениями, имеет вид
dU = δ Q - δА, (1)
для конечного изменения состояния системы
ΔU= Q - А. (2)
Внутренняя энергия системы представляет собой совокупность всех видов энергии, заключенных в рассматриваемой системе. Внутренняя энергия U зависит от природы вещества, его количества, агрегатного состояния, температуры, давления, объема.
Теплота Q является положительной, если энергия поступает в систему, и отрицательной, если энергия отводится из системы. Работа А считается положительной, если она совершается системой, и отрицательной, если совершается над системой.
Если система подчиняется законам идеального газа, то при постоянной температуре dU = 0; при изменении температуры изменение внутренней энергии рассчитывается по уравнению
dU = ν CV ∙ dT, (3)
где CV – теплоемкость системы при постоянном объёме,
ν – количество вещества;
Т – температура.
Во многих термодинамических процессах работа совершается против внешнего давления и рассчитывается по формуле δА = p ·dV,
где р – давление;
V – объём.
Величина работы расширения, совершаемой системой, зависит от условий протекания процесса:
а) при изохорном процессе (V – const)
АV = 0; (4) б) при изотермическом процессе ( Т- const)
АТ
= ν ·R
·T·
ln
![]() = ν ·R·
T·ln
= ν ·R·
T·ln
![]() ;
(5)
;
(5)
в) при адиабатном процессе, протекающем без теплообмена системы с внешнем средой (Q = const),
AQ = - ΔU, АQ = СV · (T2 – T1); (6)
г) при изобарическом расширении (p – const)
AP = p · (V2 – V1) или АP = ν ·R · (T2 – T1). (7)
Применительно к термодинамическим процессам, идущим в гомогенных системах при различных внешних условиях, уравнение (2) первого закона термодинамики записывается следующим образом:
для изохорного процесса (ΔV = 0)
QV = ΔU = СV · (T2 – T1); (8)
для изотермического процесса (Δ U =0)
QT = AT = ν ·R·T·ln = ν ·R·T·ln ; (9)
для изобарного процесса (p – const)
QP = ΔU + p ·ΔV. (10)
Для процессов, связанных с бесконечно малыми изменениями, уравнение (1) принимает вид
δQ = dU + р∙dV. (11)
В случае изобарического процесса сумма U + рV обозначается Н и называется энтальпией, тогда
δQP = dU +p·dV = dH, (12)
то есть изменение энтальпии (dH) системы равно теплоте, которая поглощается либо выделяется в ходе изобарического процесса.
Термохимия изучает тепловые эффекты химических реакций. Основной закон термохимии – закон Гесса: если химическая реакция протекает при постоянном объеме или давлении, то её тепловой эффект будет определяться начальным и конечным состоянием системы и не будет зависеть от пути процесса. Закон является основой всех термохимических расчетов при условии равенства температуры сходных веществ и продуктов реакции.
Согласно следствию закона Гесса энтальпия процесса ΔHr может быть определена как разность между суммой энтальпий образования продуктов реакции (Δf Hпрод) и суммой энтальпий образования исходных веществ (Δf Hисх в-в) с учетом стехиометрических коэффициентов в уравнении реакции. Для реакции в общем виде аА + вВ → nN + mM
Δ
Hr
= Σ![]() f
Hпрод
+ Σ
f
H
исх.
в-в
или
f
Hпрод
+ Σ
f
H
исх.
в-в
или
ΔHr. = nΔf H.(N) +mΔf H (M) – (аΔf H(А) + вΔf H. (В), (13)
где а ,в, n, m – стехиометрические коэффициенты,
Δf H(N), Δf H(M), Δf H(А), Δf H(В) – энтальпии образования веществ.
Стандартные энтальпии образования Δf H0 приводятся в справочниках физико-химических величин. Тепловые эффекты химических реакций зависят не только от природы реагирующих веществ, но и от температуры. Зависимость теплового эффекта от температуры выражается уравнением Кирхгофа, которое приведено в интегральном виде:
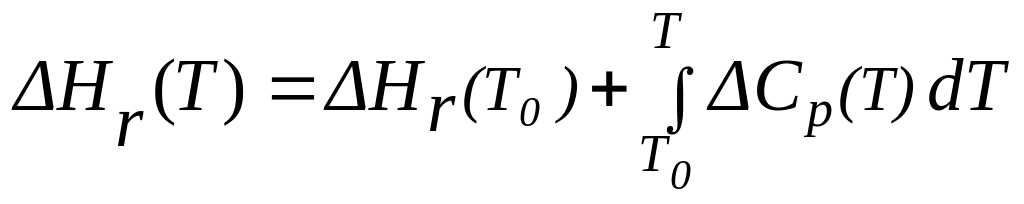 ,
(14)
,
(14)
где ΔHr(T) – тепловой эффект реакции при заданной температуре Т,
ΔHr(T0) – тепловой эффект реакции при температуре Т0,
ΔСр – изменение теплоёмкости при постоянном давлении.
Зависимость теплоёмкости от температуры выражается довольно сложно:
Ср = а + bT + c׳T2 + dT3, (15)
где a, b, c׳, d – коэффициенты (приводятся в справочниках физико-химических величин).
Изменение теплоёмкости в ходе процесса рассчитывается по уравнению
![]() ,
(16)
,
(16)
где
![]() - суммы теплоёмкостей продуктов
реакции и исходных веществ соответственно.
- суммы теплоёмкостей продуктов
реакции и исходных веществ соответственно.
