
Методическое пособие 499
.pdf
ФГБОУ ВПО «Воронежский государственный технический университет»
Кафедра материаловедения и физики металлов
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к выполнению лабораторных работ по дисциплине «Коррозия и защита металлов и сплавов» для студентов направления 150100.62 « Материаловедение и технологии материалов» (профиль «Физическое материаловедение») очной формы обучения
Воронеж 2015
Составитель канд. техн. наук Т.И. Сушко УДК 541.1:502
Методические указания к выполнению лабораторных работ по дисциплине «Коррозия и защита металлов и сплавов» для студентов направления 150100.62 «Материаловедение и технологии материалов» (профиль «Физическое материаловедение») очной формы обучения / ФГБОУ ВПО «Воронежский государственный технический университет»; сост. Т.И. Сушко. Воронеж, 2015. 41 с.
Методические указания содержат теоретическое введение и экспериментальную часть к лабораторным работам по коррозии и защите металлов. В теоретическом введении представлена теория электрохимической коррозии металлов в объеме, достаточном для правильного осмысливания лабораторного практикума и для устных отчетов по лабораторным работам. В конце каждой лабораторной работы даны контрольные вопросы.
Предназначены для студентов четвертого курсов. Методические указания подготовлены в электронном
виде в текстовом редакторе MS Word 2007 и содержатся в файле «коррозия2007.pdf».
Табл. 5. Ил. 13. Библиогр.: 5 назв.
Рецензент канд. физ.-мат. наук, доц. А.В. Миленин. Ответственный за выпуск зав. кафедрой канд. физ.-мат. наук, доц. Д.Г. Жиляков.
Издается по решению редакционно-издательского совета Воронежского государственного технического университета
© ФГБОУ ВПО «Воронежский государственный технический университет», 2015
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Электрохимической коррозией металлов и сплавов называется их самопроизвольное окисление в результате физико-химического взаимодействия с электролитами.
Примеры:
–ржавление различных металлических изделий и конструкций в атмосфере (металлические станки и оборудование заводов, стальные мосты, каркасы зданий, средства транспорта и др.);
–коррозия наружной металлической обшивки судов в речной и морской воде;
–ржавление стальных трубопроводов в земле;
–разрушение баков и аппаратов растворами кислот, солей и щелочей на химических заводах и т.д.
1.1. Электронные потенциалы
Согласно современным представлениям, кристаллическая решетка металлов построена из ионов. При погружении металла в воду ионы его поверхностного слоя под действием полярных молекул воды переходят в раствор, что приводит к возникновению на поверхности металла избытка свободных электронов. Раствор приобретает положительный заряд, а металл – равный по величине заряд противоположного знака.
Накопление ионов металла в растворе начинает тормозить дальнейшее растворение металла. В результате устанавливается равновесие:
+( ) + . (1)
Концентрация ионов металла в растворе и соответственно избыток свободных электронов на поверхности металла обусловливаются природой металла: чем активнее
металл, тем больше ионов он посылает в раствор. Аналогичная картина наблюдается и при погружении
металла в раствор собственной соли, в котором находятся ионы металла Меn+.
Только в этом случае облегчается переход ионов из раствора в металл, и равновесие устанавливается при другом по сравнению с чистой водой соотношении положительных и отрицательных зарядов в растворе и на поверхности металла.
Для неактивных металлов равновесная концентрация ионов металла в растворе очень мала. Если такой металл погрузить в раствор его соли, то катионы металла будут переходить из раствора на поверхность металла. В этом случае металл приобретает положительный заряд, а раствор из-за избытка анионов соли – отрицательный заряд.
Таким образом, при погружении металла в воду или в раствор соли данного металла на поверхности раздела металлраствор образуется двойной электрический слой, обусловливающий скачок потенциала или разность потенциалов. Эту разность потенциалов принято называть электродным потенциалом ЕМе. Величина электродного потенциала зависит от природы металла, концентрации ионов металла в растворе и от температуры. Эта зависимость выражается формулой Нернста
ЕМе = ЕМе + |
|
ln Ме , |
(2) |
|
где Е Ме – электродный потенциал металла, ЕМе – стандартный электродный потенциал, измеренный при активности раствора, содержащего 1 моль ионов металла в 1 л, R – универсальная газовая постоянная, равная 8,31 Дж/град ∙ моль, Т – температура по абсолютной шкале, n – валентность металла, F
– константа фарадея, равная 96494 Кл, а – активность ионов Ме в растворе.
Для разбавленных растворов активность может быть
2

заменена концентрацией С (моль/л).
Подставив в формулу (2) числовые значения R, Т, F и заменив натуральный логарифм десятичным, получим для 25 °С (298 К):
ЕМе = ЕМе + |
, |
l Ме . |
(3) |
Абсолютное значение электродного потенциала измерить невозможно, поэтому измеряют разность потенциалов между данным электродом и электродом сравнения. В качестве электрода сравнения используют водородный электрод, стандартный потенциал которого условно принимают равным нулю. Располагая металлы в порядке возрастания их стандартных потенциалов, получают электрохимический ряд напряжений металлов.
Ряд напряжений имеет большое значение при изучении процессов электрохимической коррозии. Он позволяет определить, какой металл из двух, находящихся в контакте, будет растворяться, какой не будет. Кроме того, зная положение металла в ряду напряжений, можно правильно сориентироваться при выборе защитных покрытий.
Таблица 1 Значения стандартных электродных потенциалов некоторых
металлов при 25 °С
Электрод |
|
Электродный процесс |
ЕМе |
при 25 °С |
|
1 |
1 |
2 |
2 |
3 |
3 |
Na/Na + |
|
|
|
– 2,71 |
|
Al/Al 3+ |
|
|
|
– 1,66 |
|
Zn/Zn 2+ |
|
|
|
– 0,76 |
|
Fe/Fe 2+ |
|
|
|
– 0,44 |
|
Ni/Ni 2+ |
|
|
|
– 0,25 |
|
Sn/Sn 2+ |
|
|
|
– 0,14 |
|
3
|
Продолжение табл. 1 |
|
Pt(H2)/Н + |
|
0 |
Cu/Cu 2+ |
|
+ 0,34 |
Au/Au+ |
|
+ 1,69 |
1.1.1. Электродвижущие силы
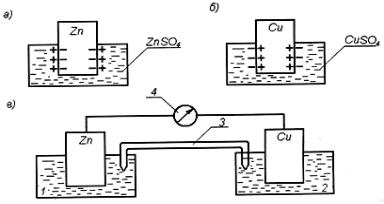
Возьмем два электрода: цинковую пластину, погруженную в раствор ZnSО4 > 4 , и медную – погруженную
враствор СuSO4.
Всоответствии с положением в ряду напряжений цинк обладает большей способностью к растворению и поэтому посылает ионы в раствор, вследствие чего пластина заряжается
отрицательно. Напротив, на медном электроде наблюдается тенденция к осаждению ионов Си 2+ , в результате чего на пластине появляются избыточные положительные заряды
(рис.1).
Рис.1. К механизму возникновения ЭДС:
а – цинковый электрод; б – медный электрод; в – гальванический элемент; 1 и 2 – эдектрохимическиеячейки; 3 –
электролитический ключ; 4 – гальванометр
4
Если эти два электрода соединить металлической проволокой, а ячейки – электролитическим ключом, то образуется гальванический элемент с определенной ЭДС. В такой замкнутой цепи избыточные электроны будут переходить с цинковой пластины на медную и гальванометр покажет наличие электрического тока.
На отрицательном электроде (аноде) будет протекать процесс окисления Zn = Zn2+ + 2е, на положительном электроде (катоде) процесс восстановления 2е + Сu2+ = Сu. Сложение этих процессов дает химическую реакцию Zn + Cu2+ = Zn2+ + Сu, которая и является источником ЭДС данного гальванического элемента. Гальванический элемент можно
ЭДС элемента – величина |
( )− |
ZnSO4CuSO4Cu+( ). |
записать в виде схемы |
|
|
положительная. Она равна разности электродных потенциалов катода и анода. Стандартная величина ЭДС медно-цинкового элемента составляет
0,34 – (– 0,76) = 1,1 В.
1.1.2. Простые и сложные электроды
Электрод, на котором протекают окислительновосстановительные превращения одного и того же вещества, является простым электродом. Устанавливающийся при этом потенциал будет обратимым (равновесным). Он обусловлен протеканием окислительно-восстановительного процесса
|
+ 2 . |
(4) |
В состоянии равновесия при наличии тока обмена на таком электроде сохраняется баланс и по току, и по веществу. Потерь металла нет.
Электрод, на котором протекает несколько окислительно-восстановительных процессов, называется сложным. Если при этом потеря электронов осуществляется одними частицами, а их поглощение – другими, то возникает
5
неравновесный потенциал.
Неравновесные потенциалы могут быть стационарными, если они устанавливаются во времени на постоянном значении, и нестационарными, если их значение во времени не достигает постоянной величины.
Условием образования стационарного потенциала является баланс зарядов. Баланс вещества при этом не сохраняется. Например, при растворении металла в соляной кислоте имеют место две сопряженные реакции:
|
+ 2 . |
(5) |
2 +2Н |
Н . |
(6) |
При определенном значении потенциала сложного электрода устанавливается такое соотношение скоростей процессов анодного окисления и катодного восстановления, при котором
+ |
= |
+ , |
(7) |
то есть сумма скоростей окисления равна сумме скоростей восстановления. При существующем балансе зарядов может быть нарушен баланс вещества, например Me (рис. 2).
При этом > , < . Следовательно происходит электрохимическое растворение металла. Процесс выделения водорода при растворении металла имеет место в кислотах или в водных растворах, не содержащих кислорода.
6

Рис. 2. Схема равновесного (а) и неравновесного (б) потенциалов:
а– баланс вещества и зарядов;
б– баланс зарядов при отсутствии баланса вещества: идет растворение металла
Вприсутствии растворенного кислорода вторым сопряженным окислительно-восстановительным процессом является реакция
О +2Н 0+4е 4ОН . |
(8) |
1.1.3. Коррозионный гальванический элемент
Коррозия металлов и сплавов при их контактировании с растворами электролитов имеет электрохимическую природу. Эта идея впервые была выдвинута в 1830 году Де-ля-Ривом. Электрохимическая концепция коррозии становится общепринятой с начала нынешнего столетия, когда появились экспериментальные подтверждения ее правильности.
Типичным примером электрохимической коррозии металлов является растворение цинка в серной кислоте:
Zn + H2SО4 = ZnSO4 + Н2. |
(9) |
Характерной особенностью в данном случае является влияние примесей на ход процесса: они сильно ускоряют
7

растворение металла. Так, добавка к цинку 10 % олова увеличивает скорость растворения в 9 раз, а добавка 10 % меди – в 54 раза. Это явление возрастания скорости коррозии в зависимости от содержания примесей привело к построению модели коррозионного гальванического элемента.
Рассмотрим коррозионный гальванический элемент, состоящий из двух разнородных металлов – меди и цинка, погруженных в раствор поваренной соли. По истечении определенного времени на каждом из металлов возникает
стационарный |
потенциал, |
который |
будет |
определяться |
||||
на цинке |
е |
О |
|
|
+2, |
|
|
, |
сопряженными реакциями: |
4 |
|
|
+2 |
|
|||
|
4 + |
|
+2 |
|
|
|||
на меди 4е+ О +2Н О 4ОН .
Для определения величины этих потенциалов подведем
ккаждому металлу электрод сравнения, относительно которого с помощью потенциометра или высокоомного вольтметра будем измерять потенциалы цинка и меди (рис. 3).
Рис. 3. Электрохимическая модель коррозионного элемента: А – анод Zn, К – катод Сu, Еа и Ек – потенциалы анода и катода, R – сопротивление; mА – миллиамперметр
8
