
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
Лекция № 7 химическая кинетика и химическое равновесие
Ранее мы рассмотрели термодинамический метод изучения химических процессов, позволяющий осуществлять расчет химического равновесия и устанавливать направление возможного протекания процессов в тех или иных условиях. Основу термодинамического метода составляет величина DG = 0 .
Однако, знание величины DG не позволяет сделать никаких заключений о скорости реакции в определенных условиях. Процессы, протекающие в искомых системах зависят не только от термодинамических закономерностей, но и от кинетических закономерностей.
Химическая кинетика – раздел химии, который изучает скорость и механизм химических превращений.
Знание кинетики и механизма протекания реакций позволяет управлять химическим процессом, проводить их математическое моделирование в условиях производства.
Реакции
гомогенные
гетерогенные

(протекают в однородной (протекают в неоднородной
среде, т.е. между веществами, среде – между веществами,
которые находятся в одной фазе) которые находятся в разных
фазах)
2NO(г) + O2(г) = 2NO2(г) CaO(т) + 2HCl(ж) = CaCl2(ж) + H2O(ж )
Условия протекания
проходят равномерно проходят на границе
во всем объеме раздела фаз

Фаза – однородная часть системы, обладающая одинаковым составом, физическими и химическими свойствами и отделенная от других частей системы поверхностью раздела.
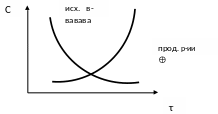
Скорость химической реакции – изменение количества реагирующих веществ за единицу времени в единице реакционного пространства.



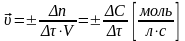
(для гомогенной реакции)
(единица реакционного пространства – единица объема (V)
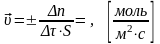
(для гетерогенной р-и)
(единица реакционного пространства – единица площади межфазной поверхности (S) .
Δn – изменение числа молей реагента по времени;
S – площадь поверхности раздела между фазами.
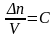
(С – молярная концентрация)
В ходе реакции изменяется концентрация как исходных веществ, так и продуктов реакции, причем они взаимосвязаны (уравнением химической реакции), поэтому в зависимости от того, о чем идет речь, берутся разные знаки:
 –
речь идет об убыли ¯
концентрации исходных веществ;
–
речь идет об убыли ¯
концентрации исходных веществ;
Å – об увеличении концентрации продуктов реакции.
Факторы, влияющие на скорость реакции
природа реагирующих веществ;
концентрация реагирующих веществ;
внешние условия (Т , Р) ;
присутствие катализатора (ускоритель) или ингибитора (замедлитель).
Зависимость скорости реакции от концентрации реагирующих веществ
Эта зависимость от концентрации реагирующих веществ определяется законом действующих масс (закон действия масс) – 3 ДМ.
Действующими массами в XIX веке называли молярные концентрации.
Сущность закона действия масс (закона действующих масс) – скорость химической реакции пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам, в уравнении реакции.
аА + вВ = сС + dD
υ = k · СаА · СвВ ,
где СА и СВ – концентрации реагирующих веществ;
а и в – стехиометрические коэффициенты.
k – коэффициент пропорциональности, который называется константой скорости реакции.
Физический смысл k легко понять, если принять, что СА = СВ = 1 моль/л , то υ = k . То есть, k численно равен скорости реакции, при концентрации реагирующих веществ, равной единице.
2СО + О2 = 2СО2
υ = k · С2СО · СО2
