
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.1. ВЫДЕЛЕНИЕ И АНАЛИЗ ПЛАЗМИДНОЙ ДНК ИЗ БАКТЕРИАЛЬНЫХ КЛЕТОК
Абсолютная воспроизводимость условий инкубации и размножения. Охлаждаемый термостат КВ53«Binder» (Германия)
Программируемая (от 0 до 100 %) принудительная конвекция (вентиля-
тор).
Рис. 1.6. Термостат КВ53 фирмы «Binder» (Германия)
Вытяжное устройство с заслонкой для сушки.
Вспененная изоляция, не содержащая хлорфторуглеродов. Внутренняя стеклянная дверь, две полки с возможностью установки че-
тырех.
Многофункциональный таймер от 0 до 99 ч 59 мин. Размеры камеры Ш x В x Г см: 40 x 40 x 33, объем 53 л. Габариты Ш x В x Г см: 64 x 84 x 58, масса 72 кг. Мощность 460 Вт.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 1.1.1. Выделение плазмидной ДНК
Порядок выполнения работы
1. Культуру E. coli, содержащую рекомбинантную плазмиду pUC18, центрифугировать в 2 мл пробирках при 8 об/мин 2 мин. Культуральную среду вылить, осадок осушить.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
22 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.1. ВЫДЕЛЕНИЕ И АНАЛИЗ ПЛАЗМИДНОЙ ДНК ИЗ БАКТЕРИАЛЬНЫХ КЛЕТОК
2.Ресуспендировать осадок в 100 мкл раствора 1 (25 mM Tris-HCl pH 8.0, 10 mM EDTA, 50 mM глюкозы, РНКаза А) с лизоцимом (на кончике шпателя на 10 мл), инкубировать 5 мин при комнатной температуре.
3.Добавить 200 мкл раствора 2 (0,2 M NaOH, 1 10 % SDS). Инкубировать
смягким перемешиванием с перевертыванием пробирки до полной прозрачности, но не более 5 мин.
4.Добавить 200 мкл 3 M NaOAc pH 4,75, смешать переворачиванием и инкубировать 5 мин, периодически помешивая.
5.Центрифугировать на максимальных оборотах 10 мин (~16 тыс.
об/мин).
6. Супернатант осторожно, не разрушая осадок, прилить к 1 мл этан о- ла, перемешать и центрифугировать 2 мин на максимальных оборотах.
7.Осадок промыть 1 мл 70 % -го этанола перемешиванием на вортексе, затем центрифугировать 2 мин на максимальных оборотах.
8.Супернатант удалить, осадок подсушить на воздухе 10 мин и раство-
рить в 80 мкл ТЕ (10 mM Tris-HCl pH 8,0, 1 mM EDTA).
Задание 1.1.2. Анализ полученных препаратов плазмидных ДНК с помощьюэлектрофореза вагарозном геле
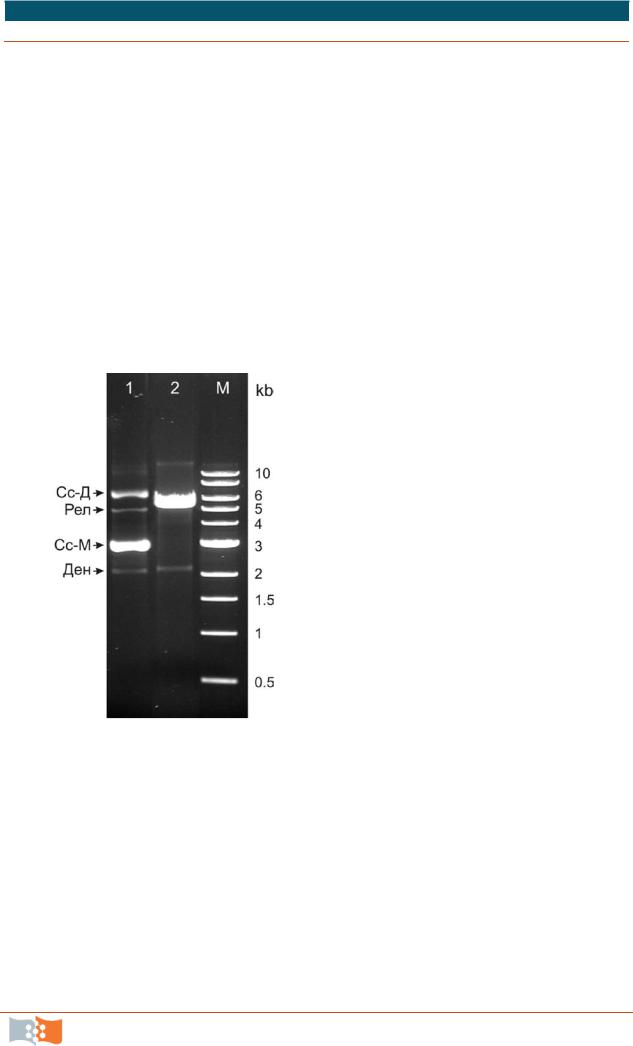
Для оценки количества и качества ДНК, а также размеров молекул ДНК используют электрофорез в гелях агарозы (горизонтальный) или полиакриламидных гелях (вертикальный электрофорез). Молекулы ДНК визуализируются интеркалирующими флуоресцентными красителями, например бромистым этидием. Двуцепочечная ДНК эффективно связывает бромистый этидий и начинает ярко флуоресцировать при облучении ультрафиолетом (УФ). Результаты электрофореза документируют в проходящем УФ-свете с помощью цифровой фотокамеры или специальной системы для документирования гелей.
Плазмидная интактная ДНК из клетки выделяется обычно в нескольких формах, которые разделяются в процессе электрофореза (рис. 1.7). В хоро-
шем препарате ДНК доминируют суперскрученная мономерная и димерная
формы (суперспиральная плазмида), при некотором повреждении ДНК появляется релаксированная форма (расплетенное кольцо, к чему проводит наличие разрыва в одной из цепей), редко бывает линейная форма, образующаяся при двуцепочечных разрывах плазмидного кольца. В препарате
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
23 |
РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.1. ВЫДЕЛЕНИЕ И АНАЛИЗ ПЛАЗМИДНОЙ ДНК ИЗ БАКТЕРИАЛЬНЫХ КЛЕТОК
плазмидной ДНК возможна небольшая примесь денатурированной ДНК, а также фракция РНК. Денатурированная форма образуется при необратимых сдвигах цепей плазмидного кольца относительно друг друга в процессе денатурации. Рестриктазы не опознают сайты на такой ДНК с нарушенной двуцепочечной структурой и, соответственно, не расщепляют данную фракцию ДНК (рис. 1.7). Подвижность полос с формами кольцевой плазмиды зависит от условий электрофореза и концентрации бромистого этидия, так как внедрение интеркалирующих красителей расплетает ДНК, изменяя ее конформацию. Суммарное количество плазмидной ДНК во внесенной в гель пробе оценивают путем сопоставления интенсивности свечения полос со стандартной ДНК маркеров.
Рис. 1.7. Пример электрофореза в 1 %- м геле агарозы, окрашивание бромистым этидием: 1 – интектная плазмида; 2 – линейная плазмида после расщепления уникальной рестриктазой (один сайт на молекулу); 3 – маркеры молекулярного веса, длины в тысячах нуклеотидных пар. Формы интактной плазмиды: Ден – денатурированная, Сс-М – суперскрученная мономерная, Сс-Д – суперскрученная димерная, Рел – релаксированная, линейная форма в данном препарате
Порядок выполнения работы
1. Приготовить буфер ТАЕ (40 мМ Трис-ацетат, 2 мМ ЭДТА, рН 8,0) для электрофореза разведением стокового раствора ТАЕх50.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
24 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.1. ВЫДЕЛЕНИЕ И АНАЛИЗ ПЛАЗМИДНОЙ ДНК ИЗ БАКТЕРИАЛЬНЫХ КЛЕТОК
2.Приготовить 1 %-й гель агарозы на ТАЕ-буфере путем расплавления навески агарозы в микроволновой печи. После остывания до умеренно горячего состояния добавить бромистый этидий до 0.25 мкг/мл и залить гель в форму.
3.Нанести 1 и 2 мкл полученного препарата рядом с 1 мкл маркерной ДНК в лунки приготовленного 1 %-го геля агарозы. Образцы перед нанесением смешивают с 1 мкл буфера для нанесения и электрофорезным буфером так, чтобы наносимый объем составил 10-15 мкл, для равномерного распределения ДНК по толщине геля.
4.Провести электрофорез в течение 30 мин при напряжении 100 В.
5.С помощью системы видеодокументации получить фотографию геля
впроходящем УФ-свете при длине волны 260 нм.
6.Идентифицировать полосы плазмидной ДНК в препарате. Оценить суммарное количество плазмидной ДНК во внесенной в гель пробе путем сопоставления интенсивности свечения полос полученного препарата с интенсивностью свечения стандартной ДНК. После этого пересчитать количество полученной ДНК на общий объем препарата.
7.Записать вывод о качестве и количестве полученного препарата плазмидной ДНК.
Задание 1.2.3.Рестрикционный анализ полученногопрепарата плазмидный ДНК
Рестриктазы или, более корректно, рестрикционные эндонуклеазы являются важнейшими инструментами создания рекомбинантных ДНК и физического картирования ДНК-молекул. Рестриктазы расщепляют двухцепочечную ДНК внутри молекулы. При этом каждая рестриктаза узнаёт определённый участок ДНК длиной от четырёх пар нуклеотидов (сайт узнавания) и расщепляет нуклеотидную цепь внутри участка узнавания или вне его (сайт расщепления). Наиболее широкое применение в генной инженерии нашли высокоспецифичные рестриктазы, узнающие палиндромные последовательности ДНК и расщепляющие ДНК-молекулу внутри сайта узнавания. При этом могут образовываться концы цепей трех структурных типов. Если разрыв происходит посередине сайта рестрикции, то образуются фрагменты с полностью спаренными («тупыми») концами. Когда расщепление ДНК происхо-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
25 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.1. ВЫДЕЛЕНИЕ И АНАЛИЗ ПЛАЗМИДНОЙ ДНК ИЗ БАКТЕРИАЛЬНЫХ КЛЕТОК
дит в стороне от середины сайта, образуются выступающие однонитевые концы, получившие название «липких», т.е. способных «слипаться» с комплементарным концом, образующимся в противоположной цепи в результате ее разрыва. Число нуклеотидов в однонитевом концевом участке может варьировать от одного до пяти.
Молекулы ДНК из разных источников, обработанные одной и той же высокоспецифичной рестриктазой, расщепляющей палиндромные последовательности, будут иметь одинаковые гибридизующиеся между собой липкие концы. Наличие таких липких концов у фрагментов ДНК существенно облегчает их ковалентное сшивание специальным ферментом ДНК-лигазой (лигирование) в рекомбинантную молекулу.
Поскольку рестриктазы узнают специфические последовательности в молекуле ДНК, становится возможным физически определить месторасположение таких последовательностей, обрабатывая ДНК соответствующими рестриктазами. Физическую карту молекулы ДНК по рестрикционным сайтам можно составить, анализируя длины фрагментов ДНК после расщепления различными рестриктазами.
Порядок выполнения работы
1.На основании физической карты плазмиды выбрать три рестриктазы для проведения расщепления полученного прерарата плазмидной ДНК в двух вариантах реакции гидролиза двумя рестриктазами одновременно.
2.Для каждого из вариантов из каталога фирмы-поставщика («Сибэнзим») выбрать состав реакционный смеси, в которой одновременно активны обе из используемых рестриктаз.
3.По данным определения содержания ДНК в по лученном препарате выбрать объемы пробы для рестрикционного анализа. Определить необходимое количество единиц активности рестриктазы для полного гидролиза полученного препарата за 30 мин, и, в соответствии с этим, добавляемый объем фермента. Записать состав реакционной смеси.
4.Собрать реакции в двух вариантах и инкубировать 30 мин при оптимальной температуре расщепления для конкретных ферментов. В качестве отрицательного контроля ставится проба ДНК без добавления ферментов – всего 3 микропробирки.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
26 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.1. ВЫДЕЛЕНИЕ И АНАЛИЗ ПЛАЗМИДНОЙ ДНК ИЗ БАКТЕРИАЛЬНЫХ КЛЕТОК
5.Провести электрофорез гидролизованных образцов в 1 %-м геле агарозы вместе с маркерными ДНК.
6.Оценить полноту расщепления пробы и размер полученных рестрикционных фрагментов. Сопоставить полученный размер с ожидаемым согласно физической карте плазмиды. Записать выводы.
 Контрольные вопросы
Контрольные вопросы
1.Что представляют собой плазмиды?
2.На чем основаны методы разделения хромосомной и плазмидной ДНК в клетке?
3.Опишите принцип щелочного метода выделения плазмидной ДНК.
4.На чем основано разделение макромолекул ДНК при агарозном гель-электрофорезе?
5.Как можно определить размер молекул ДНК?
6.Какие формы плазмидной ДНК можно увидеть после электрофореза полученного препарата в агарозном геле?
7.Каково происхождение рестрикционных эндонуклеаз (рестриктаз)?
8.Значение открытия рестриктаз для развития методов клонирования
ифизического картирования ДНК.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
27 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА1.2. ВВЕДЕНИЕЧУЖЕРОДНОЙДНКВКЛЕТКИДРОЖЖЕЙИБАКТЕРИЙ
 Цель лабораторной работы
Цель лабораторной работы
•дать представление о различных методах введения чужеродной ДНК в клетки-мишени;
•приобрести экспериментальные навыки по созданию генетиче- ски-модифицированных организмов на примере клеток E. сoli и дрожжей.
 Задачи лабораторной работы
Задачи лабораторной работы
•провести эксперимент по трансформации клеток E. сoli и дрожжей различными векторами (рекомбинантным челночным вектором pPZA двумя различными способами – химической трансформацией и электропорацией;
•продемонстрировать связи ДНК →РНК→белок→свойство организма; XL1-Blue плазмидой pGLO.
 Краткие теоретические сведения
Краткие теоретические сведения
Трансформацияприменительно к доставке чужеродной ДНК в клетку в самом общем смысле обозначает процесс введения свободной ДНК в клетку.
В более узком значении, как метод доставки ДНК, этот термин приме-
няется в основном по отношению к бактериям, для обозначения процесса поглощения рекомбинантной ДНК компетентными клетками, индуцированного температурным фазовым переходом клеточной мембраны.
E. coli является самым распространенным организмом при работе с рекомбинантными ДНК, и, чтобы обеспечить внедрение в клетки плазмидной ДНК, клетки выдерживают с ледяным раствором СаС12 и ДНК, а затем подвергают тепловому шоку при 42 °С в течение ~1 мин. По-видимому, в результате такой обработки происходит локальное разрушение клеточной стенки. Эффективность трансформации, которая определяется как число трансформантов на 1 мкг добавленной ДНК, при этом составляет примерно 10 5-107. Эффективность этого метода невысока, приблизительно менее 0,1% клеток оказываются трансформированными, но этот недостаток компенсируется
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
28 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.2. ВВЕДЕНИЕ ЧУЖЕРОДНОЙ ДНК В КЛЕТКИ ДРОЖЖЕЙ И БАКТЕРИЙ
применением схем отбора, позволяющих быстро идентифицировать нужные клоны.
Клетки, способные поглощать чужеродную ДНК, называются компетентными. Доля компетентных клеток в популяции обычно очень мала, но ее можно повысить, используя специальную питательную среду, условия культивирования и химические индукторы компетентности (подобранные, как правило, эмпирически). Часто этапом подготовки компетентных клеток идет получение сферопластов – клеток, частично или полностью (протопласты) лишенных наружной ригидной клеточной стенки. Например, только таким способом была осуществлена эффективная трансформация многих грамположительных бактерий родов Bacillus, Listeria, Streptommyces и др. Некоторые методики трансформации дрожжей также включают стадии ферментативного удаления оболочки дрожжевой клетки с помощью глюкозидаз. Для организмов, устойчивых к химическим индукторам компетентности или не обладающих природной компетентностью, применяются другие системы доставки ДНК.
Одним из популярных методов введения нуклеиновых кислот в клетки-
мишени является электоропорация – временное создание пор в бислойной липидной мембране под кратким воздействием электрического поля. Это универсальный физический метод трансформации, методика которого разработана практически для всех типов клеток. Для многих типов клеток это единственный способ высокоэффективной трансформации.
При работе с E. coli подготовленную клеточную суспензию (~50 мкл) и ДНК помещают между электродами и подают единичный импульс тока длительностью ~4,5 мс при напряжении 1,8 кВ, расстояние между электродами 1 мм. После такой обработки эффективность трансформации повышается до 109–1011 для малых плазмид (~3–6 тпн) и до 106 для больших (~135 тпн). Аналогичные условия используют для введения в Е. coli вектора ВАС. Электропорирующий эффект высоковольтного разряда на бислойную липидную мембрану, по-видимому, зависит от радиуса ее кривизны. Поэтому мелкие бактериальные клетки эффективно поглощают ДНК при значительно большей напряженности (12–18 кВ/см), чем крупные животные и растительные клетки, эффективно поглощающие ДНК при напряженности поля 1-2 кВ/см. Электропорация – наиболее простой, эффективный и воспроизводимый метод введения молекул ДНК в клетки, требующий, однако, специального прибора электропоратора.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
29 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.2. ВВЕДЕНИЕ ЧУЖЕРОДНОЙ ДНК В КЛЕТКИ ДРОЖЖЕЙ И БАКТЕРИЙ
 Материалы и оборудование
Материалы и оборудование
1.Термостатируемый шейкер-инкубатор Exella E-24, «New Brunswick» (СА) для выращивания клеточных культур .
2.Бокс-ламинар БАВнп-01-»Ламинар-С»-1,2 производства «Ламинарные системы» (Россия) , I класс защиты.
3.Микроцентрифуга для пробирок «Eppendorf» 5417R (США) c ротором для микропробирок 1,5-2 мл.
4.Лабораторный шейкер-вортекс «Вортекс V-1» фирмы «BioSan».
5.Термостат модель КВ53, «Binder» (Германия).
6.Универсальный электропоратор «GenePulser Xсell» фирмы «BioRad» (США) с одноразовыми кюветами для электропорации.
7.Водяная баня-термостат WB-4MS фирмы «BioSan».
8.Замороженные химически компетентные клетки E. coli XL1-Blue.
9.Химически компетентные клетки метилотрофных дрожжей Pichia pastoris.
10.Электрокомпетентные клетки дрожжей Pichia pastoris.
11.Раствор плазмидной рекомбинантной ДНК челночного экспрессионного вектора pPZA с блеомициновой устойчивостью, несущего вставку чужеродного гена.
12.Реагенты для химической трансформации дрожжей Pichia pastoris c LiCl.
13.Агар на LB среде.
14.Антибиотик блеомицин 100 мг/мл.
15.Чашки Петри.
16.Стерильная одноразовая пластиковая посуда (наконечники, микропробирки), шпатели для растирания культур.
17.Пластиковые пробирки Eppendorf.
18.Контейнер со льдом, водяная баня (42 °С), термостат (37 °С).
 Характеристики оборудования
Характеристики оборудования
 Бокс-ламинар
Бокс-ламинар
Бокс-ламинар «БАВнп-01-»Ламинар-С»-1,2» (рис. 1.8) производства «Ламинарные системы» (Россия), I класс защиты предназначен для создания беспылевой абактериальной воздушной среды. Используется при работе с препаратами и бактериальными культурами, не представляющими угрозы
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
30 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.2. ВВЕДЕНИЕ ЧУЖЕРОДНОЙ ДНК В КЛЕТКИ ДРОЖЖЕЙ И БАКТЕРИЙ
для здоровья оператора, когда необходима защита рабочего материала от окружающей среды или работа с объектом требует стерильной рабочей зоны.
Технические характеристики:
Габариты рабочей камеры ламинарного бокса (ШхГхВ) 1105х620х670 мм, внешние габариты 1170х685х1115 мм, вес 145 кг.
Две встроенные розетки.
Плоская несъемная столешница из полированной нержавеющей стали. Шильд-панель с ЖК-экраном, индицирующим включение систем изде-
лия.
Таймер работы УФО рабочей камеры, счетчик наработки УФО, часы, технологический таймер.
Двухступенчатая система фильтрации (классы фильтров G4 (предварительная очистка), НЕРА Н14), класс чистоты воздуха рабочей зоны ламинарного бокса по ГОСТ Р ИСО 14644-1-2002 (по частицам 0,5 мкм) 5ИСО.
Система автоматического поддержания потока воздуха со скорость воздушного потока 0,45 ± 10 % м/с.
Производительность ламинарного бокса 800 м3/ч. Освещенность рабочей зоны ламинарного бокса 1000 Лк.
Рис. 1.8. Внешний вид ламинара «БАВнп-01-»Ламинар-С»-1,2» производства «Ламинарные системы» (Россия), I класс защиты
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
31 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.2. ВВЕДЕНИЕ ЧУЖЕРОДНОЙ ДНК В КЛЕТКИ ДРОЖЖЕЙ И БАКТЕРИЙ
 Универсальныйэлектропоратор
Универсальныйэлектропоратор
Универсальный электропоратор «GenePulser Xсell Total System» фирмы «Bio-Rad» с одноразовыми кюветами для электропорации (рис. 1.9) является эффективной альтернативой другим способам доставки экзогенных молекул
вклетку-хозяина. Универсальная система электропорации «GenePulser Xсell Total System» фирмы «Bio-Rad» с электропорационной ячейкой предназначена для эффективного внедрения нуклеиновых кислот, белков, углеводов, красителей, вирусных частиц и других молекул как в прокариотические, так и
вэукариотические клетки. Здесь электропорация осуществляется либо экспоненциальным, либо квадратно–волновым пульсом для подбора максимальной трансформационной эффективности. Система включает три модуля (главный, CE модуль для эукариот и РС–модуль для прокариот) и электропорационную ячейку «Shockpod». В комплекте – ряд предустановленных оптимизированных протоколов для большинства широко используемых типов клеток.
Установленные протоколы разработаны с возможностью их оптимизации и создания новых протоколов для повышения эффективности трансфекции и увеличения жизнеспособности любых типов клеток.
Рис. 1.9. Внешний вид универсального электропоратора «GenePulser Xсell Total System»фирмы «Bio-Rad» с электропорационной ячейкой «Shockpod»
Технические характеристики:
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
32 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.2. ВВЕДЕНИЕ ЧУЖЕРОДНОЙ ДНК В КЛЕТКИ ДРОЖЖЕЙ И БАКТЕРИЙ
Электропорация проводится в одноразовых кюветах 0,1 мм, 0,2мм и
0.4 мм.
Форма пульсовой волны экпоненциальная или квадратная, с изменяемым напряжением 10-3000 В.
Электрическая емкость в диапазоне 10-500 В – 25-3275 мкФ с 25 мкФ инкрементом, в диапазоне 500-3000 В – 10, 25 и 50 мкФ.
Длительность квадратно-волнового пульса: в диапазоне 10–500 В – продолжительность 0,05-10 мс с 0,05 миллисекундовым инкрементом, продолжительность 10-100 мс с 1 ммиллисекундовым инкрементом, 1–10 пульсов с 0,1-10 с интервалом. В диапазоне 500-3000 В – продолжительность 0,05–5 мс с 0,05 миллисекундовым инкрементом, 1-2 пульса с интервалом минимум 5 с.
Сопротивление образца – 20 Ω минимум при 10-2500 В, 600 Ω мини-
мум при 2500-3000 В.
Удобный цифровой интерфейс с интуитивно программируемым контролем всех параметров. Встроенные оптимизированные протоколы и создаваемые заново модифицируемые протоколы для специфических задач для получения лучшей доставки молекул в клетки.
Хранение и вызов параметров пульса для последних 100 эксперимен-
тов.
 Водянаябаня-термостат
Водянаябаня-термостат
Водяная баня-термостат WB-4MS фирмы «BioSan» (рис. 1.10) предназначена для проведения химических, фармацевтических, медицинских и биологических исследований. Модель WB-4MS обеспечивает повышенную стабилизацию температуры (до 0,1 °С) за счет работы встроенной магнитной мешалки.
Технические характеристики:
Диапазон регулировки температуры 25–100 °C с 0,1 °C точностью, цифровая установка, ЖК-дисплей.
Регулировка оборотов магнитной мешалки в диапазоне 300-1000 об/мин.
Емкость ванны из нержавеющей стали 4 л, габариты 350x175x250 мм, вес не более 3,6 кг.
Потребляемая мощность не более 600 Вт.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
33 |

РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
РАБОТА 1.2. ВВЕДЕНИЕ ЧУЖЕРОДНОЙ ДНК В КЛЕТКИ ДРОЖЖЕЙ И БАКТЕРИЙ
Рис. 1.10. Водяная баня-термостат WB-4MS фирмы «BioSan»
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 1.2.1.Химическая трансформацияклетокE. сoli
Порядок выполнения работы:
1.Подписать две пластиковые пробирки: +ДНК и –ДНК.
2.В ламинарном боксе стерильно отобрать по 50 мкл суспензии компетентных клеток в трансформационном буфере в каждую пробирку. Поместить пробирки в ледяную баню.
3.В пробирку +ДНК внести 1 мкл раствора плазмидной ДНК. В проби р- ку –ДНК внести такое же количество буфера без ДНК. Выдержать обе смеси на льду 20 мин.
4.Расплавить агар в микроволновой печи и залить чашки с антибиотиком и без него. Конечная концентрация блеомицина для клеток E. сoli 25 мкг/мл, для дрожжевых клеток 100 мкг/мл.
5.Высушить залитые агаром чашки под UV-облучением в ламинарном
боксе.
6.Провести процедуру теплового шока. Для этого обе пробирки поместить в водяную баню (42 оС) на 25 с (строго!), после чего быстро перенести их опять на лед. Выдержать 2-3 мин.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
34 |
