
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
 Цель раздела
Цель раздела
•теоретическое и практическое освоение основных методов регистрации флуоресценции хлорофилла, получение знаний об информативности стационарных и кинетических параметров индукционных кривых флуоресценции, позволяющих получить адекватную информацию о состоянии фотосинтетического аппарата у растительного объекта.
 Задачи раздела
Задачи раздела
•освоение методов регистрации флуоресценции хлорофилла у растений и оценка определяемых на основе флуоресценции се- лекционно-значимых физиологических характеристик.
 Краткие теоретические сведения. Теоретические основы флуоресцентных методов
Краткие теоретические сведения. Теоретические основы флуоресцентных методов
Флуоресценции хлорофилла позволяет оценивать потенциальную продуктивность и структурную организацию фотосинтетического аппарата; выявлять способность к фотоавтотрофному росту у культуры тканей высших растений, культур микроводорослей и цианобактерий; проводить раннюю диагностику и контроль вирусной инфекции в листьях; оценивать устойчивость растений к высоким и низким температурам, ультрафиолетовому излучению, выявлять мутантные формы с нарушениями синтеза хлорофиллбелковых комплексов, а также формы, устойчивые к гербицидам.
Главные достоинства флуоресцентного метода – возможность работы с интактными объектами, оперативность и относительная простота.
Выполнение данного раздела требует знаний основ спектрального и люминесцентного анализа (из курсов «Физика», «Физико-химические методы в биологии); структурной и функциональной организации фотосинтетического аппарата растений и цианобактерий (из курса «Физиология растений»), владения методами выращивания одноклеточных водорослей и высших растений, включая культуру изолированных клеток и тканей.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
387 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
Флуоресценция хлорофилла является разновидностью люминесценции с хорошо выраженным максимумом при 684-686 нм, затухающей в течение τ 10-8-10-9 сек. В условиях монохроматическом возбуждающего света интенсивность флуоресценции (If) линейно зависит от квантового выхода (ϕ) и числа поглощенных квантов:
|
ϕ× |
× . |
(8.1) |
В области низких концентраций справедливо выражение: |
|
||
|
|
× |
(8.2) |
где К – удельный выход флуоресценции, С– концентрация хлорофилла. |
|
||
У зеленых растений флуоресцируют молекулы хлорофилла а в составе светособирающего хлорофилл а/хлорофилл б белкового комплекса (ССК2) и антенного комплекса ФС2 (ХБК2), у цианобактерий – хлорофилл а в составе фотосистемы 2 и фикобилиновый пигментный комплекс.
Состояние реакционного центра ФС2 играет ключевую роль в регуляции выхода флуоресценции хлорофилла а. В условиях, когда фотохимические процессы оказываются единственными регуляторами флуоресценции, ее интенсивность ограничена минимальным (Ф0) и максимальным (Фм) уровнями. Переменная составляющая (Фм-Ф0) или вариабельная (Фв) флуоресценция, отнесенная к максимальному уровню (Фв/Фм), характеризует эффективность захвата энергии возбуждения в реакционном центре ФС2 или квантовый выход фотохимической реакции восстановления первичного акцептолра ФС2 – Qa.
Наиболее информативными являются методы, основанные на регистрации светоиндуцированных изменений (переходов) флуоресценции. Кинетику переходов определяют такие процессы, как изменение окислительновосстановительного состояния пула первичных акцепторов ФС2 – Qa (фотохимический компонент) и образование трансмембранного электрохимического потенциала ионов водорода (энергетический компонент). Выделение фотохимического и энергетического компонентов тушения флуоресценции (рис. 8.1) и их количественная оценка осуществляется на основе специальных методических приемов.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
388 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
Рис. 8.1. Компоненты тушения флуоресценции хлорофилла а и их количественная оценка на основе ингибиторного анализа (А) и РАМ флуориметра (Б)
В суспензиях фотосинтезирующих клеток можно использовать ингибиторы транспорта электронов диурон, моноурон, симазин в концентрации 10-5 М. Для любых растительных объектов эта Задание решается с помощью специализированных PAM (Pulse-Amplitude-Modulated) флуориметров, регистрирующее устройство которых воспринимает флуоресценцию хлорофилла от модулированного синего возбуждающего света предельно низкой интенсивности (менее 0,1 Вт/м2). Дополнительный мощный импульс света ( 1с), действующий самостоятельно или в сочетании с фотосинтетически активным светом различной интенсивности, вызывают изменение модулированной флуоресценции через состояние первичного акцептора Qa и транесмембранный градиент протонов. Собственная флуоресценция от насыщающего импульса и от актиничного света не регистрируются.
В последние годы успешно применяется имидж-система, позволяющая визуализировать фотохимическую и энергетическую компоненты тушения, одновременно у большого числа объектов. На основе имидж-систем проводят диагностику растений табака при заражении вирусом табачной мозаики, выявляют мутанты, лишенные защиты от высокой интенсивности света, и мутанты с нарушенным реакционным центром ФС1.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
389 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
 Характеристики оборудования
Характеристики оборудования
 ФлуориметрJUNIOR-PAM
ФлуориметрJUNIOR-PAM
Технические характеристики
Компактный флуориметр
JUNIOR-PAM (WALZ, Германия) (рис. 8.2), работающий в комплексе с Windows PC, предназначен для обучения методам флуоресцентного анализа функциональной активности фотосинтетического аппарата в листьях высших растений. Он позволяет наблюдать за изменением параметров индукционной кривой флуоресценции и световой кривой фотосинтетического транспорта электронов в режиме реального времени, изменять условия возбуждения и регистрации флуоресценции.
Рис. 8.2. Флуоресцентный блок флуориметра JUNIOR-PAM: 1 – блок управления возбуждения и регистрации флуоресценции; 2 – зажим для листа; 3 – световод
 ФлуориметрPHYTO-PAM
ФлуориметрPHYTO-PAM
Технические характеристики
Чувствительный флуориметр PHYTO-PAM (WALZ, Германия) (рис. 8.3) предназначен для определения концентрации хлорофилла (от 0,1 мкг/л) и фотосинтетической активности у клеток водорослей и цианобактерий в культуре, в составе фитопланктона и фитоперифитона без отделения от субстрата, талломах лишайника. Фотосинтетическая активность определяется как при заданной интенсивности возбуждающего света, так и в режиме регистрации световой фотосинтеза. Четыре спектральные области модулированного возбуждающего света (470, 520, 645 и 665 нм) после соответствующей калибровки прибора по культурам водорослей и цианобактерий или по пробам фитопланктона в период массового развития представителей одной таксономической группы позволяют дифференцировать концентрацию хлорофилла и фотосинтетическую активность между зелеными (эвгленовыми), диатомовыми (динофитовыми) и синезелеными водорослями. Два кюветных блока (PHYTO-ED) с различной чувствительностью предназначены для работы с
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
390 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
суспензиями, дополнительный третий блок (PHYTO-EDF) – для исследования фитоперифитона, пленок, талломов и т. п.
Рис. 8.3. Флуориметр PHYTO-PAM: 1 – блок управления возбуждающим светом и регистрацией флуоресценции; 2 – персональный компьютер; 3 – измерительная ячейка PHYTO-ED для исследования суспензий; 4 – измерительная ячейка PHYTO-EDF для изучения поверхностей
Управление работой флуориметра PHYTO-PAM и обработка сигнала флуоресценция производится автоматическая на основе специализированного программного продукта, PhytoWin Software установленного на Windows PC. PhytoWin software дает возможность работать в семи различных окнах для калибровки прибора, контроля за выполнением программы и последующей обработки данных.
ФлуориметрIMAGING-PAM
Флуориметр IMAGING-PAM M-Series (WALZ, Германия) (рис. 8.4)– мо-
дульная установка для визуализации параметров флуоресценции (F0 и Fm), квантового выхода ФС2 (YII), фотохимического и нефотохимического компонент тушения флуоресценции на всей площади изучаемого объекта, а также
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
391 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
регистрации светоиндуцированных изменений флуоресценции и световой кривой фотосинтеза в установленных оператором зонах.
Рис. 8.4. Флуориметр IMAGING-PAM M-Series: 1 – блок управления возбуждающим светом и регистрацией флуоресценции; 2 – персональный компьютер; 3 – MAXI модуль для исследования целых листьев; 3 – MINI модуль для изучения тканей растений
MAXI модуль снабжен объективом с переменным фокусным рассточнием, что позволяет исследовать поверхность площадью от 10×13 см до 13×22 мм, на которой могут размещаться целые листья, планшеты с культурами водорослей, чашки с каллусными культурами, лишайники, субстрат, заселенный микроводорослями.
MINI модуль аналогичен MAXI модулю, с той лишь разницей, что позволяет исследовать флуоресценции на площади 3.5×4.5 мм с разрешением, 640×480 точек на дюйм. Таким образом достигается тканевой уровень визуализации параметров флуоресценции.
В MINI и MAXI модулях для возбуждения флуоресценции используется модулированный синий (460 нм) свет и актиничный свет интенсивностью до 2000 мкмоль фотонов×м−2×с−1.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
392 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
 Культиваторводорослей
Культиваторводорослей
Технические характеристики |
|
Культиватор водорослей КВМ- |
|
05 (СФУ, Красноярск) (рис. 8.5) пред- |
|
назначен для проведения экспери- |
|
ментов с культурами водорослей и |
|
цианобактерий в условиях постоян- |
|
ной температуры, освещения и газо- |
|
обмена. |
|
Количество сосудов (объем 10 |
|
мл) 24; стабилизация температура от |
|
температуры окружающей среды до |
|
40 °С, точность установки ±2 °С; ис- |
Рис. 8.5. Общий вид культиватора |
точник постоянного белого света |
КВМ-05 |
лампа накаливания 25 – 40 Вт, интен- |
|
сивность света 20 – 60 Вт/м2; ско- |
|
рость вращения 40-60 об/мин. |
|
Планктофлуориметр
Технические характеристики
Планктофлуориметр ПФЛ 3004 СИД (ФГАОУ ВПО СФУ, Красноярск) (рис. 8.6) предназначен для регистрации флуоресценции в красной спектральной области (> 650 нм) у гомогенных суспензий клеток водорослей, цианобактерий. Встроенный микропроцессор позволяет управлять работой прибора в полуавтоматическом режиме. Рабочее состояние прибора и интенсивность сигнала флуоресценции отображаются на ЖК дисплее. Источником возбуждающего света служит мощный белый светоизлучающий диод.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
393 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
Рис. 8.6. Общий вид планктофлуориметра ПФЛ3004-СИД
Выделение четырех спектральных полос возбуждающего света осуществляется на основе светофильтров 390-620 нм и четырьмя степенями интенсивности от 15 до 150 Вт/м2 : λmax – 410; 510; 540 нм. Перемешивание содержимого кюветы происходит за счет вращающегося отрезка магнитной резины.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
394 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА8.1 ОЦЕНКАФУНКЦИОНАЛЬНОЙАКТИВНОСТИ ФОТОСИНТЕТИЧЕСКОГОАППАРАТАНАПРИМЕРЕЛИСТЬЕВВЫСШИХ РАСТЕНИЙ
 Функциональную активность фотосинтетического аппарата листа характеризуют параметры световой кривой фотосинтетического транспорта электронов.
Функциональную активность фотосинтетического аппарата листа характеризуют параметры световой кривой фотосинтетического транспорта электронов.
 Цель лабораторной работы
Цель лабораторной работы
•сравнительная оценка функциональной активности фотосинтетического аппарата у листьев разного возраста в различных зонах листа.
 Материалы и оборудование
Материалы и оборудование
1.Флуориметр Junior-PAM («Walz», Германия) (рис. 8.2); Специа-
лизированное программное обеспечение (WinControl, www.walz.com), установленное на Windows PC.
2.Светозащищенный бокс размером 20×20×40 см для адаптации объекта к темноте.
3.Растения пшеницы (овса) в фазе третьего листа, выращенные на искусственной среде в песчаной или водной культуре.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 8.1.1. Сравнительная оценка функциональной активности фотосинтетического аппарата у листьев разного возраста вразличных зонах листа
Порядок выполнения работы
1.Осторожно, не повреждая корней, извлечь растение из вегетационного сосуда, обернуть корни влажной салфеткой; поместить растение в светозащищенный бокс на 20-30 мин.
2.Ознакомиться с устройством и инструкцией по эксплуатации флуо-
риметра Junior-PAM.
3.Привести флуориметр в рабочее состояние согласно инструкции по эксплуатации, используя магнитный фиксатор листа.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
395 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА 8.1 ОЦЕНКА ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА
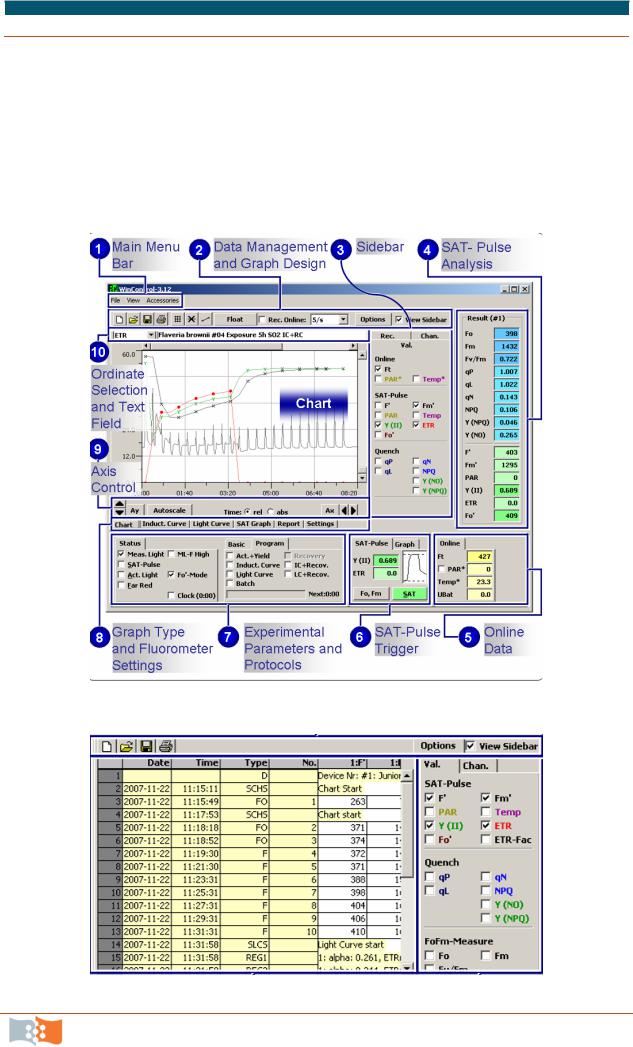
4.Запустить программу WinControl на ПК.
5.Поместить лист в магнитный фиксатор верхней частью к световоду, контролируя положение по центру отверстия.
6.Активировать страницу WinControl для коррекции предварительных установок  .
.
7.Проверить соответствие текущих установок флуориметра, рекомендованным изготовителем согласно рис. 8.7. При необходимости внести изменения.
Рис. 8.7. Окно текущих установок флуориметра
8.Активировать рабочую страницу WinControl (рис. 8.8.).
9.Установить во вкладке STATUS функцию Far Red.
10.Активировать функцию Light Curve во вкладке PROGRAM. Программа автоматически запускает регистрацию световой кривой фотосинтеза, при этом открывается специальное окно (рис. 8.9), на котором отображается выполнение программы. Программа останавливается автоматически после завершения.
11.Активировать вкладку REPORT. В правой части окна выделить отображаемые параметры: Fm’ (максимальный уровень флуоресценции), PAR (фотосинтетически активная радиация, мкмоль квантов×м–2×с–1), Y(II) (кван-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
396 |
РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА 8.1 ОЦЕНКА ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА
товый выход ФСII), ETR (скорость электронного транспорта, мкмоль электронов × м–2 × с–1).
12.Провести измерения световой кривой у листьев каждого яруса у основания, в середине и верхушке листа.
13.Сохранить файл отчета.
14.Перенести данные из REPORT в итоговую табл. 8.1.
Рис. 8.8. Страница WinControl
Рис. 8.9. Страница выполнения программы
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
397 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА 8.1 ОЦЕНКА ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА
Таблица 8.1
Параметры, отражающие фотосинтетическую активность
Вариант опыта |
|
Регистрируемые параметры |
|
|
Fm’, при PAR=0 Y(II), при PAR=0 ETRmax α Ik |
Нижний лист |
Основание |
|
|
Середина |
|
|
Верхушка |
|
Средний лист |
Основание |
|
|
Середина |
|
|
Верхушка |
|
Верхний лист |
Основание |
|
|
Середина |
|
|
Верхушка |
|
где ETRmax – максимальная скорость электронного транспорта; α – тангенс угла наклона линейного участка световой кривой; Ik – интенсивность света, характеризующая переход от линейного к стационарному участку световой кривой.
15. Проанализировать результаты. Сделать вывод о возможном влиянии на фотосинтез таких факторов, как возраст листа и расположения места регистрации флуоресценции на листовой пластинке.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
398 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА8.2. ФЛУОРЕСЦЕНТНЫЙКОНТРОЛЬСКОРОСТИРОСТАИ ПОТЕНЦИАЛЬНОЙФОТОСИНТЕТИЧЕСКОЙАКТИВНОСТИКЛЕТОК МИКРОВОДОРОСЛЕЙ(ЦИАНОБАКТЕРИЙ) ВКУЛЬТУРЕ
 Краткие теоретические сведения
Краткие теоретические сведения
Контроль скорости роста микроводорослей (цианобактерий) основан, с одной стороны, на связи интенсивности флуоресценции с концентрацией хлорофилла (уравнение 8.2), с другой – на связи хлорофилла с биомассой.
Показателями, связанными прямой зависимостью с содержанием хлорофилла, могут быть максимальные уровни флуоресценции, которые регистрируются в момент первой насыщающей вспышки света (Fm) или после добавления к суспензии клеток ингибитора электронного транспорта диурона (F+diuron) в конечной концентрации 10−5 М (рис. 8.1).
Потенциальную фотосинтетическую активность клеток водорослей (цианобактерий) характеризует вариабельная луоресценция:
|
− |
|
(8.3) |
где , − соответственно нулевой и максимальный уровени флуоресценции во время первой насыщающей вспышки света (рис. 8.1). Величина этого параметра изменяется от нуля (культура не способна к фотоавтотрофному росту) до 0,5 (цианобактерии) и 0,7 (водоросли) – культура имеет высокую потенциальную фотосинтетическую активность.
Стационарную фотосинтетическую активность на актиничном свету заданной интенсивности характеризует вариабельная флуоресценция, рассчитанная по формуле:
|
− |
|
(8.4) |
при использовании РАМ флуориметра или по формуле:
|
+diuron− |
+diuron |
(8.5) |
при использовании флуориметра с источником постоянного света.
 Материалы и оборудование
Материалы и оборудование
1.Флуориметр PHYTO PAM (рис. 8.3) и/или планктофлуориметр ПФЛ 3004 СИД.
2.Культиватор вращающийся КВМ-05 (рис. 8.5).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
399 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА8.2. ФЛУОРЕСЦЕНТНЫЙ КОНТРОЛЬ СКОРОСТИ РОСТА И ПОТЕНЦИАЛЬНОЙ ФОТОСИНТЕТИЧЕСКОЙ АКТИВНОСТИ КЛЕТОК
3.Ручной гомогенизатор клеток (пластиковый).
4.Автоматические пипетки постоянного объема 50 и 100 мкл, переменного объема на 1000 мкл.
5.Маточные растворы для приготовления культуральной среды (см. работу 8.1.).
6.Спиртовый раствор диурона (10-3 М).
7.Накопительная культура зеленой водоросли Chlorella vulgaris или цианобактерии Anabaena sp.
8.Световой микроскоп Primo Star (Carl Zeiss, Германия).
9.Камера Горяева.
10.Колбы конические 250 мл 2 шт.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 8.2.1. Изучение влияния начальнойконцентрации клеток на параметры роста культуры и ее потенциальной фотосинтетической активности
Порядок выполнения работы
1.Ознакомиться с конструкцией и правилами работы флуориметра PHYTO PAM и планктофлуориметра ПФЛ 3004 СИД подготовьте приборы к работе.
2.Определить титр (количество клеток в мл) накопительной культуры зеленой водоросли Ch. vulgaris (см. работу 8.1.). Перед определением титра
культуру рекомендуется профильтровать через мелкоячеистый газ и тщательно гомогенизировать ручным гомогенизатором.
3. Составить схему закладки опыта по табл. 8.2.
|
|
|
|
|
Таблица 8.2 |
|
|
|
|
|
|
||
|
Количест- |
Титр культуры, 103 кл/мл |
|
Время реги- |
||
Варианты |
во по- |
Накопитель- |
В начале экс- |
Разведе- |
страции |
|
вторно- |
ние |
флуоресцен- |
||||
|
ная |
перимента |
||||
|
стей |
|
ции, ч |
|||
|
|
|
|
|||
1 |
6 |
1300* |
50 |
В 26 раз |
0, 6* |
|
2 |
6 |
1300* |
500 |
В 2.6 раза |
0, 6* |
|
3 |
6 |
1300* |
50 |
В 26 раз |
0, 24* |
|
4 |
6 |
1300* |
500 |
В 2,6 раза |
0, 24* |
|
*) величины указаны в качестве примера
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
400 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА8.2. ФЛУОРЕСЦЕНТНЫЙ КОНТРОЛЬ СКОРОСТИ РОСТА И ПОТЕНЦИАЛЬНОЙ ФОТОСИНТЕТИЧЕСКОЙ АКТИВНОСТИ КЛЕТОК
4.Приготовить по 250 мл каждого варианта экспериментальной культуры Ch. vulgaris из накопительной культуры в соответствии с проведенными расчетами. Использовать культуральную среду для разбавления.
5.Измерить сигналы флуоресценции у каждой приготовленной культуры водорослей и фоновые значения флуоресценции культуральной среды.
Использовать режим регистрации световой кривой при работе на PHYTO PAM. Регистрируемые параметры: Fm – максимальный уровень флуоресценции на первой ступени записи световой кривой, Y(II) – квантовый выход ФСII на первой ступени регистрации световой кривой, ETRmax – максимальная скорость электронного транспорта, достигнутая при регистрации световой кривой. Необходимо контролировать уровень чувствительности.
Использовать режим возбуждения белым светом низкой интенсивности (Б1) при работе на планктофлуориметре ПФЛ 3004 СИД. Зарегистрировать последовательно стационарный уровень флуоресценции (Fst), максимальный уровень (F+diuron) после добавления к суспензии водорослей 0,1 мл раствора диурона (10−3 М). Используйте флуоресценцию эталона для контроля чувствительности.
Занести результаты в бланк регистрации.
6. Разлить в чистые зараннее приготовленые пеницилиновые флаконы приготовленные культуры с различным содержанием клеток водорослей Поместить флаконы в гнезда вращающегося культиватора, отметить в журнале время начала опыта и включите культиватор. Время культивирования водорослей зависит от их физиологических особенностей. Высокотемпературный штамм зеленой водоросли Ch. vulgaris (при 30-32 оС) требует относительно короткого периода культивирования – 24 часа.
7.Измерить сигналы флуоресценции водорослей через 6 и 24 ч после начала культивирования в соответствии п.5. Каждый раз из культиватора брать по шесть флаконов. Заносить результаты в бланк регистрации.
8.Обработка результатов.
Обработать статистически результаты, полученные с помощью флуориметра PHYTO PAM, рассчитав среднее значение и ошибку среднего у каждого из трех зарегистрированных параметров: Fm, Y(II) и ETRmax.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
401 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА8.2. ФЛУОРЕСЦЕНТНЫЙ КОНТРОЛЬ СКОРОСТИ РОСТА И ПОТЕНЦИАЛЬНОЙ ФОТОСИНТЕТИЧЕСКОЙ АКТИВНОСТИ КЛЕТОК
В случае использования планктофлуориметра ПФЛ 3004 СИД необходимо рассчитать чистые сигналы флуоресценции. Чистый сигнал флуоресценции представляет собой разницу между сигналом флуоресценции пробы фитопланктона и сигналом флуоресценции фильтрата этой же пробы, нормированные по уровню флуоресценции эталона:
Fчистый = Fпробы |
− |
|
Fфильтрат |
(8.6) |
|||
|
Fэталон |
|
|
|
|
, |
|
|
|
|
Fэталон |
|
|||
где Fпробы – флуоресценция пробы водорослей, Fэталон – флуоресценция |
|||||||
эталона, зарегистрированная при |
|
той же чувствительности, |
Fфильтрат – |
||||
флуоресценция фильтрата, зарегистрированная при той же интенсивности возбуждающего света. Для оценки вариабельной флуоресценции водорослей использовать формулу 8.5;
Заполнить табл. 8.3 после окончания эксперимента.
|
|
|
|
|
|
|
|
Таблица 8.3 |
|
|
|
|
|
|
|
|
|
Вари- |
Время, |
|
PHYTO-PAM |
|
|
ПФЛ 3004 СИД |
||
ант |
час |
Fm |
|
Y(II) |
|
ETRmax |
F+diuron |
F’var |
1 |
0 |
|
|
|
|
|
|
1 |
1 |
6 |
|
|
|
|
|
|
|
2 |
0 |
|
|
|
|
|
|
|
2 |
24 |
|
|
|
|
|
|
|
3 |
0 |
|
|
|
|
|
|
|
3 |
6 |
|
|
|
|
|
|
|
4 |
0 |
|
|
|
|
|
|
|
4 |
24 |
|
|
|
|
|
|
|
9.Проиллюстрировать полученные результаты графиками.
10.Проанализируйте влияние начальной концентрации клеток на параметры роста культуры и ее потенциальной фотосинтетической активности.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
402 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА8.3. ВЫЯВЛЕНИЕРАСТЕНИЙСНАРУШЕНИЯМИВСИНТЕЗЕ ХЛОРОФИЛЛ-БЕЛКОВЫХКОМПЛЕКСОВ
 Цель лабораторной работы
Цель лабораторной работы
•оценка различий в составе хлорофилл-белковых комплексов по изменению параметров нормированной на площадь интенсивности флуоресценции, квантового выхода ФСII и световой кривой фотосинтеза.
 Материалы и оборудование
Материалы и оборудование
1.Флуориметр IMAGING-PAM модуль MAXI (рис. 8.4).
2.Растения ячменя (Hordeum sp) в возрасте третьего листа с нормальным и мутантным (chlorina-f2) генотипами.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 8.3.1. Оценка различий в составе хлорофилл-белковых комплексов по изменению нормированнойнаплощадь интенсивности флуоресценции, снижению квантового выхода ФСII и изменению параметров световой кривой фотосинтеза
Порядок выполнения работы
1.Ознакомьтесь с конструкцией и правилами работы флуориметра
IMAGING-PAM модуль MAXI.
2.Включите РС и флуориметр согласно инструкции.
3.Извлеките нормальные и мутантные растения из вегетационных сосудов, не повреждая корней; оберните корни влажной салфеткой и поместите растения в светозащищенный бокс на 20-30 мин.
4.Ознакомьтесь с устройством и инструкцией по эксплуатации флуо-
риметра IMAGING-PAM с модулем MAXI.
5.Приведите флуориметр в рабочее состояние согласно инструкции по эксплуатации.
6.Запустите установленную на РС программу.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
403 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА 8.3. ВЫЯВЛЕНИЕ РАСТЕНИЙ С НАРУШЕНИЯМИ В СИНТЕЗЕ ХЛОРОФИЛЛ-БЕЛКОВЫХ КОМПЛЕКСОВ
7.Поместите листья нормального (3 шт.) и мутантного ячменя (3 шт.) на предметную площадку флуориметра, установите площадку в рабочее положение.
8.Установите зоны регистрации флуоресценции (обычно средняя часть листа) на основе изображения на экране компьютера.
9.Запустите программу регистрации световой кривой.
10.Сохраните файл после выполнения программы.
11.Откройте окно REPORT. Перенесите в итоговую таблицу следующие параметры: Fm и Y(II) при интенсивности PAR равной нулю, ETRmax.
12.Сохраните визуализированные параметры флуоресценции Fm и Y(II)
унормальных и мутантных растений ячменя (формат файла *.jpg).
13.Определите степень различий нормального и мутантного растений, сопоставив средние значения зарегистрированных параметров флуоресценции.
14.Сделайте выводы относительно эффективности использования энергии возбуждения молекулами хлорофилла ФС2 и о характере изменений
ворганизации хлорофилл-белковых комплексов.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
404 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА8.4. КОНТРОЛЬРАЗВИТИЯФОТОСИНТЕТИЧЕСКОГОАППАРАТАПРИ МОРФОГЕНЕЗЕКЛЕТОКВКУЛЬТУРЕТКАНЕЙРАСТЕНИЙ
Биогенез фотосинтетического аппарата в клетках каллусной культуры, развитие фотосинтетического аппарата в период ее дифференциации и при последующем морфогенезе растений является важными показателями в экспериментах с использованием культуры тканей растений.
Контроль этих процессов проводят на основе регистрации флуоресценции хлорофилла с помощью флуориметра IMAGING-PAM, модуль MAXI (см. работу 8.3). Показателем способности каллусных клеток к автотрофному росту служит величина квантового выхода ФСII и максимальная скорость электронного транспорта при регистрации световой кривой. Флуориметр IM- AGING-PAM с модулем MINI позволяет обнаружить локализацию клеток каллуса с максимальной фотосинтетической активностью.
 Материалы и оборудование
Материалы и оборудование
1.Флуориметр IMAGING-PAM модули MAXI и MINI (рис. 8.4).
2.Каллусы на разных стадиях дифференциации, выращенные на чашках Петри.
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 8.4.1. Зафиксировать локализациюклетоккаллуса с максимальной фотосинтетической активностью
Порядок выполнения работы
Последовательность операций описана в работе 8.3. Каллусы не вынимая из чашек Петри, помещают в камеру MAXI модуля или на предметное стекло MINI модуля и производят регистрацию световой кривой фотосинтеза.
 Контрольные вопросы
Контрольные вопросы
1. Какова природа флуоресценции хлорофилла в растительных объек-
тах?
2.Какие процессы фотосинтеза и каким образом влияют на квантовый выход флуоресценции хлорофилла?
3.На основании каких свойств флуоресценции возможен контроль скорости роста микроводорослей и цианобактерий?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
405 |

РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
РАБОТА8.4. КОНТРОЛЬ РАЗВИТИЯ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА ПРИ МОРФОГЕНЕЗЕ КЛЕТОК В КУЛЬТУРЕ ТКАНЕЙ РАСТЕНИЙ
4.Какие флуоресцентные показатели позволяют оценить потенциальную фотосинтетическую активность?
5.Какие флуоресцентные показатели позволяют оценить характер структурной организации фотосинтетического аппарата?
6.Почему для исследования растений с нарушенными хлорофиллбелковыми комплексами и каллусных культур целесообразно использовать флуориметры серии IMAGING-PAM?
7.Предложите задачи в области биотехнологии и экологии растений, решение которых требует применения флуоресцентных методов.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
406 |
